【トピックス】
酵素と抗体は兄弟だった
一二三恵美
大分大・研究マネジメント機構
1.はじめに
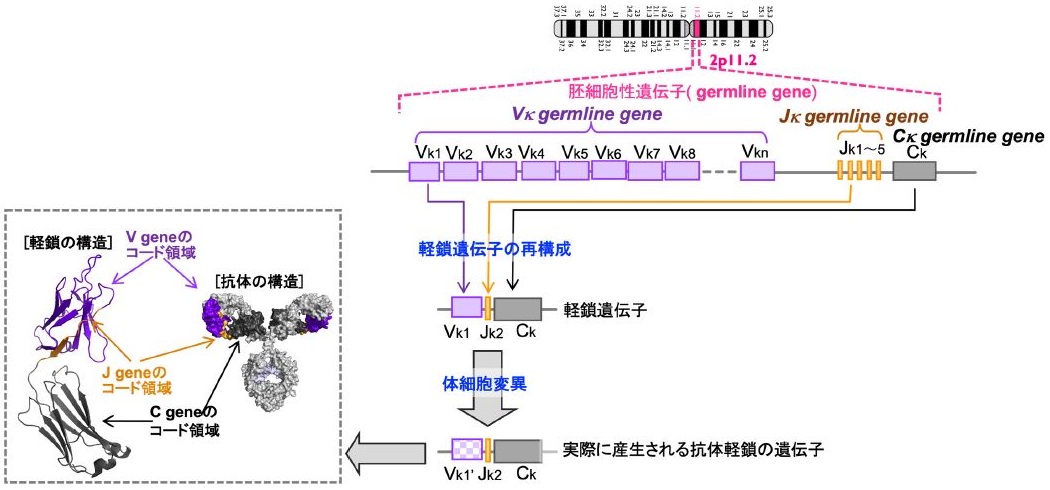
本稿執筆の依頼を受けて、2004年高分子学会誌の「特集:高分子とバイオテクノロジー」に寄稿した「酵素と抗体は兄弟?」が浮かんだ1)。1996年にモノクローナル抗体の軽鎖が抗原タンパクを分解する現象に出会い、その後、作製方法の確立を進めていた頃のことである2)。抗体軽鎖可変領域の約90%をコードするV 遺伝子の種類と、抗原分解活性の関連性について独自の知見を提唱する中で、執筆したものであった (図1)。

このV遺伝子の種類に着目する手法で抗体酵素の作製を行ってきたが、一定の成果は得たものの筆者らのグループはもとより、抗体酵素の実用化には至っていない。その理由は明確で、高い機能を有する抗体酵素の作製には、多大な時間と労力を必要とするからである。この点を打開すべく、抗体酵素の高活性化についての検討を進める中で、僅か1残基の変異が軽鎖型抗体酵素の機能に大きく影響することを見出した。これは、「酵素と抗体は兄弟?」と結び付く知見であり、この手法を使えば、全世界で作製されてきた“高性能の抗体”を、抗体酵素に変換することが出来る。本トッピックスでは一連の基礎研究に焦点を当てながら、応用的研究へと繋げる話題を提供したい。
2.S35およびS38クローンとの出会い
2-1 S35, S38クローンのアミノ酸配列と酵素活性
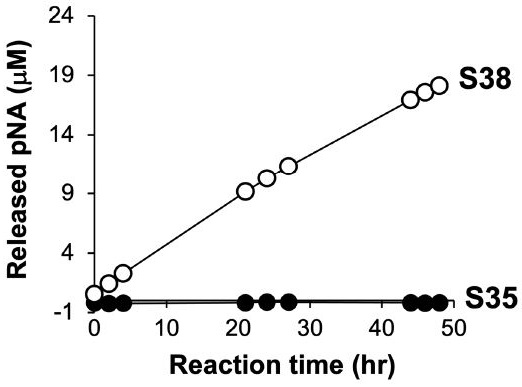
S35, S38クローンは、健常人末梢血由来のBリンパ球から抗体酵素として機能する可能性の高いκ型軽鎖遺伝子のライブラリーを作製し、発現させたものである。数百種類の遺伝子を大腸菌で発現・精製し、「抗体酵素バンク」として取り扱っている。両クローン可変領域の配列をIMGT(the international ImMuno GeneTics information system)分類のVκ germline gene 配列と共に示す ( 図2)。S35のV geneにはVκ germline gene VK2/2D-28*01のままで体細胞変異は入っていない。S38は95位のPro (Pro95)の欠失があるだけで、軽鎖全長219残基の中でS35とS38の違いは僅か1残基である。ところが両者の酵素活性には明確な違いが現れた (図3)。合成基質のArg-pNAに対する加水分解活性を調べたところ、S35クローンでは、推定していた酵素活性サイト (TrypsinなどのSerine proteaseの活性中心に見られる触媒三ツ組残基。Asp, His, Serより成る。) は機能しなかったのに対して、S38はArg-pNAを分解した (詳細は後述)。にわかには信じ難い現象であったため、精製ロットや担当者を変えてみても同じ現象が起こったことから、Pro95に着目した検討を開始することにした。

![]()
2-2 S38によるR-pNAの切断活性
抗体酵素の酵素活性のスクリーニングには、市販の合成基質を用いることが多い。Matsuuraら4)やDurovaら5)は、合成基質のArg-pNA (R-pNA) やGlu-pNA、LeupNA、Ala-pNA、Phe-pNaなどを用いて酵素活性を調べている。S38は、R-pNA (Trypsin用基質) のみを分解した。そこで、これを使った速度論的解析を行うと、Hanes-Woolf plotに於いて[s]と[s]/vにR2=0.9903の相関関係が成立し、Michaelis-Mentenの式に従う酵素反応であることが確認出来た。この反応に於けるkcatは4×10-3 min-1、Kmは3.6×10-4 Mであった6)。これらの値は、R-pNAを基質としてBence-Jonesタンパク質 (多発性骨髄腫患者の体内でがん化したB細胞が産生するモノクローナルな抗体軽鎖。尿中から検出されることが多い。) のMORクローンを分析したMatsuura らの結果 (kcat = 7 × 10-2 min-1, Km = 0.21 × 10-4 Mや7)、DurovaらのPRF-MCAを基質としたモノクローナル抗体L12クローン軽鎖の分析結果 (kcat = 1.55 × 10-3 min-1, Km = 5.3 × 10-4 M)8)と同等であった。
3.κ型軽鎖で高度に保存されたPro95
S35、S38クローンの結果を受けて、κ型軽鎖Pro95の保存性について調べた。図4には、ヒトVκ germline geneの主な遺伝子について56位から95位の配列を示した。多様性に富むCDR3領域にありながら、殆どの遺伝子で95位にProが配置されていることが分かる。次に筆者が所有している抗体酵素バンクのアミノ酸配列から、体細胞変異の入り方を調べたものが図5である。図5(a) は、95位にProを持つVκ germline gene IGKV2-29*02を使用している21クローンの配列を示した。Pro95に変異が入っていたのは僅かに1クローンであった。一方、95位にProを持たないVκ germline gene IGKV1-5*03を使っているクローンについて纏めたものが図5(b)である。11クローンのうちの7クローンでProへの置換が認められた。これらの事実は、κ型軽鎖が抗体軽鎖としての役割を担う上で、Pro95が重要な役割を担うことを示唆している。
![]()

4.Pro95欠失によるκ型軽鎖の酵素活性発現
4-1 T99クローン
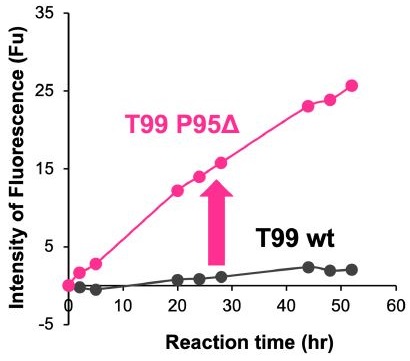
Pro95欠失による酵素活性の発現が、抗原認識部位に酵素活性サイト様の構造を備えた抗体軽鎖に於いて共通する現象か否かを検証する必要がある。特に体細胞変異の影響は大きいと考えられるため、抗体酵素バンクの中で触媒三ツ組残基様構造を持つと推定されながら酵素活性を発揮しないクローンを使って検証することにした6)。T99クローンは、V gene領域の体細胞変異が16残基と、抗体酵素バンクの中でも高頻度の体細胞変異を伴うクローンである。種々の基質に対する分解試験を行ったが、分解活性は認められなかった。ところが、Pro95を欠失させたT99-Pro95Δは、N末端に7-MCA、C末端にDNPを導入することでFRET修飾したAmyloid-β (26-33) peptide (FRET-Aβ peptide) を加水分解した (図6)。この反応もMichaelis-Menten式に従う酵素反応であることが確認出来た(Aβ 1-40 peptideの分解も確認)。

4-2 H34クローン
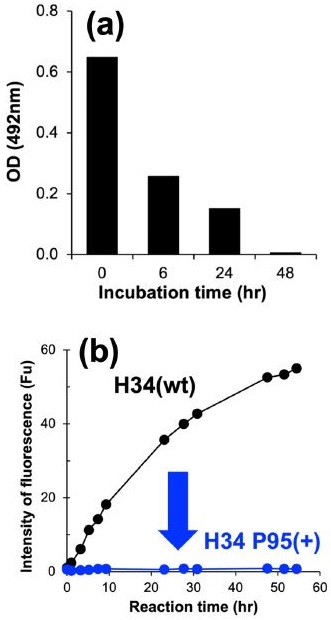
H34クローンも、抗体酵素バンクに含まれるヒトκ鎖型抗体酵素である。触媒三ツ組残基様構造は確認出来なかったが、免疫チェックポイントPD-19)分子を切断する能力を有する10)。このクローンは、V geneとして95位がSerであるVκ germline gene VK1-5*03を用いており、95位はSerからArgへの体細胞変異が入っている (図5(b))。H34クローンがrec PD-1 (Recombinant human PD-1, V5-tag付き, Enzo製) を分解することは電気泳動により確認出来たので、分解を受けたrec PD-1のPD-L1との結合能消失を調べることにした。rec PD-1にH34クローンを37°Cで6, 24, 48時間反応させた反応液を回収し、rec PDL1(Recombinant human PD-L1, Enzo製)を固相化したELISAプレートに加えて反応させた。rec PD-L1に結合したrec PD-1を、HRP標識抗V5-tag抗体で検出した結果を図7(a)に示した。rec PD-L1に結合したrec PD-1は経時的に減少し、48時間で完全に消失した。これがH34クローンの抗体としての結合阻害反応であるならば、2時間程度で平衡に達し、上述の結果にはならない。recPD-1はH34クローンにより分解されて、PD-L1との結合能を消失したと結論付けた。

このH34クローンは、Pro95を持たないため、95位にProを挿入して酵素活性の変化を調べることにした。FRET修飾したPD-1 peptideを基質とした分解試験の結果を図7(b)に示した。H34 Pro95(+)は、PD-1 peptideに対する分解能を完全に失った。この結果は、触媒三ツ組残基に限らず、超可変領域近傍に存在する酵素活性サイトの機能発現において、Pro95が強く影響を及ぼすことを示す重要な知見である。
4-3 マウスモノクローナル抗体軽鎖への適用
(Inf A mAbシリーズ)
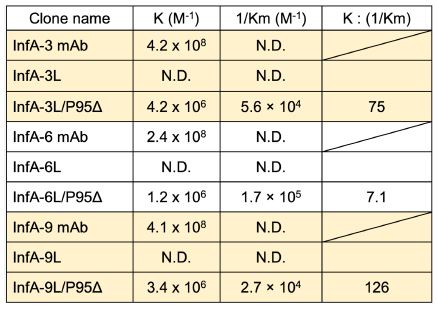
これまで調べてきたのは、ヒト型のκ鎖であった。1976年のKoller & Milstein11)の細胞融合法によるモノクローナル抗体作製の発表以来、全世界でモノクローナル抗体が作製・利用されている。その多くはマウス型抗体であることから、Pro95欠失変異導入による酵素化を試みることにした。モノクローナル抗体InfA-3, -6, -9の3クローンは、A型インフルエンザウイルスヘマグルチニンの保存領域を標的として作製したモノクローナル抗体である12)。軽鎖可変領域に触媒三ツ組残基を持つと推定されたが、酵素活性サイトとして機能しなかった。そこで、Pro95を欠失させた変異体を作製し、FRET修飾した抗原ペプチドに対する分解試験を行ったところ、3クローンとも抗原ペプチドに対する分解能を獲得した13)。これらの抗体は、先に述べた抗体酵素バンクとは異なり免疫原が明確であるため、Michaelis-Menten定数 (Km) と化学的親和性定数 (K) の相関を調べた (表1)。親和性定数(K)は、ELISAにより測定した。なお、完全抗体の親和性定数は、既報の等温滴定カロリメトリーで得られた値と同じオーダーであった(一般的に軽鎖のK値は完全抗体の1/100 〜 1/1000となり、等温滴定カロリメトリーでは検出限界以下である)。ELISAによる測定結果を見ると、野生型軽鎖の免疫学的抗原親和性 (K) は、いずれも検出限界以下であったのに対して、Pro95を欠失させた変異体は、完全抗体の約1/100とELISAで分析可能なレベルまで強くなった。一方、抗原ペプチド分解の速度論的解析で得たKmの逆数である1/Km値は、触媒活性部位への基質の結合親和性に対応する。これらの値を比較すると、軽鎖Pro95欠失変異体 (L/P95Δ) の免疫学的親和性 (K) と基質親和性 (1/Km) には数十倍程度の開きがあることから、抗原認識部位と酵素活性サイトは異なると考えられた。変異導入によって抗原親和性が強くなり、酵素活性サイト近傍への抗原ペプチドの保持力が向上したことも、抗原分解活性の発現に寄与していると考えられる。これらの変異体は、in vitroでのインフルエンザウイルス感染抑制試験においても抑制効果を示すようになったことを付け加えておきたい。

抗体酵素の実用化を考えると、マウスのモノクローナル抗体の酵素化に成功したことの意義は大きい。筆者がこれまで検討してきたのは、超可変領域近傍に触媒三ツ組残基様構造を持つと推定されるκ型軽鎖である。データベースを用いた解析の結果から、ヒトの場合、κ型軽鎖の中で触媒三ツ組残基様構造を持つクローンの割合は約10%、κ型軽鎖とλ型軽鎖の割合はほぼ等しいことから、着目している遺伝子を持つ抗体の割合は、全体の5%ほどしか存在しない。しかしながら、マウスの場合は、軽鎖の95%がκ型であるのに加え、触媒三ツ組残基を持つと推定されるV遺伝子を持つクローンの割合が40%にも及ぶ。つまり、酵素化出来る抗体の割合はマウスの方が格段に高いのである。既に反応性が吟味された 「優秀なモノクローナル抗体」には、酵素化が可能なものが多数眠っていると推定される。
4-4 抗体医薬品への適用
ヒト型、マウス型抗体軽鎖の酵素化に成功したことから、抗体医薬品の酵素化に着手した。まだ検討段階であるが、いくつかのデータを紹介したい (尚、本節は論文執筆中なので、概略に留めたく、ご容赦願いたい)。現在、検討を進めているのはHuman Epidermal growth factor Receptor 2 (HER2)高発現の転移性乳がんに対する抗体医薬品として開発されたTrastuzumab (商品名 Herceptin)である。Trastuzumabのアミノ酸配列は公開されており、軽鎖の95位と96位に連続してProが存在することから、Pro95とPro96の両方を欠失させることにした。まずは、野生型のL鎖全長とPro95Δ・Pro96Δの変異を導入した変異体を作製すると、変異導入によってFRET-HER2 peptideに対する分解活性は顕著に高くなったが、特異性に問題があった。そこで、上述の変異を導入した単鎖可変領域フラグメント(Single chain Fv; ScFv)を作製した。このTrastuzumab scFv Pro95 ΔPro96Δ (Tmb scFv PPΔ ) のFRET-HER2 peptideに対する分解活性は、L鎖変異体(Tmb-L PPΔ)より若干低いものの、対照として使用した非抗原ペプチドは分解しなかった。そこで、HER2高発現の乳がん細胞株を用いる細胞傷害性試験を行った。標的分子のHER2は、ヒト上皮成長因子受容体の1つで、2量体を形成すると分化・増殖のシグナル伝達が起こる。Trastuzumabは、他の抗体医薬品と同様の抗体依存性細胞傷害 (Antibody-dependent cellular cytotoxicity; ADCC) 以外にも、HER2 homodimer形成阻害による増殖抑制効果が知られている。そこで、ADCCとHER2以外の成長因子受容体による2量体形成を排除した条件、即ち、HER2 homodimer形成のみが起こる条件での細胞傷害性試験を行った。すると、Trastuzumabでは、HER2 homodimer形成阻害による増殖抑制 (増えはしないが、死にもしない) が認められたのに対して、Tmb scFv PPΔでは顕著な細胞死が起こった。固形がん組織には、リンパ系組織が発達しにくく、ADCCに関与する免疫系細胞が入りにくいことや、病状の進行に伴う免疫機能の低下を考慮すると、抗体分子単独でがん細胞死を誘導出来たことの意義は大きい。
5.おわりに
冒頭で述べた経緯から、筆者らは抗体鎖、主に軽鎖型の抗体酵素を扱ってきた。マウスモノクローナル抗体に由来するクローンも多数扱ってきたが、完全抗体で酵素活性を検出した例は無い。この理由としては、重鎖と軽鎖から成る可変領域を形成することで、酵素活性サイトがマスクされることや、抗原親和性が強すぎて切断片のリリースが起こりにくく、回転しなくなるのではないかと考えていた。実際、Okochiら14)によって、触媒三ツ組残基を持つ軽鎖を酵母にディスプレーさせると酵素活性が検出されるのに対して、重鎖を合わせたAntigen-binding fragment (Fab)として発現させると、酵素活性が消失する例が報告されている。Trastuzumabの場合も、完全抗体では抗原分解活性は検出されず、野生型のscFvでは、極めて低い抗原ペプチド分解が検出される程度であったが、Pro95・Pro96の欠失によって高い抗原分解能を獲得し、がん細胞を傷害するという機能を発揮した。これまで調べた全てのクローンで、変異導入により抗原親和性は強くなっているので、抗原親和性とkcatに直接的な関係は無いようである。scFvの酵素化については、複数のクローンで確認する必要はあるものの、抗原特異性への懸念は払拭出来ることから、天然型抗体酵素の実用化に向けて大きな一歩を踏み出すことが出来たと感じている。
高分子学会誌に寄稿した2004年には「酵素と抗体は兄弟?」であったが、20数年の基礎研究を経て「?」を外して「酵素と抗体は兄弟」と言えるようになった。抗体酵素は、抗体と酵素の中間的な性質を有しており、κ型軽鎖Pro95の欠失により、酵素に近い性質を示すようになる。λ型軽鎖や重鎖にも、同じようなキーになるアミノ酸残基が存在するかも知れないし、κ型軽鎖についても、より酵素に近づけるためにキーになる他のアミノ酸残基が存在するかも知れない。
謝辞
本研究は、科学研究費補助金 (16H2282, 20K21255)、JST未来社会創造事業、JST戦略的創造研究推進事業 (CREST) による支援を受けて実施した。
文献
1) 宇田泰三, 一二三恵美:高分子, 53, 859 (2004).
2) Hifumi, E., Mitsuda, Y., Ohara, K., Uda, T.: J. Immunol. Methods, 269, 283 (2002).
3) Kabat, E. A., Wu, T. T., Reny, H. M., Gottesman, K. S., Foeller, C.: Sequence of proteins of immunological interest, 5th ed. vol. 1-3, 91 (1991).
4) Matsuura, K., Yamamoto, K., Shinohara, H.: Biochem. Biophys. Res. Commun., 204, 57 (1994).
5) Durova, O. M., Vorobiev, I. I., Smirnov, I. V., Reshetnyak, A. V., Telegin, G. B., Shamborant, O. G., Orlova, N. A., Genkin, D. D., Bacon, A., Ponomarenko, N. A., Friboulet, A., Gabibov, A. G.: Mol. Immunol., 47, 87 (2009).
6) Hifumi, E., Taguchi, H., Tsuda, H., Minagawa, T., Nonaka, T., Uda, T.: Sci. Adv., 6, 13, eaay6441 (2020).
7) Matsuura, K., Yamamoto, K., Shinohara, H.: Biochem. Biophys. Res. Commun., 204, 57 (1994).
8) Durova, O. M., Vorobiev, I. I., Smirnov, I. V., Reshetnyak, A. V., Telegin, G. B., Shamborant, O. G., Orlova, N. A., Genkin, D. D., Bacon, A., Ponomarenko, N. A., Friboulet, A., Gabibov, A. G.: Mol. Immunol., 47, 87 (2009).
9) Ishida, Y., Agata, Y., Shibahara, K., Honjo, T.: EMBO J., 11, 3887 (1992).
10) Hifumi, E., Taguchi, H., Nonaka, T., Harada, T., Uda, T.: RSC Chem. Biol., 2, 220 (2021).
11) Kohler, G., Milstein, C.: Nature, 256, 495 (1975).
12) Hifumi, E., Fujimoto, N., Ishida, K., Kawawaki, H., Uda, T.: J. Biosci. Bioeng., 109, 598 (2010).
13) Hifumi, E., Ito, Y., Tsujita, M., Taguchi, H., Uda, T.: Sci. Rep., 14, 12184 (2024).
14) Okochi, N., Murai, K. M., Kasonosono, T., Ueda, M.: Appl. Microbiol. Biotechnol., 77, 597 (2007).