【トピックス】
酵素によるタンパク質チロシン残基の化学修飾
佐藤伸一
東北大・学際研
1.はじめに
タンパク質の化学修飾技術は、抗体薬物複合体の開発やバイオマテリアルの革新を支える重要な技術として、近年ますます注目を集めている。非天然アミノ酸をタンパク質合成過程に導入し、部位特異的な化学修飾を施す試みや、タグ化されたタンパク質を発現し、sortase Aなどの酵素反応によりC末端を特異的に修飾する手法も進展しているが、本トピックスでは、天然タンパク質のチロシン残基 (Tyr) を標的とした選択的な酵素反応による化学修飾に焦点を当てる。
筆者は、天然タンパク質の機能を精密に制御するためのツールとして酵素分子に着目し、酵素工学の応用可能性を拡張するためのタンパク質化学修飾反応を研究してきた。特に、horseradish peroxidase (HRP) とlaccaseの2種類の酵素を活用したラジカル種の生成によるTyrの修飾とその応用について紹介する。
天然の20種類のアミノ酸残基の中で、信頼性高く修飾できるものはこれまで、リジン残基 (Lys) とシステイン残基 (Cys) に限られていた。これらの求核性残基は、求電子的な試薬を用いることで安定した結合が可能となり、LysやCysの化学修飾は、タンパク質機能化やイメージング、酸化ストレス研究など、幅広い生命科学分野で大きな役割を果たしてきた。しかし、他の18種類のアミノ酸残基に関しては、選択的で信頼性の高い修飾法がまだ確立されていないのが現状である。特にTyrは、(a) リン酸化、硫酸化、ジチロシン、酸化などの多様な翻訳後修飾を受ける、(b) タンパク質間相互作用、核酸-タンパク質間相互作用の界面に濃縮される、(c) ラジカル化され生体内で一電子移動反応を媒介する、などの特徴を持つ重要な残基である。そのため、Tyrの選択的修飾は新たな生命科学の発展の鍵になると期待される。しかし、天然アミノ酸残基に対する化学修飾法の開発には、以下のような課題がある。(1) 安定な結合の形成、(2) 高い反応効率、(3) 水中やバッファー中で進行する反応、(4) タンパク質の構造を保持するための中性付近のpHや低温条件での反応、(5) 残基選択的な反応、などが求められる。従来の有機化学的アプローチでは、有機溶媒中での検討で発見された反応を、生理的環境でも制御できるように調整するというアプローチで研究が進められてきたが、特に (3) や (4) の条件をクリアすることが困難であり研究障壁となっている。一方、酵素を用いた反応活性化のアプローチでは、初めからバッファー系で反応条件を最適化できるため、これらの課題を克服しやすい。低分子性触媒や反応性化学種の活用から修飾反応をデザインするアプローチに比べ、制御可能な反応の種類に制限はあるものの、酵素反応によるアプローチでは生体分子の修飾に適した反応条件での検討が可能である。
近年、タンパク質化学修飾の分野で着目される天然型タンパク質を化学修飾する酵素反応としては、改変ascorbate peroxidaseを使うAPEX法1)、改変biotin ligaseを使うBioID法2)、BioIDを高速化させたTurboID法3)といった手法が注目されており、proximity labelingと呼ばれる技術での応用が進んでいる。これらの手法では、酵素分子の周辺数十ナノメートル単位での近接空間で選択的にタンパク質をビオチン化し、ビオチン化されたタンパク質をnanoLC-MS/MSによって網羅的に解析することで、タンパク質複合体の構成因子同定や、タンパク質間相互作用、オルガネラ局在タンパク質の解析が可能になる。APEXは、修飾剤のチロシン模倣分子 (チラミ ド) をラジカル化し、BioID, TruboIDはビオチンを求電子性の高いbiotinyl-5’-AMPへと変換し、それぞれ電子豊富なアミノ酸残基、求核性のLysを酵素分子の近接環境で選択的に修飾する。本トピックスでは、これらの酵素反応と同様に、タンパク質修飾剤となる人工的な化合物を高反応性のラジカル種へと変換し、Tyrの効率的な修飾に応用した例を紹介する。
2.ヘム鉄による酸化反応を活用したチロシン残基修飾
2-1 チロシン残基修飾のための修飾剤開発
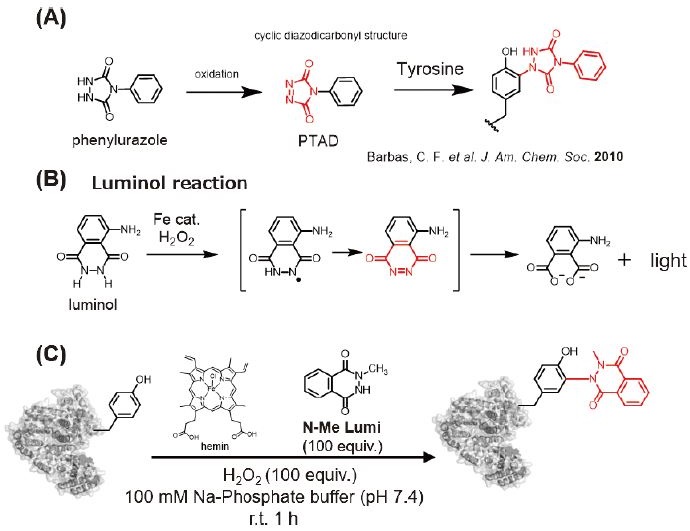
Tyrの修飾剤として、4-phenyl-1,2,4-triazoline-3,5-dione (PTAD) が知られていた4)。図1Aに示すPTADの前駆体であるフェニルウラゾールと構造的に類似している環状ヒドラジド構造を持つ分子として、ルミノールに注目した。ルミノール反応は、犯罪捜査でも使用されるよく知られた化学発光反応である (図1B)。この反応では、血液中のヘモグロビンのヘム構造が触媒として作用し、ルミノールを酸化し、ルミノールの酸化中間体からの脱窒反応 (–N2) によって化学発光が生じる。著者はルミノールの酸化中間体がPTADと類似のN=N結合を有する環状のdiazodicarbonyl構造を有することに着目し、これがTyrを修飾するのではないかと着想した。そこで、eminを触媒としてさまざまなルミノール誘導体で反応を試みたところ、ルミノール誘導体がTyr修飾剤としての活性を示すことを明らかにした。N-メチル化ルミノール誘導体 (N-Me Lumi) は化学発光反応を示さず、代わりに効率的にTyrを修飾した (図1C)5)。

反応メカニズムの詳細解析の結果、heminと過酸化水素 (H2O2) の反応によって生成される非常に反応性の高いcompound I ([PPIX] · + Fe(IV) O) によるN-Me Lumiの酸化反応が関与していると考えられる。さらなる調査から、N-Me Lumiは0.7 V (対Ag/AgCl) で一電子酸化されることが示唆され、当初想定したN=N結合の活性中間体ではなく、ラジカル種の発生を介してTyrと結合を形成することが分かった6)。N-Me Lumiの酸化によるラジカル化が鍵となるステップであるため、heminによる一電子酸化活性、すなわちperoxidase活性が本Tyr修飾反応の触媒活性に重要である。Peroxidaseなどの高活性の酵素を触媒として活用する話題に入る前に次小節では、peroxidase活性が向上するheminと核酸分子の複合体による反応制御を紹介したい。
2-2 Peroxidase活性が向上するヘム鉄と核酸の複合体を活用した核酸結合タンパク質同定
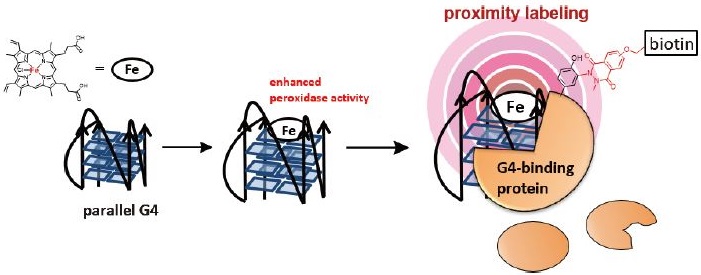
グアニン (G) 豊富な領域において形成される核酸の二次構造であるG-Quadruplex (G4) は、遺伝子の転写調節、テロメアの伸長、エピジェネティクス、DNA複製、RNA処理、メッセンジャーRNAの局在、翻訳の調節など、多くの生物学的機能に関与している。複数あるG4構造の中でもparallel G4構造と呼ばれる構造は4つのDNAまたはRNAストランドがすべて同じ方向 (5 ′から3 ′方向) に配向しており (図2左)、heminと複合体を形成することが知られている。また、parallel G4構造に結合したheminはperoxidase活性が向上することが知られている (図2中央)7)。

そこで、hemin とparallel G4 構造の複合体のperoxidase活性を利用してG4結合タンパク質を近接ラベリングする技術を開発した。Peroxidase活性により、複合体周辺でN-Me Lumi誘導体を用いたTyrの修飾反応が加速される。複合体近傍で発生するラジカル種は高反応性化学種であり、拡散する前に触媒 (=heminとparallel G4構造の複合体) の近接環境で反応が完結する (proximity labeling)。これにより、G4に結合するタンパク質が選択的に修飾でき、修飾されたタンパク質を同定することによって、G4構造に結合するタンパク質をノンバイアスに特定できると考えた (図2)。
我々はこの手法をTERRA (テロメリックリピート配列G4 RNA) と結合するタンパク質の同定に応用した。TERRAはテロメアDNAから転写され、テロメアの維持に必要なタンパク質複合体の一部として機能する。本手法によりTERRAと結合する既知のタンパク質、hnRNP A1やその部分構造UP1が選択的に修飾されることを示した。また、細胞破砕液中のタンパク質の修飾と修飾されたタンパク質の濃縮、nanoLC-MS/MSによる同定によって、TERRAと結合するタンパク質fibrillarinを初めて同定することに成功した8)。
3.Horseradish peroxidaseを活用するタンパク質Tyr修飾
3-1 Horseradish peroxidaseによる反応効率の高さ
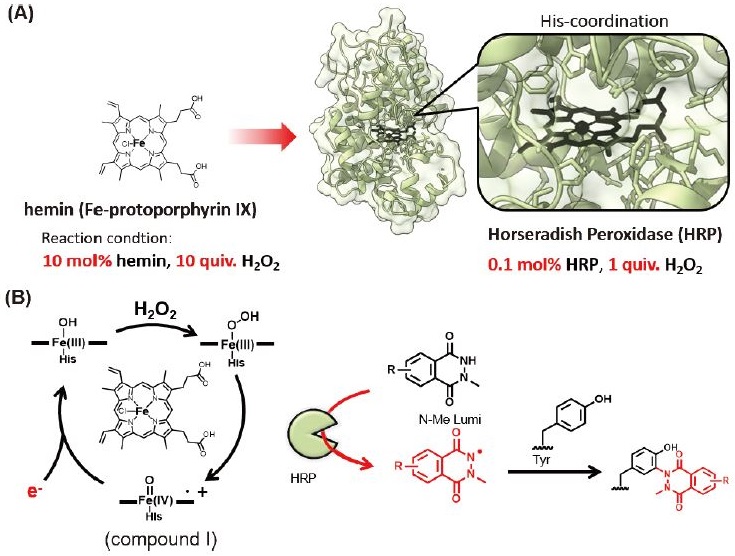
生化学分野の研究で汎用されるレポーター分子である西洋わさびペルオキシダーゼ (horseradish peroxidase、HRP) はheminが配位した酵素分子である。我々は、上記のTyr修飾反応はheminを触媒とした時よりも遙かに効率的に進行することを見出した。heminを触媒とするTyr修飾の場合、基質に対して10当量程度のH2O2が必要であった。一方で、HRPを触媒として用いることで、低濃度のH2O2 (1当量) で反応を行うことができ、Cysの酸化などの酸化的副反応を抑えながら、反応効率を高めることに成功した (図3)9)。

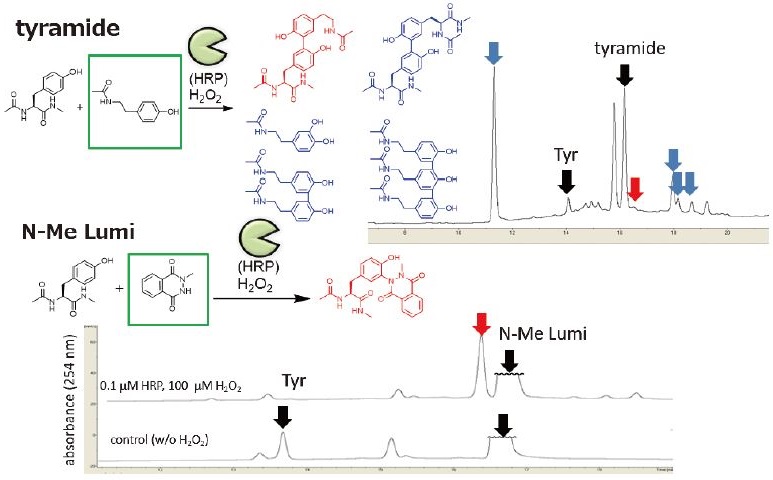
チラミド (Tyrの模倣分子) はperoxidaseによって、ジチロシン形成反応を模倣することが知られている。そこで、HRPを用いて、チラミドによるTyrの修飾とN-Me LumiによるTyrの反応性を比較した。チラミドはHRPによるラジカル化により活性化され、Tyrとの結合形成反応が進行するが、Tyr側のラジカル化 (チロシルラジカルの生成) も同時に進行し、多様な生成物が進行し、望みの修飾体に関しては収率が低いという問題点がある (図4上段)。一方で、N-Me LumiはHRPによって効率的にラジカル化され、高い収率でTyrを修飾できることが明らかとなった (図4下段)。チラミドを使う上で問題となる修飾剤同士のカップリング反応などの副反応も観測されず、従来法よりも高効率なTyr修飾であることが示唆された。

上記のparallel G4構造とheminの複合体と同様に、HRPを用いる方法においても、酵素の活性中心でN-Me Lumiのラジカル種が発生し、活性中心の近傍空間で反応が完結すると考えられる。また、基質側の反応点となるTyrを考慮すると、活性中心に近接できる基質タンパク質のTyrはタンパク質表面に露出したTyrであり、タンパク質構造の内部に埋もれたTyrはHRPの活性中心にアクセスできない。よって、同じTyrであっても、反応性は、タンパク質構造上のTyrの周辺環境に大きく影響を受け、タンパク質表面に露出したTyrが選択的に修飾できると考えた。一般的には、Tyrの疎水的な特徴から、タンパク質表面に露出するTyrは限られている。よって、タンパク質構造の中でも限られたTyrだけを標的にできる部位選択的なタンパク質の機能化手法になりうる。以下にその応用例の一例として抗体分子に適用した成功例を記載する。
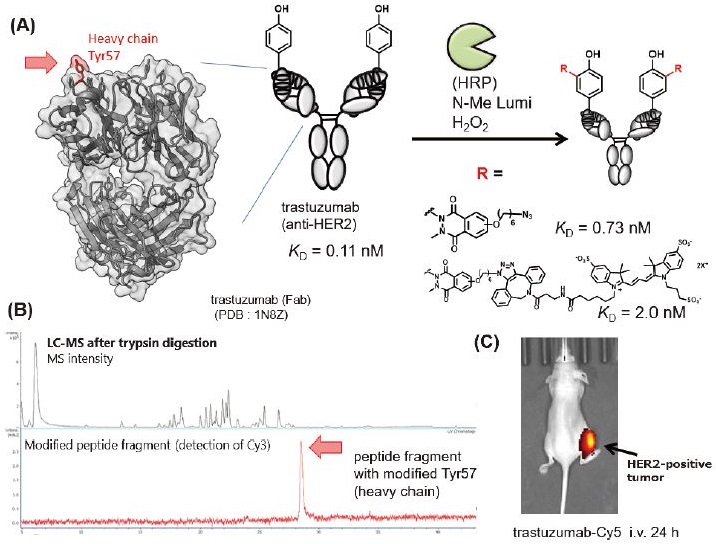
3-2 Horseradish peroxidaseが触媒するTyr修飾を利用した抗体の部位選択的機能化
我々は、抗体免疫グロブリンG (IgG) 構造におけるTyrの表面露出レベルに注目した。タンパク質中のTyrは、生体内で一重項酸素、ヒドロキシラジカル、ペルオキシナイトライトなどの様々な活性酸素と反応し、タンパク質に損傷をもたらす。血中において高い安定性 (T1/2=20 d) を有する必要のある抗体分子に関しては、酸化ストレスの標的になってしまうTyrをタンパク質内部に隠すような構造を進化的に獲得していると予想され、ヒトIgGの定常領域にあるTyrは露出していない。したがって、上記のHRPを使った方法ではほとんど修飾されない。一方で、相補性決定領域 (CDR) は抗体間で配列が著しく異なり、CDRにTyrが存在する場合、抗体構造において最も露出したTyrとなる。HRPを触媒とするN-MeLumiによる抗体の修飾は、CDRのTyrを特異的に修飾した。驚くべきことに、CDRのTyrを機能化した抗体は、抗原認識能力を失っていなかった。少なくとも抗HER2抗体であるTrasztuzumabでは、CDRで最も露出した重鎖Tyr57が特異的に修飾された (図5A、B)。修飾後も抗原認識能が著しく損なわれることはなく、動物実験レベルでも抗原発現腫瘍細胞への選択的な集積 (図5C) や、抗体薬物複合体による良好な抗腫瘍効果を示した6)。これは、チロシン修飾反応によってフェノール性水酸基や芳香族性が失われないためと考えられる。

4.Laccaseを用いた溶存酸素駆動でのTyr修飾
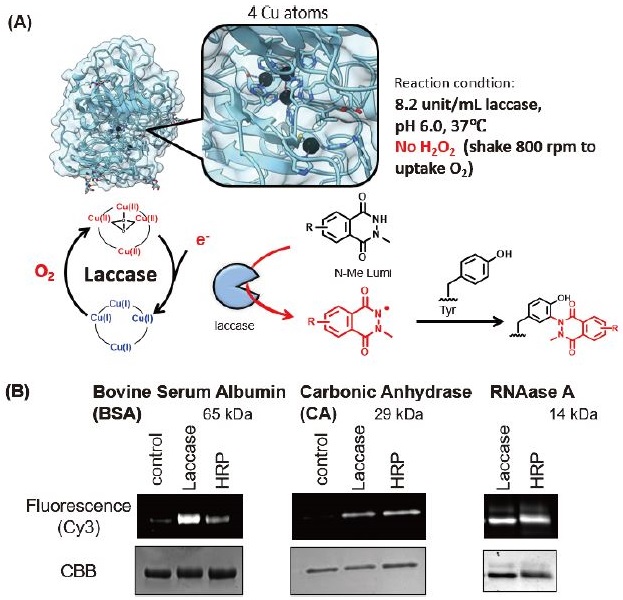
Heminを使ったタンパク質中のTyr修飾法からHRPを使う方法に改良、高効率化することで、反応制御に必要なH2O2を低減させることができ、酸化的な副反応を低減できたが、peroxidaseを使用する以上、H2O2の添加は必須である。基質タンパク質への酸化ダメージをさらに抑制するためには、peroxidaseとは異なるメカニズムの触媒システムが必要であった。Laccaseはカワラタケなどの菌類が主に生産する酵素で、リグニンなどのポリフェノールを酸化すること、比較的幅広い構造の化合物を酸化できることが知られている。特筆すべき特徴として、溶存酸素 (O2) を酸化反応の駆動力にできるという点があり、H2O2などの酸化剤の添加を必要とせずに、酸化反応を触媒できる。
Laccaseは4つの銅原子をその構造中に有しており、基質から一電子を受け取るT1銅と、受け取った電子を使い酸素を水に変換するT2、T3a、T3b銅に分類される。Laccaseの酸化ポテンシャルを考慮しても、N-Me Lumiを十分に活性化できるため、laccaseを使った反応条件を検討することで、溶存酸素を酸化の駆動力とした極めて温和な反応条件でTyr修飾を制御できると考えた (図6A)。

反応条件を種々検討したところ、laccaseの至適pHの範囲内であるpH 6.0、37℃で反応系中に酸素を取り込むために800 rpmでチューブのふたを開けたまま震盪することで、効率的に反応が進行することが明らかになった。HRPで最適化された条件と比較しても、それと同等かそれ以上の反応効率によって、N-Me LumiとTyrの結合形成を触媒することが示唆された (図6B)10)。
5.おわりに
本トピックスでは、天然型タンパク質のTyr修飾を促進する酵素の使用に関する我々の研究動向、その開発過程、および生物学的応用について概説した。酵素工学は、生物学的プロセスの解明から医薬品開発に至るまで幅広い分野でその価値が認識されている。特に、本研究で採用された天然型タンパク質のTyr修飾法は、酵素の利用範囲を広げ、タンパク質機能の緻密な制御を可能にする新たなアプローチである。
酵素反応の利用における主要な利点の一つは、高反応性の化学種を生体分子に調和性の高い条件で生成できることである。酵素は、温和な反応条件下、高い基質選択性で化学反応を制御することができ、合成化学では達成し難い効率と特異性を提供する。例えば、HRPは低濃度のH2O2の使用でも修飾剤を効果的に活性化し、タンパク質のTyrを修飾することが可能である。また、laccaseを使用すると、溶存酸素を利用して反応を促進し、不要な酸化ストレスによる副反応を防ぎながら、温和な条件で効率的にタンパク質を修飾できる。これにより、特定の官能基を選択的に機能化し、例えば抗体の部位選択的機能化を通じて、高機能バイオマテリアルの創出が可能となる。
今後の研究では、さらに多様な酵素の発見と改良が求められ、修飾の範囲と精度を向上させることが期待される。また、新しい化学的手法と酵素反応を組み合わせることで、未踏のアプローチを可能にし、生命科学だけでなく、材料科学やエネルギー分野においても酵素工学の応用が拡がることを期待している。
謝辞
本稿で紹介した著者の研究結果に関して,多くの実験は,東京工業大学科学技術創成研究院 中村浩之教授の研究室で行われたものであります。中村先生を始め、実験に携わってくれた中村公亮修士、對馬理彦博士、松村雅喜修士、中根啓太博士を始めとする学生諸君に深く感謝いたします。現在もより効率的なTyr修飾の開発を目指し、laccaseの検討を続けており、改良研究に貢献し、ご助言を賜った東北大学 石川稔教授、友重秀介博士、藤村千鶴氏、Zhengyi Liu博士に感謝致します。当該研究の一部は、科学技術振興機構、日本学術振興会、文部科学省、上原記念生命科学財団の支援を受けて行われたものであり、関係諸機関に深く感謝いたします。
文献
1) Rhee, H.-W., Zou, P., Udeshi, N. D., Martell, J. D., Mootha, V. K., Carr, S. A., Ting, A. Y.: Science, 339, 1328 (2013).
2) Roux, K. J., Kim, D. I., Raida, M., Burke, B.: J. Cell Biol., 196, 801 (2012).
3) Branon, T. C., Bosch, J. A., Sanchez, A. D., Udeshi, N. D., Svinkina, T., Carr, S. A., Feldman, J. L., Perrimon, N., Ting, A. Y.: Nat. Biotechnol., 36, 880 (2018).
4) Ban, H., Gavrilyuk, J., Barbas, C. F.: J. Am. Chem. Soc., 132, 1523 (2010).
5) Sato, S., Nakamura, K., Nakamura, H.: ACS Chem. Biol., 10, 2633 (2015).
6) Sato, S., Matsumura, M., Kadonosono, T., Abe, S., Ueno, T., Ueda, H., Nakamura, H.: Bioconjug. Chem., 31, 1417 (2020).
7) Chang, T., Gong, H., Ding, P., Liu, X., Li, W., Bing, T., Cao, Z., Shangguan, D.: Chemistry, 22, 4015 (2016).
8) Masuzawa, T., Sato, S., Niwa, T., Taguchi, H., Nakamura, H., Oyoshi, T.: Chem. Commun., 56, 11641 (2020).
9) Sato, S., Nakamura, K., Nakamura, H.: Chembiochem, 18, 475 (2017).
10) Sato, S., Nakane, K., Nakamura, H.: Org. Biomol. Chem., 18, 3664 (2020).