【トピックス】
キチン粉末を利用したタンパク質精製手法の開発と酵素探索への応用
加藤俊介、林 高史
阪大院・工
1.はじめに
酵素や微生物等を用いた物質変換法 (Biocatalysis) に注目が集まる昨今において、新規な触媒活性を示す酵素を高精度に探索するハイスループットスクリーニング (HTS) 技術の開発は不可欠である。特に、「精製」された酵素サンプルを用いたHTSは、細胞夾雑物による影響を完全に排斥し、より厳密な反応条件下でのスクリーニングを可能にする点で非常に有用である。しかしながら、タンパク質精製に要するコストや労力の観点から、既存のタンパク質精製手法 (例えば、イオン交換クロマトグラフィー・サイズ排除クロマトグラフィー・Ni-NTAアフィニティークロマトグラフィーなど) を大規模なHTSへと応用することは難しく、より高効率かつ安価なタンパク質精製手法の開発が望まれている。そこで近年、筆者らは、安価な多糖高分子であるキチン粉末を用いた新規アフィニティー精製手法「CSAP system」を開発した1)。このCSAP systemでは、市販のキチン粉末 (市場価格:100 gあたり2,000円程度) をクロマトグラフィー用担体として利用し、独自の結合タンパク質ChSavを共役させることで、Strep-tag II2)融合タンパク質の効率的かつ簡便なアフィニティー精製を実現する。本稿では、このCSAP systemを用いたタンパク質精製の詳細と、実際の酵素探索への応用について紹介したい。
2.結合タンパク質ChSavの構築とCSAP systemの開発
Strep-tag II は、8残基のアミノ酸 (配列:WSHPQFEK) から構成されるアフィニティー精製用ペプチドタグである2)。His-tagやGST-tagなどの他のタンパク質タグと比較した際のStrep-tag II の利点として、 (i) タグの結合特異性が高く、精製後のタンパク質純度が優れること、 (ii) タグの化学的反応性が低く、ペプチド長も短いため融合タンパク質の物性に影響を与えにくいこと、 (iii) アフィニティークロマトグラフィーの溶出条件が温和であること、などが挙げられる。しかしながら、Strep-tagII 精製用の市販のクロマトグラフィー担体は非常に高価であり、さらに、繰り返し利用のためのカラム再生操作が煩雑である。従って、Strep-tag II 融合タンパク質の精製に、安価かつ使い捨て可能なクロマトグラフィー担体を使用することは、精製酵素サンプルを用いたHTSを実施する上で大きなアドバンテージを生む。
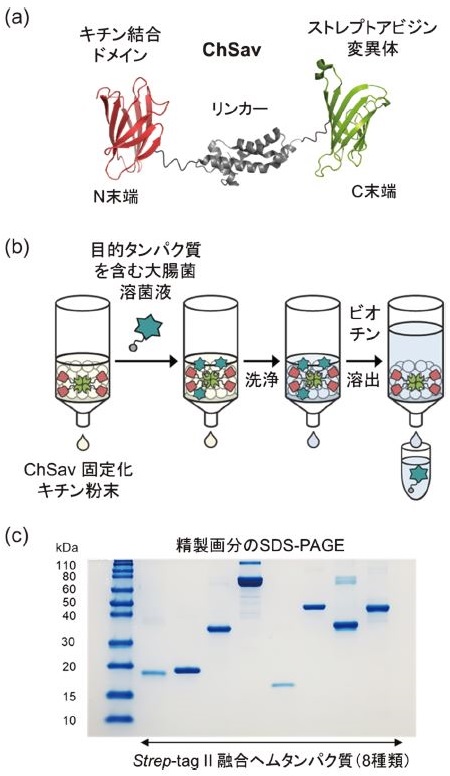
そこで筆者らは、クロマトグラフィー用担体としてキチン粉末の利用に着目した。安価な多糖高分子であるキチン粉末は、主にカニやエビなどの水産物から加工廃棄物として得られ、非可食性バイオマスとして現在さまざまな活用法の検討がなされている。本研究では、このキチン粉末をStrep-tag II のクロマトグラフィー用担体として利用するべく、Strep-tag II 結合能を有するストレプトアビジン変異体と、Thermococcus kodakarensis KOD1由来キチナーゼのキチン結合ドメイン3)を連結した融合タンパク質ChSavを調製した (図1a)。ChSavの発現には、Brevibacillus choshinensis HPD31-SP3を用いた分泌発現システムを採用し、キチン粉末を担持したカラムに対して、ChSavを含むBrevibacillus choshinensis HPD31-SP3の培養液の上澄みを流通させることで、ChSavのカラムへの固定化を行った。続いて、目的のStrep-tag II 融合タンパク質を含む大腸菌溶菌液を、このChSavを固定化したキチン粉末へと添加し、カラムの洗浄操作後、ビオチン溶液によりStrep-tag II を選択的に解離・溶出させることで、目的タンパク質のアフィニティー精製を行った (図1b)。例として、図1cにStrep-tag II を融合したヘムタンパク質 (計8種類) の精製画分のSDS-PAGEを示す (左から順にmyoglobin、nitrobindin、dye-decolorizing peroxidase、catalase、truncated hemoglobin、flavohemoglobin、tryptophan 2,3-dioxygenase、cytochrome P450)。目的タンパク質の分子量や高次構造、Strep-tag II の付加位置 (N末端・C末端) に影響されることなく、目的のStrep-tag II 融合タンパク質のみが単一のバンドとして高純度で得られていることが明らかとなった。これらの結果を受け、筆者らはこの精製手法を「Chitin-and Streptavidin-mediated Affinity Purification (CSAP) system」と名付け、さらなる精製条件・実験操作の検討を行った。
図1 ChSavを用いたStrep-tag II 融合タンパク質の精製
3.大腸菌共発現系を用いたワンステップ精製CSAP systemの開発
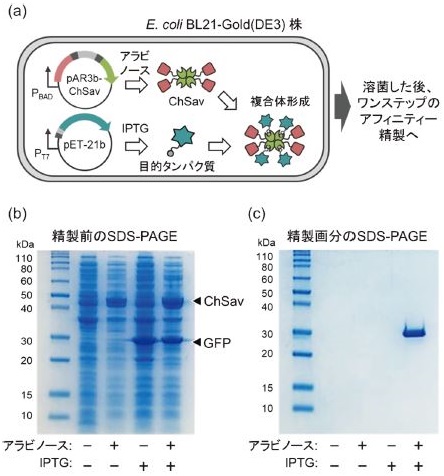
上記のBrevibacillus choshinensis HPD31-SP3分泌発現系を用いたアフィニティー精製手法では、目的のStrep-tag II 融合タンパク質とは別にChSavを含む細胞培養液を調製する必要がある。CSAP systemに要する実験操作の更なる簡略化をめざし、次に筆者らは、大腸菌共発現系を用いた一段階のアフィニティー精製系の構築に取り組んだ。具体的には、図2aに示すように、同一の大腸菌細胞内でChSavと目的のStrep-tag II 融合タンパク質を共発現させて両者の複合体を系中で形成することができれば、別途ChSavを調製する必要なく、続くキチン粉末を用いたアフィニティークロマトグラフィーにより、目的タンパク質をワンステップで容易に精製可能であると予想した。
図2 大腸菌共発現系を用いたワンステップ精製CSAP system
この仮説のもと、筆者らはアラビノースプロモーターPBAD支配下にChSav遺伝子をコードするpACYC系プラスミド (pAR3b-ChSav) を調製し、pETシステムとの併用によるChSavとStrep-tag II 融合タンパク質の共発現を実施した。一例として、ChSavとStrep-tag II 融合緑色蛍光タンパク質 (GFP) を共発現させたEscherichia coli BL21-Gold(DE3)株のSDS-PAGEを図2bに示す。アラビノースとIPTGの二つの誘導剤を用いた直交型の遺伝子発現制御により、当初の設計通りの両タンパク質の共発現が実現していることが判明した。さらに、このChSavとGFPを共発現させた大腸菌溶菌液を、キチン粉末を担持したカラムへ添加し、上記と同様にカラムの洗浄操作後、ビオチン溶液を用いて溶出させることで、Strep-tag II 融合タンパク質の一段階のアフィニティー精製に成功した。図2cの精製画分のSDS-PAGEに示す通り、アラビノースとIPTGの両誘導剤の添加によりChSavとGFPの共発現を行った場合にのみ、高純度のGFPが得られている。また、GFPだけでなく、それ以外の様々なStrep-tag II 融合タンパク質についても、この大腸菌共発現系を用いたワンステップCSAP systemが機能することを実証している1)。
4.CSAP systemによるシクロプロパン化反応を触媒する微生物酵素の探索
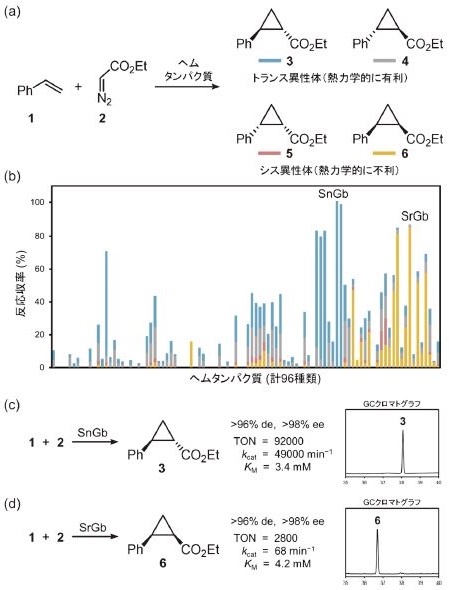
最後に、開発したCSAP systemの応用として、スチレン (1) とジアゾ酢酸エチル (2) のシクロプロパン化反応を触媒する微生物酵素の探索を実施した (図3a)。本反応を自然界で行う酵素は未だ発見されていないものの、近年、進化工学的アプローチにより改変されたシトクロムP450BM3変異体が、本反応に対して触媒活性を示すことが報告されている4)。そこで筆者らは、シトクロムP450BM3等の既知タンパク質に限らず、微生物がもつ多種多様なヘムタンパク質を網羅的に探索することで、より高いシクロプロパン化活性を示す酵素を同定することをめざした。
図3 シクロプロパン化反応を触媒する微生物酵素の探索
まず初めに、種々の微生物ゲノムから96種類のヘム酵素遺伝子 (cytochrome P450、dye-decolorizing peroxidase、catalase、tryptophan 2,3-dioxygenase 等) をクローニングし、Strep-tag IIを末端に付加した組換え酵素の遺伝子ライブラリを構築した。そして、この遺伝子ライブラリをE. coli BL21-Gold(DE3)株を用いて発現した後、CSAP systemによるタンパク質精製を96-well形式で実施し、精製条件下でのシクロプロパン化反応に対する触媒活性および立体選択性の評価を実施した (図3bに各シクロプロパン立体異性体3–6の反応収率を図3aに対応する色別に示す)。その結果、目的のシクロプロパン化反応に対して有望な触媒活性を示すいくつかのヘム酵素の同定に成功した。中でも、グロビンフォールドを有する比較的小さなヘムタンパク質 (以降、グロビン) は、他のヘムタンパク質と比較して特に高い触媒活性と優れた立体選択性を示すことが判明した。例えば、硫黄酸化細菌Starkeya novella由来グロビン (SnGb) は、非常に高い触媒活性 (kcat=4.9×104 min-1, KM=3.4 mM, 触媒回転数TON=9.2×104) を示し、目的生成物のうちトランス異性体3を立体選択的 (>96% de, >98% ee) に与えた (図3c)。その一方で、放線菌Streptosporangium roseum由来のグロビン (SrGb) は、熱力学的に不利なシス異性体6を立体選択的 (>96% de, >98% ee) に生成することが明らかとなった (図3d)。通常、遷移金属触媒を用いたシクロプロパン化反応では、熱力学的に有利なトランス異性体の生成が優先するため、シス異性体を立体選択的に与えたSrGbの触媒特性は、有機化学的な視点から見ても大変興味深い。また最近では、データベース上の類似配列を有するグロビンのクラスタリング解析を実施し、微生物由来グロビンの系統的なスクリーニングを実施することで、シクロプロパン生成物のうちこれまで未獲得であったトランス異性体4とシス異性体5を立体選択的に与える酵素をそれぞれ同定することにも成功している。このように、本研究で開発したCSAP systemは、精製条件下での酵素探索を指向した96-well形式のHTSへと応用可能であることが実証された。
5.おわりに
本研究で開発したCSAP systemは、高価なクロマトグラフィー担体を使用することなく、市販のキチン粉末を利用しStrep-tag II 融合タンパク質のアフィニティー精製を実現する独自手法である。他の既存のタンパク質精製手法と比較した際の、 (i) キチン粉末のコスト優位性、 (ii) Strep-tag II の汎用性と利便性、 (iii) 実験操作のシンプルさ、について考慮すると、このCSAP systemがもたらす恩恵は非常に大きい。また、本稿では一例として、酵素探索にむけたHTSへの応用を示したが、他にもタンパク質の進化工学実験や、大規模スケールでの精製タンパク質の調製、固定化酵素触媒の開発など、様々な学術的・工業的用途にもCSAP systemを幅広く利用できる可能性が高い。酵素・微生物を用いた物質変換法 (Biocatalysis) の実装に注目が集まる昨今において、今後このCSAP systemが酵素工学研究の発展に貢献することを期待したい。
謝辞
本研究は、JSPS科研費 新学術変革領域研究 (A) 「予知生合成」JP23H04554、「無細胞分子システム」JP22H05421、JP24H01136、JST ACT-X「環境とバイオテクノロジー」領域 JPMJAX22B6の支援をうけたものである。
文献
1) Kato, S., Takeuchi, K., Iwaki, M., Miyazaki, K., Honda, K., Hayashi, T.: Angew. Chem. Int. Ed., 62, e202303764 (2023).
2) Schmidt, T. G. M., Skerra, A.: Nat. Protoc., 2, 1528 (2007).
3) Hanazono, Y., Takeda, K., Niwa, N., Hibi, M., Takahashi, N., Kanai, T., Atomi, H., Miki, K.: FEBS Lett., 590, 298 (2016).
4) Coelho, P., Brustad, E. M., Kannan, A., Arnold, F. H.: Science, 339, 307 (2013).