【トピックス】
酵素を用いた核酸医薬製法の開発
萩原佑介、佐野坂真人
味の素株式会社、味の素バイオファーマサービス/株式会社ジーンデザイン
1.はじめに
オリゴ核酸を有効成分とする核酸医薬は、従来の低分子医薬や抗体医薬とは異なる次世代の医薬品として注目されている。核酸医薬には、siRNAやアンチセンス核酸など、さまざまなモダリティが含まれ、遺伝性疾患やがんなどを対象に全世界で盛んに創薬研究が進められている。上市されている核酸医薬の数は年々増加しており、また、核酸医薬開発におけるパイプライン数も増加の一途である。このため、大量の原薬が必要になっており、工業スケールでオリゴ核酸を効率よく合成できる方法が求められている。
現在、研究や臨床開発、医薬品として使われているオリゴ核酸の多くは、固相合成によって調製されている。現状の製造方法では、合成や精製工程における大量の有機溶剤の使用などの問題があり、サステナビリティの観点からは環境負荷の低い生産方法も求められている。このため、新たな精製方法の開発や、液相での合成法の開発などが進められている1)。
また、オリゴ核酸の化学合成では、鎖長が長くなるにつれて純度や収率が低下する。したがって、目的のオリゴ核酸の短い断片を化学的に合成し連結できれば、生産効率や品質が向上し、上記の課題にも有効と期待される。我々は酵素を用いる連結手法に着目し、研究開発を進めている。ここでは、オリゴ核酸製造に向けた酵素の高機能化と、近年活発化している長鎖のオリゴ核酸の製造に向けた取り組みについて述べる。
2.酵素を用いたsiRNAの製法の開発と高機能な酵素の創出
2-1 酵素によるsiRNAの製法
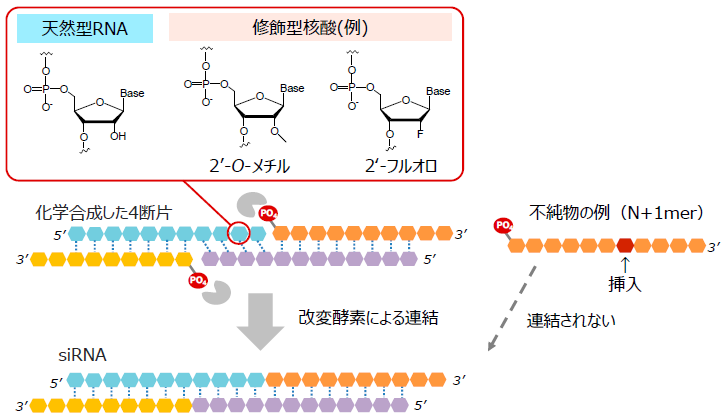
我々は、主要な核酸医薬のモダリティのうち、21-23 merのセンス鎖およびアンチセンス鎖の二本鎖からなるsiRNAの製造への酵素反応の利用を試みた (図1)2,3)。本製法は、両鎖をそれぞれ2つ以上の短鎖断片に分け、断片間の相補性を利用して二本鎖を組ませた上で酵素により連結することで、4つ以上の核酸断片からsiRNAを生成するというものである。
図1 酵素によるsiRNA製法の概略
これまでにさまざまなオリゴ核酸連結酵素 (リガーゼ) が報告されている。このうち二本鎖RNAのニック (切れ目) を連結する酵素は、二本鎖RNAリガーゼと呼ばれる。2004年にT4ファージ由来の二本鎖RNAリガーゼ (T4Rnl2) が報告され4)、立体構造や生化学的な解析が進められてきた。T4Rnl2はほかの多くのオリゴ核酸リガーゼと同様に、ATPをエネルギーとして利用し、マグネシウム (II) イオンの存在下で、3’-OH末端と5’-リン酸末端をホスホジエステル結合で連結する反応を触媒する5)。
これまでのT4Rnl2の研究は長鎖の二本鎖RNAを用いて解析されている。siRNAのような生成物が21-23 merとなる短鎖へ適用した例はなく、適切に4断片がアニールされてsiRNAを生成できるか不明であった。我々はT4Rnl2によるsiRNA製法を試み、各断片を適切に設計することで、4つの断片からセンス鎖、アンチセンス鎖が構築され、目的のsiRNAを生成できることを見出した2,3)。
この製法は、生産効率だけではなく品質の面でも優位性があった。上述のようにオリゴ核酸の化学合成では伸長反応が進むにつれ、1残基の挿入・欠失体 (N±1 mer) といった副生物が増加する。一方、酵素を使った製法では10塩基長程度の短鎖断片の合成でよいことから、これらの副生物を大幅に低減できる。また、二本鎖RNAリガーゼは、二本鎖構造を認識して連結するため、適切な二本鎖を形成できないN±1 merに対する反応性が低い。以上のように、もともと断片に含まれるN±1 mer不純物が少ないうえに、そのような不純物も酵素により連結されにくいため、酵素によって生成したsiRNAは、固相合成で全長を合成した場合に比べると高純度であった3)。オリゴ核酸の大量製造ではカラムクロマトグラフィーによる精製工程の生産性も課題であるが、酵素による製法では高純度な生成物を得られるため、精製工程を簡略化できる可能性がある点でも優れている。
2-2 祖先型RNAリガーゼ (AncT4_2) の設計
酵素を用いたsiRNA製法は効率的な製法として期待されるが、実用化には課題もあった。多くのsiRNAでは生体内での安定性や標的のRNAへの親和性向上のため、2’-O-メチル基や2’-フルオロ基で修飾されたヌクレオチドが使用されている。既知のオリゴ核酸リガーゼは、このような修飾型RNAに対する活性が低く、効率の良い連結が難しかった。我々は、オリゴ核酸の酵素的製法の実現に向けて、酵素の基質特異性の改変を試みた6,7)。
酵素の一般的な改変方法としては、立体構造に基づいて酵素のアミノ酸配列を置換する合理的設計、およびランダムに変異を導入した変異体ライブラリーから目的活性の酵素を探索する指向性進化が挙げられる8)。しかし、それぞれ、立体構造情報の取得、または効率的なスクリーニング系の確立などが必要となり、酵素改変において課題となることがある。
これらの改変方法と異なり、祖先型配列設計法は、さまざまな生物の酵素のアミノ酸配列を比較することで、これらの酵素の進化系統樹を作成し、共通の祖先が持っていた酵素の配列を推定する方法である8)。祖先型配列設計法では、立体構造情報が不要で酵素のアミノ酸配列情報のみから、コンピューター上で新しい酵素を設計できるため、上記の合理的設計や指向性進化における問題を回避できる。また、多数のアミノ酸残基を一度に変更することで大幅な酵素の性質の改変も期待される。
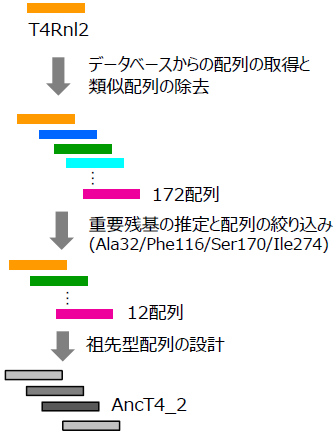
我々はT4Rnl2をもとに、祖先型配列設計法による酵素の改変を試みた (図2)。まず、T4Rnl2配列と相同性の高い配列を公共のデータベースから取得し、互いに類似している配列などを除いて172配列を得た。これらの配列を既報の方法9)により比較することで、重要な4アミノ酸残基を推定し、これらの残基が保存されている12配列を得た。この12配列に基づき、祖先型のRNAリガーゼを複数設計した。設計した酵素をEscherichia coli により組換え発現させたところ、AncT4_2が良好なタンパク質発現と活性を示したことから、さらなる検討を進めた。AncT4_2とT4Rnl2のアミノ酸配列を比較したところ、334残基の93%が同一であり、7% (22残基) が異なっていた。
図2 祖先型配列の設計
2-3 AncT4_2の性質
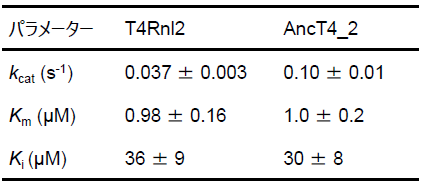
さまざまな濃度の天然型の二本鎖RNAに対するAncT4_2とT4Rnl2の活性を測定し、これらの酵素の速度論的パラメーターを比較した。オリゴ核酸リガーゼの先行研究では、基質オリゴ核酸による反応への阻害が報告されており10)、本研究においても基質による阻害モデルに基づいて各パラメーターを算出した。RNAに対するミカエリス定数 (Km) とRNAによる阻害定数 (Ki) は、2つの酵素で同等であった。一方、AncT4_2のターンオーバー数 (kcat) および触媒効率 (kcat/Km) は、T4Rnl2の2.5倍以上に向上しており、酵素活性が向上していた (表1)。
表1 各酵素の速度論的パラメーター
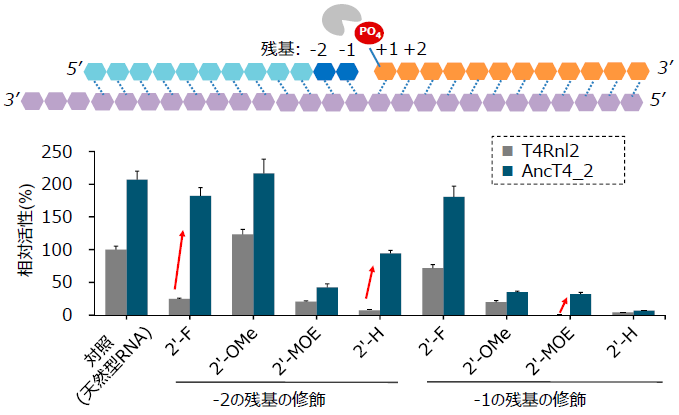
次に、AncT4_2とT4Rnl2における各種修飾型核酸に対する活性を比較した。評価方法は、二本鎖RNAのニックを連結する反応とし (図3)、連結部の両側2残基をそれぞれ修飾型核酸に置き換えた基質を用いた。T4Rnl2の活性は、3’側の残基 (図3の+1および+2の残基) の置換による影響はなかった一方で、5’側の残基 (図3の-1および-2の残基) を修飾型に置換した場合に低下が認められた。これに対し、AncT4_2では、これらの修飾型核酸を導入したRNAに対しても、一部で高い連結活性を示した。例として、連結部から2残基目 (図3の-2の残基) が2’-フルオロ基で修飾されたRNAに対する活性が7倍に向上していた。以上のように、AncT4_2は、T4Rnl2の基本的な能力を維持しつつ、基質特異性が拡大していることが分かった。

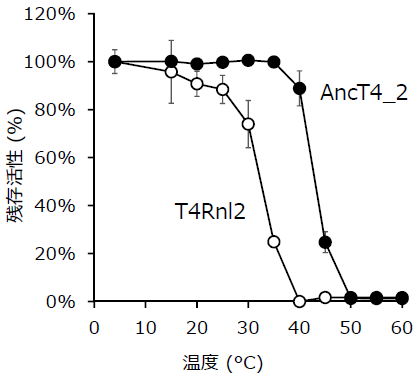
また、祖先型設計により酵素の熱安定性が向上する例も多く報告されている。調製した酵素を各温度で1時間加熱後に残存活性を測定したところ、残存活性が50%になる温度は、T4Rnl2の32℃に対して、AncT4_2は45℃に向上していた (図4)。このような酵素の熱安定性の向上は、工業化時の安定生産や長時間の反応に有用な性質である。また、より高温で反応することで、反応速度の向上も期待される。
図4 熱安定性の比較
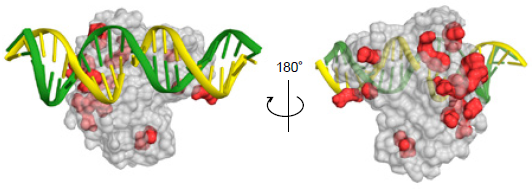
AncT4_2とRNAの複合体モデルから、高機能化の機構を考察した (図5)。AncT4_2に導入された22箇所の変異点のほとんどは、基質であるRNAの結合部位の裏側に位置していた。基質結合部位から離れた位置へ多数の変異が導入されることで、基質結合部位付近の構造が変化し、基質特異性の拡大につながった可能性がある。このうち4変異点はグリシンへの置換、2変異点はアミノ酸残基の欠失であった。先行研究では、グリシンへの置換やアミノ酸残基の挿入・欠失により、タンパク質のフレキシビリティの向上や11)、運動性に影響することが報告されており12)、AncT4_2でも同様の機構で性質が変化した可能性がある。基質から離れた位置における有効変異の予測は、立体構造に基づく合理的な改変では難しいことも多く、祖先型設計法の有用性を示す結果となった。
![]()
2-4 AncT4_2のsiRNA製造への利用
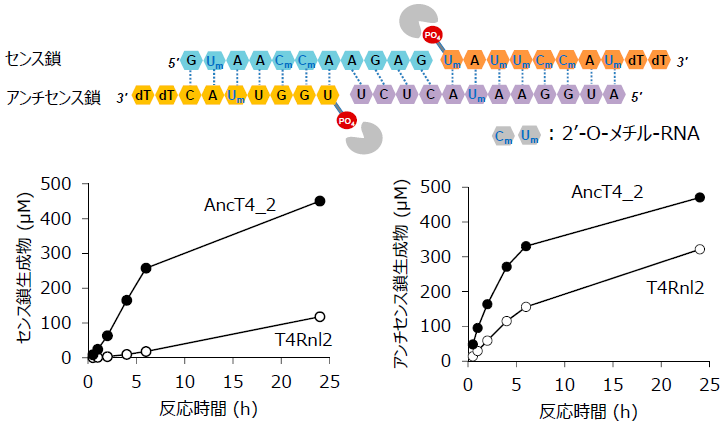
AncT4_2のsiRNA製造での有用性を評価するため、2’-O-メチル修飾された残基を含むsiRNAであるパチシランの合成を行った6)。siRNAを構成する4つの断片をそれぞれ化学的に合成し、これらを等モル含む反応液に対して、T4Rnl2またはAncT4_2を添加して両鎖の生成を試みた。反応24時間後の収率は、T4Rnl2ではセンス鎖で24%、アンチセンス鎖で64%であったのに対し、AncT4_2では両鎖ともに90%以上に到達していた。以上のようにAncT4_2の利用により、効率のよいsiRNAの合成が可能であった。AncT4_2の活性と熱安定性の向上が寄与したと考えている (図6)。
図6 siRNAの生成速度の比較
現在、AncT4_2を用いて、さまざまな構造の核酸医薬への酵素的製法の適用を検討している。また、製法の実用化に向けて、液相のオリゴ核酸合成法であるAJIPHASE®3)との組み合わせや、酵素反応のスケールアップを進めている。
3.酵素ライゲーションによる長鎖RNA合成
3-1 長鎖RNA合成における課題と、その解決法としてのライゲーション法の意義
上述したsiRNAなどの比較的短いオリゴ核酸に加えて、近年、CRISPR-Cas9法によるゲノム編集で使用されるSingle guide RNA (sgRNA) 等、100 merを超えるような、化学合成での製造が困難な長鎖の一本鎖RNAの需要が高まってきている。核酸の化学合成で一般的なホスホロアミダイト法では、化学修飾された核酸モノマー (ホスホロアミダイトモノマー) を一残基ずつ3’→5’方向に縮合 (カップリング) することで、核酸鎖を伸長する。このため、鎖長が長くなるに連れて完全長の割合が低下し、DNAに比べてRNAの場合はその低下が顕著である。
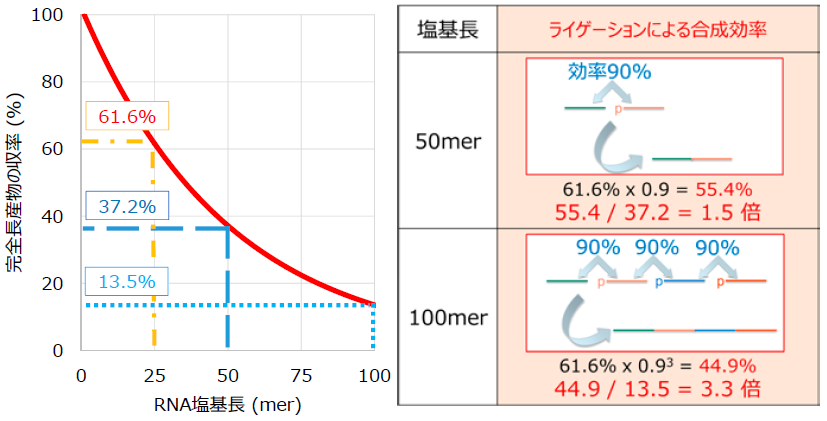
この顕著な低下は主としてRNAのホスホロアミダイトモノマーにおけるリボースの2’-OH基の保護基に起因し、その立体障害によってアミダイトモノマーのカップリングが阻害されてしまう。カップリング反応効率を98%と仮定すると、25 merの場合では合成産物中における完全長産物の割合は計算上61.6% (0.9824 = 0.616) となるが、50 merの場合では37.2% (0.9849 = 0.372)、100 merの場合は計算上13.5% (0.9899 = 0.135) となり、その割合は著しく低くなる (図7)。カップリング効率等を改善する方法もこれまで検討されてきているが13)、それでも100塩基長を超えるような長鎖RNAの高効率合成は困難である。

一方、mRNAなどのさらに長鎖のRNAは、T7 RNAポリメラーゼ等の酵素を用いる合成法であるin vitro 転写 (in vitro transcription; IVT) 法により製造が行われている。この方法で例えばシュードウリジンや5-メチルシチジン等の修飾核酸を挿入したい場合は、RNA配列中の全てのウリジンやシチジンを置換させなければならない14)。望んだ位置に部分的に修飾核酸を挿入させるような、バリエーションに富んだ長鎖RNAを設計し合成しようとするのであれば、IVT法ではなく化学合成法を用いる必要があるが、前述の通り長鎖のRNA化学合成は効率が低いため、特に150 merを超えるRNAを一度に連続的に合成することは現実的ではない。
これらの問題を解決して、修飾等のバリエーションに富んだ長鎖RNAを高効率に生産するためには、比較的化学合成が容易である短い鎖長のRNAを複数作製し、リガーゼ等の酵素で連結 (ライゲーション) することが有用であると我々は考え、製法の開発に取り組んできた。例えば完全長産物量61.6%の効率で合成できる25 merの複数RNA断片をライゲーションした場合、その反応点でのライゲーション効率が90%であれば、50 mer合成では55.4% (61.6% × 0.9 = 0.554)、100 mer合成では44.9% (61.6% × 0.93 = 0.449) となり、連続的に化学合成した場合と比較してそれぞれ1.5倍、3.3倍の効率上昇となる (図7)。RNA化学合成とライゲーション反応を組み合わせることによって、計算上顕著な高効率化が可能であり、さらに高効率化だけではなく、多数のRNAをライゲーションさせることによって、今までは合成が著しく困難であった150 mer以上の部分修飾RNAの合成も可能になる。
3-2 酵素ライゲーションの概要・長鎖RNAの作製例
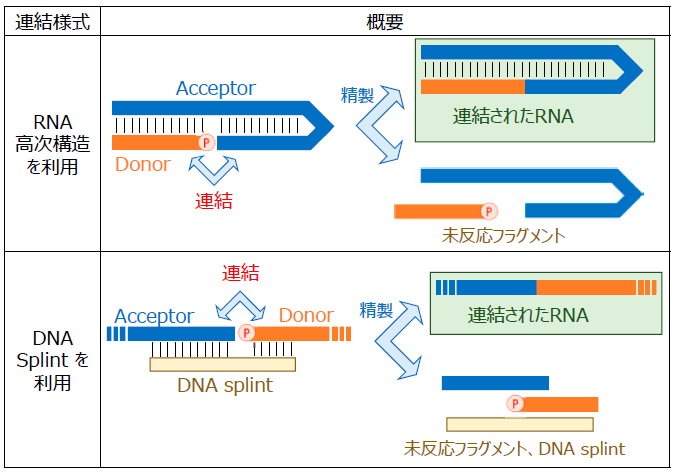
RNAのライゲーションに用いる酵素としては、siRNA製法の検討時と同様に二本鎖RNAリガーゼを主に使用している。二本鎖RNAリガーゼは二本鎖のオリゴ核酸に対して活性を持つことから、二本鎖RNAリガーゼにより一本鎖RNAを生成するためには、連結部において二本鎖の構造をとる必要がある。そこで、ライゲーション反応において、ヘアピン構造等RNAの高次構造を利用する方法と、相補鎖DNA splintを利用して疑似的に二本鎖RNAニック様構造を形成させる方法を検討している (図8)。いずれの方法でもライゲーション後、未反応断片及びDNA Splintを液体クロマトグラフィーにより分離することにより目的のRNAを得る。AncT4_2を利用することによって、修飾核酸を含んだRNAにおけるライゲーションの高効率化も可能である。
次に当社での実施例を二つ紹介する。一つは50 mer程度のヘアピン型RNAを製造したものである。図8上段のように、この配列のステム部分で2分割したものを作製し、それらをT4Rnl2を用いてライゲーションすることにより目的のRNAをグラムスケールで製造した。この際にリガーゼの使用量削減を目的とした条件検討も行い、酵素使用量を初期条件の40分の1まで削減させることにも成功している15)。
図8 二本鎖RNAリガーゼによるRNAのライゲーション様式
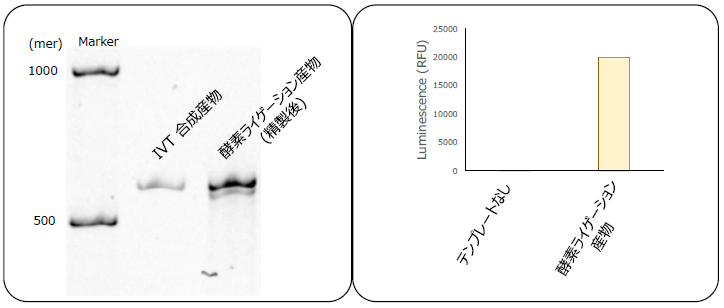
もう一つは、20以上の短鎖RNA断片を連結させ、長鎖を作製したものである。図8下段の様式を応用して、トゲオキヒオドシエビ[Oplophorus gracilirostris]由来ルシフェラーゼ (NanoLuc®) をコードした全長500 merを超えるmRNAの合成に挑戦した (図9、左)。この合成したmRNAを用いて無細胞翻訳系でタンパク質を合成し、ルシフェラーゼ活性を確認することに成功した (図9、右)16,17)。

4.おわりに
化学合成と酵素反応を組み合わせた手法は、高品質なオリゴ核酸を高効率に調製できる利点がある。AncT4_2の持つ、修飾型オリゴ核酸に対する高い活性や熱安定性は、酵素を用いたオリゴ核酸の製造において、優れた性質といえる。また、化学合成と酵素反応の併用は、化学合成法で顕著に合成効率の低下する長鎖のRNAや、IVTのみでは合成できない部分的に修飾されたRNAの製造への応用も期待される。本製法の実現を通して、高品質な核酸医薬原薬の安定供給に貢献できることを願っている。
謝辞
AncT4_2の設計は静岡県立大学准教授 中野祥吾氏、同大学准教授 伊藤創平氏、同大学博士後期課程 (当時) 本山智晴氏の協力を受けて実施しました。ここに感謝の意を記します。
文献
1) Andrews, B. I., Antia, F. D., Brueggemeier, S. B., Diorazio, L. J., Koenig, S. G., Kopach, M. E., Lee, H., Olbrich, M., Watson, A.: J. Org. Chem., 86, 49 (2021).
2) 高橋大輔、萩原佑介、梶本祥平、小西美和: 国際特許出願WO2020171092 (2020).
3) 高橋大輔: MEDCHEM NEWS, 31, 200 (2021).
4) Nandakumar, J., Shuman, S.: Mol. Cell., 16, 211 (2004).
5) Nandakumar, J., Shuman, S., Lima, C. D.: Cell, 127, 71 (2006).
6) Kajimoto, S., Ohashi, M., Hagiwara, Y., Takahashi, D., Mihara, Y., Motoyama, T., Ito, S., Nakano, S.: Appl. Environ. Microbiol., 88, e01679 (2022).
7) Konishi, M., Kajimoto, S., Hagiwara, Y., Mihara, Y., Nakano, S., Motoyama, T., Ito, S.: 米国特許 US11525132B2 (2022).
8) Thomson, R. E. S., Carrera-Pacheco, S. E., Gillam, E. M. J.: J. Biol. Chem., 298, 102435 (2022).
9) Nakano, S., Motoyama, T., Miyashita, Y., Ishizuka, Y., Matsuo, N., Tokiwa, H., Shinoda, S., Asano, Y., Ito, S.: Biochemistry, 57, 3722 (2018).
10) Bauer, R. J., Evans, T. C., Lohman, G. J. S.: PLoS One, 11, e0150802 (2016).
11) Gaucher, E. A., Govindarajan, S., Ganesh, O. K.: Nature, 451, 704 (2008).
12) Schrank, T. P., Bolen, D. W., Hilser, V. J.: Proc Natl Acad Sci USA, 106, 16984 (2009).
13) Hendel, A., Bak, R. O., Clark, J. T., Kennedy, A., Ryan, D. E., Roy, S., Steinfeld, I., Lunstad, B. D., Kaiser, R., Wilkens, A. B., Bacchetta, R., Tsalenko, A., Dellinger, D. J., Bruhn, L., Porteus, M. H.: Nat. Biotechnol., 33, 985 (2015).
14) Nance, K. D., Meier, J. L.: ACS Cent. Sci., 7 , 748 (2021).
15) 稲田英朗、伊関克彦、沖村慶一、佐野坂真人、高科あゆみ: 日本国特許第6631751号 (2020).
16) 佐野坂真人、南海浩一: Med Sci Digest, 49, 787 (2023).
17) 佐野坂真人、斎藤恵美、南海浩一:特許出願中