【トピックス】
実験と計算化学を組み合わせたゲラニル二リン酸C6位メチル基転移酵素の機能解析と合理的改変による基質特異性の改変
堤 隼馬、大西康夫、勝山陽平
北里大院・感染制御科学府/東大院・農、東大院・農/東大・微生物イノベ連携機構、東大院・農/東大・微生物イノベ連携機構
1.はじめに
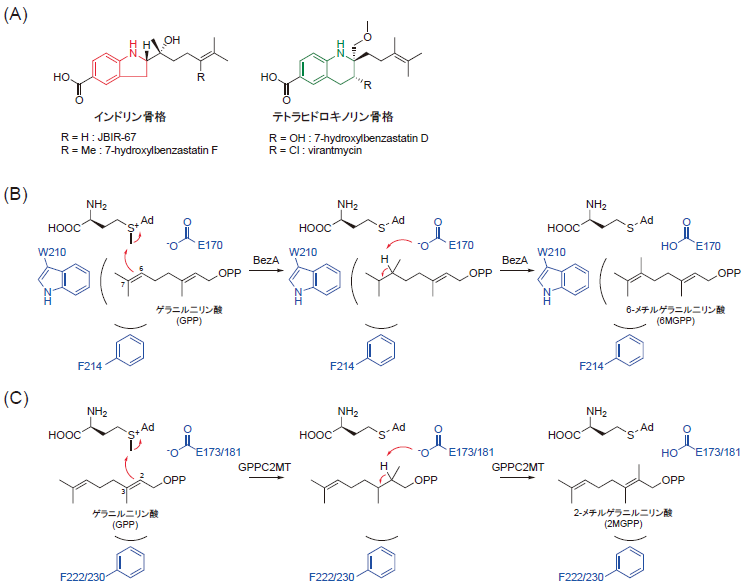
生物の生体内において、様々な代謝反応が効率的に行われている。これらの反応には様々な酵素が関与しているため、それぞれの反応を触媒する酵素を見出し、その機能を詳細に解析していくことは酵素研究において非常に重要な課題である。また、酵素反応は特異性が高く、穏和な条件で進行することから、バイオ触媒として様々な用途で産業利用される。そのため、天然の酵素の基質特異性改変や反応効率改善、耐熱性の付与などが求められ、酵素の機能改変を効率的もしくは合理的に行うことも酵素研究における重要な課題である。以上のような背景から、酵素の発見・詳細な機能解析は基礎科学的な知見を広げるのみならず、酵素の産業応用への足掛かりを与えることにつながると言える。本稿では、近年、我々がベンザスタチン (BS) 類 (図1A) の生合成研究1)から見出したゲラニル二リン酸C6位メチル基転移酵素 (GPPC6MT) であるBezAの構造解析・計算化学を利用した詳細な反応機構解析および構造に基づく合理的な機能改変の成果2)について概説する。

2. ゲラニル二リン酸C6位メチル基転移酵素BezAの発見と機能解析
BS類はp-アミノ安息香酸とゲラニル二リン酸 (GPP)を前駆体に生合成される天然物の総称であり、インドリン骨格やテトラヒドロキノリン骨格といったユニークな二環性骨格を有しているものがある (図1A)。我々は特に、ユニークな二環性骨格の形成機構を解明すべく、本化合物の生合成研究を行ってきた1)。この過程で、GPPのC6位にメチル基を転移するという、これまでに知られていない位置特異性を有する新規GPPメチル化酵素GPPC6MT (BezA) を発見した (図1B)。GPPなどのプレニル二リン酸は通常、環化3,4)や転移5)などの反応を受けた後に、修飾されることが一般的で、これらの反応の前に修飾が生じる例は非常に稀である。しかし、BezAのように、生合成反応の初発反応として、GPPなどのプレニル二リン酸をメチル化する酵素はいくつか報告されていた。例えば、methylisoborneolの生合成において、GPPのC2位へのメチル基転移酵素 (GPPC2MT) が2種の放線菌から見出されていた (図1C、Streptomyces coelicolor A3(2)由来のScGPPC2MTとStreptomyces lasalocidi由来のSlGPPC2MT)6,7)。それ以外にも、イソペンテニル二リン酸 (IPP) やジメチルアリル二リン酸のメチル基転移酵素8-10)、ファルネシル二リン酸 (FPP) のメチル化とそれに伴う環化を触媒するメチル基転移酵素11)が見出されていた。GPPC2MTは結晶構造が報告されており、その反応機構がいくつか提唱されていたが5,6)、メチル基転移という比較的簡単な反応であるにもかかわらず、その詳細は未解明であった。また、メチル基転移酵素同士はアミノ酸相同性が低い12)という特徴から、BezAと他のメチル基転移酵素との基質認識機構の違いをアミノ酸配列ベースで解析することは困難であった。このような背景から、我々はBezAの詳細な分子機構の解明を試みた。
最初に、BezAの特性、つまり、基質特異性と金属要求性を調べた。その結果、BezAはGPPのみを基質とし、イソペンテニル二リン酸 (IPP)、ジメチルアリル二リン酸(DMAPP)、ファルネシル二リン酸 (FPP)、ゲラニルゲラニル二リン酸 (GGPP) は基質としないこと、BezAの反応にはマグネシウムが必要であることが明らかになった。また、BezAの速度論解析により、GPPに対するkcat/Kmは (1.67 ± 0.11) × 10-2 μM-1s-1、S-adenosyl-L-methionine (SAM) に対するkcat/Kmは(9.26±1.62)×10-3 μM-1s-1であることが明らかになった。
3. BezAの構造解析・計算化学を利用した詳細な反応機構解析
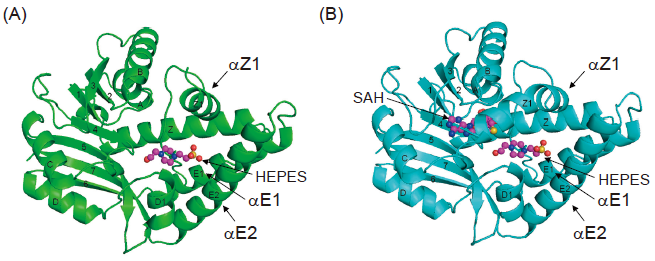
次に、X線結晶構造解析により、BezAの基質認識能や反応機構の解明を試みた。X線結晶構造解析においては、結晶化に用いたバッファー成分のHEPESが基質ポケットに入った構造 (apo-BezA, PDB ID: 7FBH) と、HEPES とS-adenosyl-L-homocysteine (SAH) の2 つの分子が基質ポケットに入った構造 (BezA-SAH, PDB ID: 7FBO) を取得することに成功した (図2A, B)。一方、基質であるGPPやメチル基ドナーであるSAMとの共結晶を取得することはできなかった。GPPとの共結晶が得られなかったのは、HEPESがGPPのポケットに強固に結合しているためであると考えられた。実際に、HEPES溶液中ではBezAのメチル化活性を見ることができなかったことからもHEPESが基質ポケットに強く結合していることが示唆された。

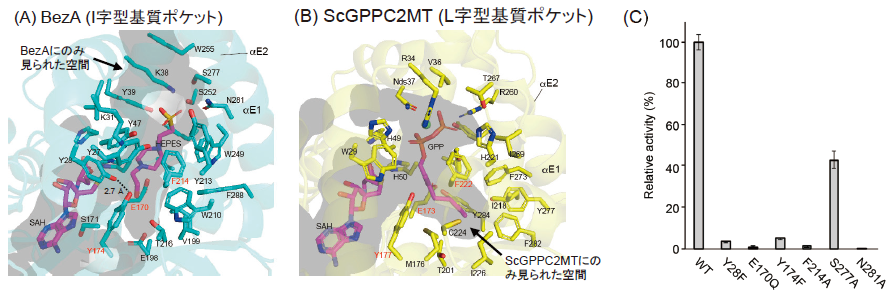
得られたBezAの全体構造に着目すると、BezAは通常のメチル基転移酵素同様、Rossmann foldをとっており、アミノ酸配列の相同性は約20%程度と低いものの構造が解明されていたScGPPC2MT (PDB ID: 3VC2) およびSlGPPC2MT (PDB ID: 4F86) とも非常に類似した構造をとっていることが明らかになった (3VC2、4F86それぞれに対して、RMSD 1.51 Å、1.15 Å)。しかし、全体構造をより詳細に見ると、BezAのαE1、αE2ヘリックスがGPPC2MTのものより長く、基質ポケットが縦に長くなっていた。また、BezAの構造間でも、BezASAHの構造において、αZ1ヘリックスがapo-BezAのものよりも長く、基質ポケットを閉じるように配置されていた (図2A, B)。さらに、このαZ1ヘリックス中の28番Tyr (Y28) と基質ポケットに存在する174番Tyr (Y174) が水素結合により相互作用することでαZ1ヘリックスが固定されていることがわかった (図3A)。実際にこれら2つのTyrのうち一方をPheに置換すると大幅に活性が減弱した (図3C)。このことから、反応時に基質ポケットを閉じるためにY28-Y174の相互作用が重要であることが明らかになった。

次に、BezAとScGPPC2MTの基質ポケットの比較を行ったところ、BezAがI字型の縦長の基質ポケットを有しているのに対し、ScGPPC2MTはL字型の基質ポケットを有していた (図3A, B)。前述の通り、BezAはGPPC2MTよりも長いαE1、αE2ヘリックスを有していることから、GPPの二リン酸の保持部位がGPPC2MTよりも上部に移動しているように見られた。また、GPPC2MTで反応に重要だと示唆されているGlu (BezA: E170、ScGPPC2MT: E173、SlGPPC2MT: E181)、Tyr (BezA: Y174、ScGPPC2MT: Y177、SlGPPC2MT: Y185)、Phe (BezA: F214、ScGPPC2MT: F222、SlGPPC2MT: F230) がBezAでも保存されていた。BezAにおいてE170QやF214Aの変異酵素はメチル化活性が消失していたことから、これらのアミノ酸残基がBezAにおいても反応に重要であることが確認された (図3C)。しかし、GPPC2MTの解析において、これらのアミノ酸の触媒反応における役割は二つの可能性が提唱されていた。Köksalらは、ScGPPC2MTの構造から、E173、F222の両アミノ酸とも反応中に生じるカルボカチオンの安定化に寄与するであろうと論じている6)。一方、Ariyawutthiphanらは、SlGPPC2MTの構造から、E181はプロトンを引き抜くための塩基としてはたらき、F230は反応中に生じるカルボカチオンの安定化に寄与していると論じている7)。そのため、これらのどちらの説が正しいか、また、BezAとGPPC2MTでは同じ機構で反応が進行しているのかを調べるため、計算化学を利用したこれらアミノ酸の機能解析を試みた。
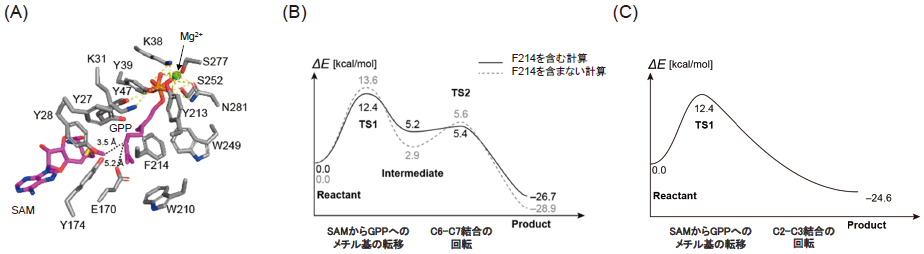
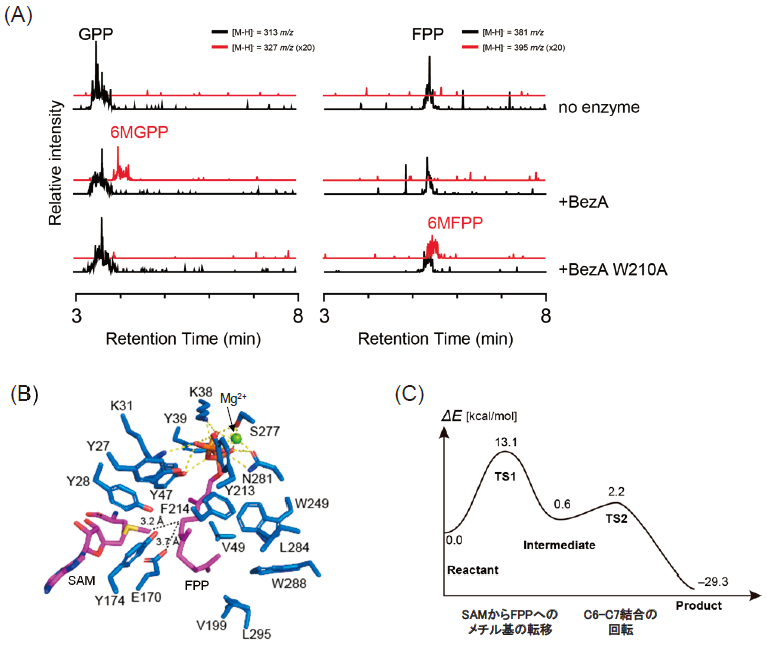
まず、BezAと基質であるGPP、補酵素であるSAMとMg2+のドッキングを行い、これらの複合体モデルを得た (図4A)。この複合体において、Mg2+はS277とN281を介してGPPの保持に関与していることが示唆され、実際に、これらのアミノ酸の置換によりメチル化活性が減弱もしくは消失していた (図3C)。次に、この複合体構造をもとに30 ns の分子動力学 (MD) シミュレーションを行ったところ、SAMのメチル基とGPPのC6位がメチル基の転移が生じうる距離に存在していた。また、ScGPPC2MTについても同様にMDシミュレーションを行ったところ、SAMのメチル基とGPPのC2位がメチル基の転移が生じうる距離に存在していた。最後に、量子力学/分子力学 (QM/MM) 計算により、反応のエネルギー計算を行った。その結果、BezAではtransition state 1 (TS1) を経由してメチル基がGPPに転移し、C7位にカルボカチオンを有するintermediateが形成されること、transition state 2 (TS2) を経由してC6位のプロトンがE170に引き抜かれ、product (6MGPP) が形成されることが明らかになった (図4B)。このとき、初期状態からTS1への活性化エネルギーは12.4 kcal/mol、intermediateからTS2へは0.2 kcal/molであった。また、F214がカルボカチオンの安定化に寄与しているかを調べるため、F214を含めないでQM/MM計算を行ったところ、intermediateからTS2に至るまでの活性化エネルギーに大きな差がなく、F214が量子的な寄与をしていない、つまり、カルボカチオンの安定化のためのカチオン-π相互作用が存在しないことが示唆された。このことより、F214は物理的にGPPを基質ポケット内で固定するために存在していると考えられた (図4B)。一方、ScGPPC2MTについてもQM/MM計算を行った結果、BezAと同様の機構で反応が進行することが明らかになった。しかしながら、ScGPPC2MTではTS1への活性化エネルギーはBezAと類似しているものの、intermediateやTS2が見られず、GPPのC2位へのメチル基の転移と同時にC2位のプロトンがE173へと転移していることが示された (図4C)。以上の解析から、BezAとGPPC2MTの反応機構の詳細を明らかにすることができた。

4. 立体構造に基づいた合理的機能改変によるファルネシル二リン酸C6位メチル基転移酵素の創出
次に立体構造に基づいてBezAの基質特異性の改変を試みた。BezAとGPPC2MTの基質ポケットを比較したところ、前述の通り、BezAはI字型のポケットの形をしていたのに対し、GPPC2MTはL字型の基質ポケットをしていた (図3A, B)。この基質ポケットの形の違いはBezAのW210が右側のスペースを塞ぐようにしているためである。このW210をAlaのような小さな側鎖をもつアミノ酸残基に置換することにより、基質ポケットが広がり、BezAもL字型の基質ポケットを有するようになることが予想された。そこで、BezA W210A変異体を構築し、この変異酵素の基質特異性を調べた。この結果、興味深いことに、BezA W210Aは元の基質であるGPPを基質として受け入れず、FPPのみを基質として受け入れる酵素になっていることが明らかになった (図5A)。さらに、BezA W210AではFPPに対するkcat/Kmは(0.66±0.01)×10-2 μM-1s-1、SAMに対するkcat/Kmは(5.57±0.18)×10-3 μM-1s-1であり、触媒能力が低下することなく、基質特異性が変化していた。次に、我々はこの基質特異性の切替えが生じた理由を考察した。BezA W210AがFPPを基質にできるようになったのは、FPPを収納可能なL字型の基質ポケットがW210A置換によって形成されたためだと考えられる。一方、BezA W210AがGPPを基質にできなくなったのは、野生型BezAではW210がGPPの結合に重要な機能を有しているからだと考えられる。W210の機能として、GPPの二重結合とのπ-π相互作用が考えられたため、W210FやW210Y変異体の解析を行ったところ、前者のGPPのメチル化能力は大幅に減弱し、後者は完全に失っていた。そのため、W210とGPPとの間のπ-π相互作用はないと考えられ、W210がGPPの炭素鎖を物理的に固定する留め具のような役割をしていることが示唆された。

最後に、ドッキングシミュレーション、MDシミュレーション、QM/MM計算により、BezA W210Aの触媒する反応を解析した。まず、BezA W210AとFPPのドッキングシミュレーションを行った結果、FPPの二リン酸部位、FPPのC1-C8の炭素鎖、C13、C14のメチル基はGPPと同様に基質ポケットに格納されるが、C9-C12の炭素鎖、C15、C16のメチル基からなるFPPの末端のイソプレンユニットはW210がA210となることでアクセスできるようになったスペースに格納されることが示された (図5B)。このスペースはV49、V199、W288、L295といった疎水性残基が作り出していた (図4B)。このように、MDシミュレーションから、FPPが安定的にBezA W210Aの基質ポケット内に収容されること、末端のイソプレンユニットがV49、V199、W288、L295といった疎水性残基により安定的に保持されていること、FPPのC6位のメチル化を受ける部位がメチル基供与体であるSAMのメチル基とメチル基転移が生じうる距離に存在していることが明らかになり、BezA W210AがFPPを基質として受け入れる妥当性が支持された。最後に、QM/MM計算により、この反応のエネルギーを計算したところ、エネルギーのプロファイルはBezAによるGPPのメチル化と非常に類似しており、BezA W210Aは、BezAと同様の機構でFPPをメチル化することが明らかになった (図5C)。
5.おわりに
以上のように、我々は天然物の生合成研究の過程で見出した新規酵素、GPP C6位転移酵素BezAの詳細な触媒機構を構造解析、計算化学による反応機構解析を用いて明らかにした。特に、本研究では構造解析と計算化学を組み合わせることにより、構造解析だけでは明らかにすることが困難なアミノ酸残基 (E170とF214) の役割の解明につながった。E170はGPPC2MTにおいて、塩基として機能するもしくはカルボカチオンの安定化に寄与すると提唱されていたが、実際には塩基であることがQM/MM計算より明らかになった。この塩基となるアミノ酸は、塩基を反応に必要としないFPPのメチル化に伴う環化を触媒する酵素以外のプレニル二リン酸メチル基転移酵素では保存されていることからも、その重要性がわかる。また、F214は芳香族アミノ酸であり、メチル基転移中に生じるカルボカチオンに近いことから、カチオン-π相互作用によるカチオンの安定化に寄与すると予想されていた。実際に芳香族アミノ酸がカチオンの安定化に寄与する例13)があることから、基質ポケット内に芳香族アミノ酸が存在する場合には安易にカチオン-π相互作用が起こっていると一般的には議論しがちである。しかし、今回、QM/MM計算からはF214が量子的な役割を果たしていないことが明らかになった。この結果は、基質ポケット内に活性に重要な芳香族アミノ酸があったとしても、その機能はカチオン-π相互作用を介したものであるとは限らないということを示している。他の酵素においても同様のケース14)があると思われるため、今回得られた知見の意義は大きいと考えられる。
本研究ではBezAの詳細な機能解析に加え、GPPを基質とする酵素からFPPを基質とする酵素 (BezA W210A) への機能の改変にも成功した。さらに、計算化学を利用することで、機能改変がどうして生じたのかを明らかにした。また、この改変に伴い、W210がGPPの炭素鎖を固定するための留め具のような役割をしていることも明らかにすることができた。
プレニル二リン酸の修飾酵素は非天然型のテルペノイド生産に応用することが可能である。例えば、IPPやDMAPPのメチル化酵素を利用することで、非天然型のカロテノイド生産10)、GPPC2MTを利用することで非天然型テルペンの生産15,16)、GPPC6MTとプレニル基転移酵素を利用することで非天然型のフラボノイドの生産17)が可能である。また、近年では、GPPC2MTをDMAPPのメチル化酵素に改変し、これを利用することで非天然型テルペノイドの生産が試みられている18)。このように、プレニル二リン酸の修飾酵素を利用することで、非天然型化合物の生産が今後も試みられていくことが予想される。
本研究は、酵素の機能解析や構造解析のようなwetの技術と計算化学のdryの技術を組み合わせることが今後の酵素の詳細な機能解析において重要になってくることを示した好例であると考えている。また、本研究において、我々は酵素の構造に基づいた機能改変にも成功した。このような酵素の詳細な機能解析や酵素改変の結果は酵素学研究の歴史の中では、ほんのわずかな情報でしかない。しかしながら、このような情報の蓄積が、近年、加速度的に成長している深層学習などに代表されるAI (機械学習) 技術と組み合わされることにより、目的の機能を有する酵素を自在にデザインする時代が到来することを期待したい。
謝辞
本研究において、様々な方々に協力していただきました。菌株及びそのゲノム配列は産業技術研究所の新家一男総括研究主幹に提供していただきました。計算化学を用いた解析は東京大学大学院農学生命科学研究科の清水謙多郎教授、寺田透准教授、森脇由隆助教に行っていただきました。化合物のLC-MS解析においては同研究科の尾仲宏康特任教授、浅水俊平特任講師に装置を使用させていただきました。BezAの構造解析においては高エネルギー加速器研究機構のスタッフにサポートしていただきました。また、本研究は日本学術振興会からの支援 (19H04645、19H05685、18J14650) で行ったものです。この場を借りて厚く御礼申し上げます。
文献
1) Tsutsumi, H., Katsuyama, Y., Izumikawa, M., Takagi, M., Fujie, M., Satoh, N., Shin-ya, K., Ohnishi, Y.: J. Am. Chem. Soc., 140, 6631 (2018).
2) Tsutsumi, H., Moriwaki, Y., Terada, T., Shimizu, K., Shin-ya, K., Katsuyama, Y., Ohnishi, Y.: Angew. Chem. Int. Ed., 61, e202111217 (2022).
3) Christianson, D. W.: Chem. Rev., 117, 11570 (2017).
4) Rudolf, J. D., Chang, C. Y.: Nat. Prod. Rep., 37, 425 (2020).
5) Winkelblech, J., Fan, A., Li, S. M.: Applied Microbiology and Biotechnology, 99, 7379 (2015).
6) Köksal, M., Chou, W. K. W., Cane, D. E., Christianson, D. W.: Biochemistry, 51, 3003 (2012).
7) Ariyawutthiphan, O., Ose, T., Minami, A., Sinde, S., Tsuda, M., Gao, Y. G., Yao, M., Oikawa, H., Tanaka, I.: Acta Crystallogr. Sect. D, 68, 1558 (2012).
8) Ozaki, T., Shinde, S. S., Gao, L., Okuizumi, R., Liu, C., Ogasawara, Y., Lei, X., Dairi, T., Minami, A., Oikawa, H.: Angew. Chem. Int. Ed., 57, 6629 (2018).
9) Radhika, V., Ueda, N., Tsuboi, Y., Kojima, M., Kikuchi, J., Kudo, T., Sakakibara, H.: Plant Physiol., 169, 1118 (2015).
10) Drummond, L., Kschowak, M. J., Breitenbach, J., Wolff, H., Shi, Y. M., Schrader, J., Bode, H. B., Sandmann, G., Buchhaupt, M.: ACS Synth. Biol., 8, 1303 (2019).
11) Von Reuss, S., Domik, D., Lemfack, M. C., Magnus, N., Kai, M., Weise, T., Piechulla, B.: J. Am. Chem. Soc., 140, 11855 (2018).
12) Struck, A. W., Thompson, M. L., Wong, L. S., Micklefield, J.: ChemBioChem, 13, 2642 (2012).
13) Ito, R., Hashimoto, I., Masukawa, Y., Hoshino, T.: Chemistry, 19, 17150 (2013).
14) Raz, K., Driller, R., Dimos, N., Ringel, M., Brück, T., Loll, B., Major, D. T.: J. Am. Chem. Soc., 142, 21562 (2020).
15) Ignea, C., Pontini, M., Motawia, M. S., Maffei, M. E., Makris, A. M., Kampranis, S. C.: Nat. Chem. Biol., 14, 1090 (2018).
16) Kschowak, M. J., Wortmann, H., Dickschat, J. S., Schrader, J., Buchhaupt, M.: PLoS One, 13, e0196082 (2018).
17) Tsutsumi, H., Urano, N., Katsuyama, Y., Ohnishi, Y.: Biosci. Biotechnol. Biochem., 86, 1270 (2022).
18) Xia, C. Y., Lu, B. W., Cui, J. Y., Wang, B. Y., Sun, Y. Y., Gan, F.: Synth. Syst. Biotechnol., 8, 107 (2023).