【トピックス】
乳酸菌Lactiplantibacillus plantarumのフェルラ酸代謝機構の解明と有用生理活性物質生産への応用
三井亮司、矢野嵩典、栢木宏之、阿波里佳、西谷洋輔、桒原浩誠
岡山理科大・生命科学、岡山理科大・生命科学、丸善製薬・総合研究所、丸善製薬・総合研究所、丸善製薬・総合研究所、丸善製薬・総合研究所
1.はじめに
乳酸菌は多くの発酵食品や醸造の製造工程に関与しており、古くからの豊富な食経験に基づく安全性から食品産業分野を中心に多用されている。また、近年では腸内細菌に関する研究に注目が集まり、腸内細菌叢と健康との関係性も頻繁に議論されるようになった。乳酸菌の摂取は生死菌を問わず腸内細菌叢の改善に寄与するとされ、腸内細菌叢がヒトの健康におよぼす要因のひとつとして短鎖脂肪酸に代表される腸内細菌代謝産物があげられる。
本研究ではヒトへの生理活性が知られる植物由来の化合物の幾つかを摂取すると、血清や尿中に共通して腸内細菌代謝産物と予測される3-(4-hydroxy-3-methoxyphenyl) propionic acid (HMPA、ジヒドロフェルラ酸) が検出されることに着目した (図1)。例えばヒトによるコーヒー摂取後のクロロゲン酸の体内動態の 研究において、HMPAが血清中に高濃度で検出されたり1)、腸内を模した嫌気的環境下で糞便懸濁液にクルクミンを作用させたりした場合にも検出されている2)。また、全粒小麦食品の摂取試験においても血中HMPA濃度が精製小麦摂取群よりも数倍高いという報告3)や柑橘類に含まれるヘスペリジンや、玄米、米ぬかに含まれるγ-オリザノールの摂取においても人や動物の尿中からHMPAが検出されることも報告されている4,5)。このことからHMPAがこれら化合物の生理活性の本体化合物であることも予測される。HMPAが検出される化合物に共通する構造としてフェニルプロパノイドのケイ皮酸誘導体があげられる。摂取されたこれらの化合物が腸内細菌により代謝されることによりHMPAを産生していることが予想された。我々は、のちの機能性食品素材としてのHMPA発酵生産を見据え、乳酸菌のHMPA生成活性に着目して研究を行ってきた。本稿ではHMPAの前駆体の4-Hydroxy-3-methoxycinnamic acid (フェルラ酸)を乳酸菌Lactiplantibacillus plantarumがHMPAに変換する反応、および関わる還元酵素の反応機構について紹介する。
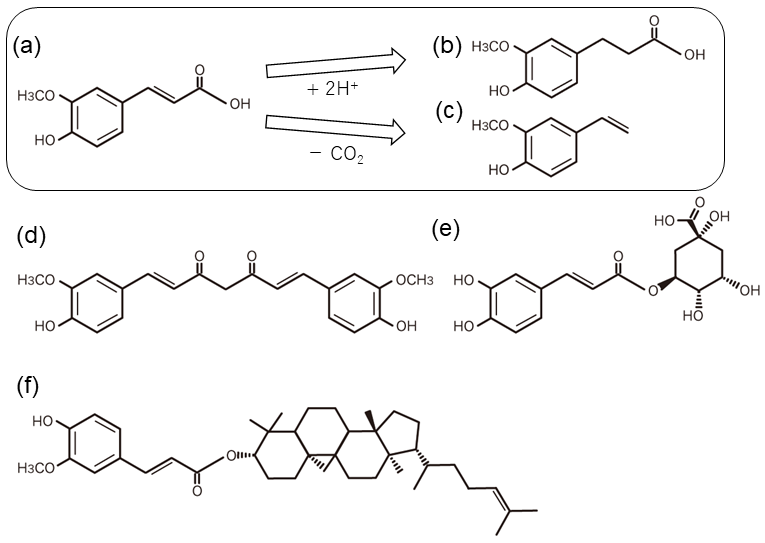

2.機能性表示食品素材HMPA
HMPAは図1にあげた化合物などの摂取による腸内細菌代謝産物と考えられる。その他にも黒酢6)、味噌、ぬか漬けなど植物性素材の食品からも検出される。いずれも食経験が豊富で健康をイメージさせる発酵食品でもあり、かつ「ぬか」が残った状態の素材が使用されているところが興味深い。「ぬか」にはHMPA前駆体であるフェルラ酸が遊離体あるいは結合体で存在している。
HMPAは豊富な食経験に加えてこのヒトへの有効性も報告されており、年齢20歳以上65歳未満の健常な成人男女を対象に、12週間継続摂取(23 mg/day)させたランダム化二重盲検プラセボ対照並行群間比較試験において腹部脂肪面積及びウエスト周囲径に有意な低下が報告されている7,8)。このことからHMPAは新規機能性表示食品として『BMIが高めの人の腹部の脂肪とウエスト周囲径を減らす機能が報告されています。』のヘルスクレームが受理されている。またHMPAの機能性は基礎研究やヒト試験などで、体脂肪減少機能以外にも有効性のあることが示唆されている。現在この素材を使用した最終商品も市場に出つつある。
3. Lactiplantibacillus plantarumによるHMPAの生成と関与する酵素
3-1 L. plantarumによるフェルラ酸からHMPAの生成
図1に示したようにL. plantarumは培地中にフェルラ酸が存在すると、これに由来する異なる2つ生成物を生じることが報告されている9,10)。1つは今回の目的産物であるフェルラ酸のプロペン酸部分が還元を受けたHMPAを生成する反応で、もう一方は脱炭酸により4-ビニルグアイアコール (4-VG) が生成する反応である (図1)。4-VGはフェルラ酸の加熱による非酵素的な生成の他、酵母や乳酸菌のフェルラ酸デカルボキシラーゼによる酵素的生成によるものも知られている。4-VGは清酒や焼酎においては煙様やスパイス様の香りとしてネガティブに評価されるが、沖縄で製造される蒸留酒の泡盛では貯蔵期間が長く、その間に4-VGが変化して生じるバニリンがクース (古酒) の特長香のひとつともなる。
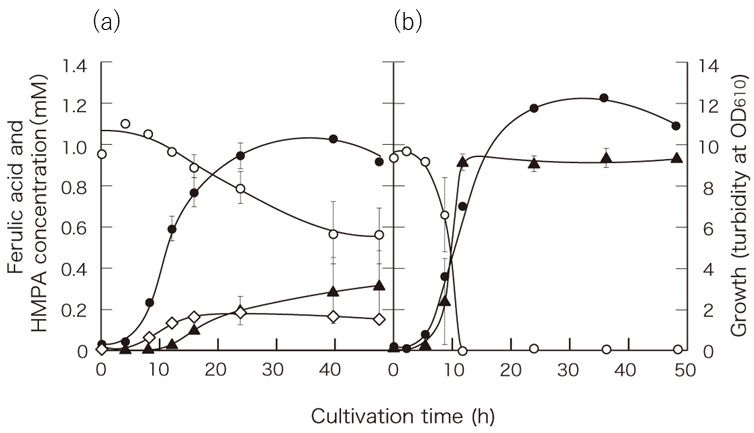
乳酸菌培養に一般的に用いられるMRS培地にフェルラ酸を加えてL. plantarumを培養すると既報の通りHMPAと4-VGが生成した。本研究の初期では2つの生成物比率が培養毎になかなか安定しなかったが、HMPAのみを生成させる培養法を様々に検討するなか、厳密に培養開始時の溶存酸素濃度をコントロールすることが鍵になることが明らかになった (図2)。密閉容器を用いてかつ、できる限りヘッドスペースを小さくし、培養液中の溶存酸素濃度を低く保った培地を用いて培養を開始すると4-VGの生成がなく、添加したフェルラ酸に対してほぼ100%の収率でHMPAを生成させることが出来た。添加したフェルラ酸に対してほぼ全てがHMPAに変換されて培養液中に検出できることから、L. plantarumにとってHMPAはエンドプロダクトであり、フェルラ酸を電子受容体として利用する乳酸発酵と競争的に行われる反応であることが予想された。一方で溶存酸素濃度が一定以上の培養で4-VGが生成する理由についても興味が持たれた。

3-2 フェルラ酸代謝に関わる酵素の探索
L. plantarumにおいてフェルラ酸存在下で誘導される酵素を探索するため、フェルラ酸を添加したものと非添加にした培地を用いて培養した菌体から調製したtotal RNAを用いてRNA-seq解析を行った。この結果、フェルラ酸に応答して強く誘導を受ける遺伝子は3つのみであった。いずれも酵素をコードするもので、うち2つはゲノム上でオペロンを構成していることが確認できた。これらの酵素はそれぞれNAD(P)H依存型のFAD/FMNレダクターゼおよびフマル酸を還元するフマル酸レダクターゼ、およびフェノール酸を脱炭酸するフェノール酸/フェルラ酸デカルボキシラーゼ (Pdc) と相同性を示した。本研究と時期を同じくしてオペロンを構成する前2つの酵素はHcrAおよびHcrBとしてケイ皮酸の還元に関わることが報告され、HMPAの生成に関わることが示唆された11)。また興味深いことに3つ目のPdcに関しては生成物の4-VGが検出されない低溶存酸素下での培養においても、フェルラ酸の添加で強い誘導を受けていることが明らかになった。このことから溶存酸素の濃度にかかわらずフェルラ酸を添加した条件で培養した菌体内には常にこれら3つの酵素が共存していることが予測された。しかし培養条件とHMPA、4-VGの2つの生成物の関係、酵素の詳細などについてもまだ不明な点が多く酵素を取得して詳細を検討した。
3-3 フェルラ酸還元酵素HcrAとHcrB
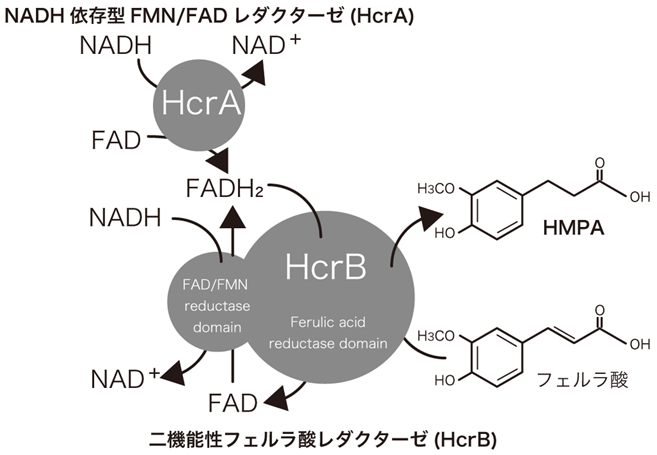
HcrAとHcrBをそれぞれ大腸菌において発現させて精製した酵素標品を用いてフェルラ酸の還元活性について検討を行った。HcrBの精製酵素に補酵素としてNADHとFADあるいはFMNを加えた反応液を用いるとHcrB単体でフェルラ酸の還元活性が検出された。また、興味深いことにFMNレダクターゼのHcrAは単体ではフェルラ酸への還元活性は持たないが、HcrBと混合して反応した際にはHcrB単体の時より倍以上の活性を示した。つまりHcrAはNADHを用いてFADを還元し、その後HcrBにFADH2が受け渡されフェルラ酸還元に利用されていることが明らかになった (図3)。またHcrB単体でもフェルラ酸の還元活性を持つ理由としてはHcrBのサブユニットを構成するおよそ800アミノ酸残基のうち、N末端から200アミノ酸まではHcrAとかなり高い相同性を有しているためであると考えられる。このN末端領域にFAD/FMNレダクターゼ活性を有した二機能性酵素であることが示唆された。
![]()
3-4 L. plantarumにおけるフェルラ酸還元の意義
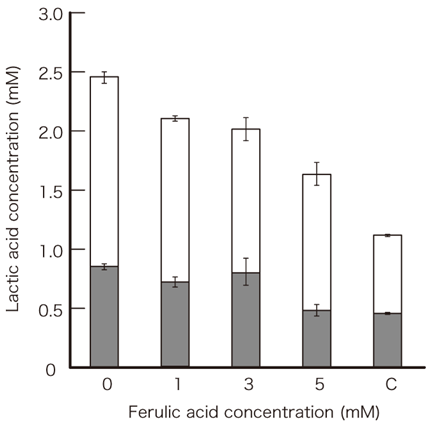
乳酸発酵は解糖で生じたNADHが同じく解糖で生じたピルビン酸を還元してNAD+にリサイクルされると同時に乳酸が生じることとされる。しかしL. plantarumにおいてはフェルラ酸を添加することでNADHを積極的にフェルラ酸還元に利用していることが確認された。L. plantarumの休止菌体を用いてグルコース存在下で乳酸生成量を測定した結果、反応液中のフェルラ酸濃度を増加させると、乳酸生成量が減少すること、またフェルラ酸の還元は活発に解糖が起こる対数増殖期に限られた現象であることから、L. plantarumはフェルラ酸存在下で乳酸発酵よりもフェルラ酸還元を優先していると考えられた (図4)。フェルラ酸をNAD+再生に用いる利点は、乳酸菌の炭素源、エネルギー源である糖を効率的に利用するために解糖産物を利用することなく、外部添加されたフェルラ酸を還元してNAD+再生が達成できることであり、L. plantarumにとって生育に有利に働くのではないかと考えられる。

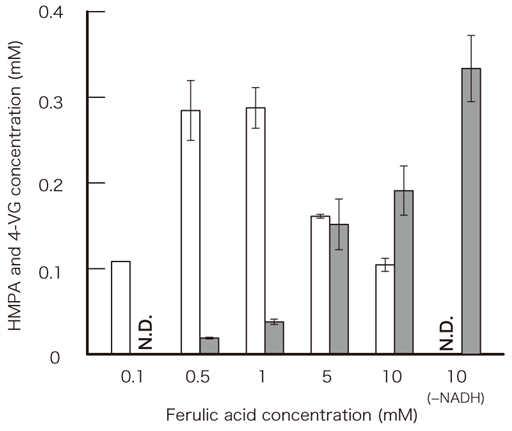
3-5 フェルラ酸からHMPA、4-VGの生成条件
L. plantarumの培養液にフェルラ酸を添加して培養すると、フェルラ酸還元に関わるHcrAおよびHcrBに加えて脱炭酸酵素のPdcが菌体内に共存することは先に述べた。低溶存酸素下のHMPAのみを生成する条件で培養した菌体から粗酵素液を調製してPdc活性を測定すると、フェルラ酸から4-VGを生成するに十分な活性を保持していることも確認できた。しかし低溶存酸素下で培養した菌体では4-VGの生成は見られず、HMPAのみを生成する。そこでPdcも同様に大腸菌において発現させた後、精製酵素を用いてその理由について検討した。その結果、PdcのKm値は酵母で知られるもの (0.18 mM)11)とは明らかに異なり、30.4 mMと高い値を示した。このことから3つの精製酵素をおおよそ等モルずつ反応液中に加えてNADHおよびFAD存在下でフェルラ酸濃度と生成物との関係を調べるとフェルラ酸を低濃度で添加した場合にはHMPAが優先的に生成し、高濃度になるにつれて4-VG生成量が増加すること、NADH非存在下では4-VGのみが生成することが明らかになった (図5)。以上より菌体内で3つの酵素が存在しても低濃度でフェルラ酸が維持されている場合には4-VGの生成はほとんど見られないものの、溶存酸素濃度が高い状況では菌体内NADH量が低下することにより、4-VGがフェルラ酸の主要な生成物となった。培養時の4-VGの生成にはフェルラ酸濃度と溶存酸素濃度、さらに菌体内の酸化還元電位が強く関係していることが明らかになった。

4.おわりに
HMPAは無色無味、熱にも安定で比較的水溶性も高いことから機能性食品素材として様々な展開が期待される。抗酸化活性にも優れておりフェノール性水酸基と短鎖脂肪酸を併せ持ったような構造からヒト・動物体内での動態についても興味がもたれる。HMPAはケイ皮酸誘導体などの化合物から腸内細菌が触媒となって生成することを考えると、いわゆる身体に良い食品を摂取しても腸内環境によっては受けられる恩恵に制限があることも考えられる。あらかじめ乳酸菌で発酵させて生産されたHMPAは腸内細菌での変換を見越した生理活性物質の本体化合物を摂取すること、と考えると腸内環境に左右されずに恩恵を受けられるというストーリー性も併せ持つ。
本稿で紹介させていただいたL. plantarumによるHMPA生産は溶存酸素など培養条件が比較的厳密で、また基質となるフェルラ酸の仕込み濃度を高くすると副産物である4-VGの生成が顕著になる。このことから現在では効率的生産に適したフェルラ酸脱炭酸活性を持たない新たな乳酸菌Weissella cibaria YN2株を取得し、高濃度仕込みによる効率的生産を達成している。HMPA生成は乳酸発酵と競争的に行われる反応であり、L. plantarumは主としてホモ型の乳酸発酵菌である。一方W. cibariaはヘテロ型の乳酸発酵菌でL. plantarumに見られるHcrAやHcrBは存在しないことがわかっている。W. cibariaにはヘテロ乳酸発酵と連動したフェルラ酸還元機構があると考えられ、現在代謝機構や関わる酵素について解析を進めている。
L. plantarumは植物性の発酵食品において高い頻度で検出される乳酸菌であり、これによるフェルラ酸からの4-VGの生成は製品の臭いとも強く関連するため、製品品質向上への知見にもなることが期待される。
謝辞
本研究は令和元年度採択、戦略的基盤技術高度化支援事業「メタボリックシンドローム予防を目的とした革新的な機能性食品素材 (米ぬか発酵代謝物) の研究開発」の一環として実施されたものです。関係の方々に御礼申し上げます。
文献
1) Stalmach, A., Steiling, H., Williamson, G., Crozier, A.: Arch. Biochem. Biophys., 501, 98 (2010).
2) Tan, S., Calani, L., Bresciani, L., Dall’asta, M., Faccini, A., Augustin, M., Gras, S., Rio, D.: Int. J. Food Sci. Nutr., 66, 790 (2015).
3) Vitaglione, P., Mennella, I., Ferracane, R., Rivellese, A., Giacco, R., Ercolini, D., Gibbons, S., Storia, A., Gilbert, J., Jonnalagadda, S., Thielecke, F., Gallo, M., Scalfi, L., Fogliano, V.: Am. J. Clin. Nutr., 101, 251 (2015).
4) Van Rymenant, E., Salden, B., Voorspoels, S., Jacobs, G., Noten, B., Pitart, J., Possemiers, S., Smagghe, G., Grootaert, C., Van Camp, J.: Mol. Nutri. Food Res., 62, 1700881 (2018).
5) Fujiwara, S., Sakurai, S., Sugimoto, I., Awata, N.: Chem. Pharm. Bull., 31, 645 (1983).
6) Shimoji, Y., Tamura, Y., Nakamura, Y., Nanda, K., Nishidai, S., Nishikawa, Y., Ishihara, N., Uenakai, K., Ohigashi, H.: J. Agric. Food, Chem., 50, 6501 (2002).
7) 吉野 進, 川上秀昭, 清水隆麿, 小野貴弘: 薬理と治療, 49, 1639 (2021).
8) 吉野 進, 川上秀昭, 清水隆麿, 小野貴弘: 薬理と治療, 50, 1031 (2022).
9) Knockaert, D., Raes, K., Wille, C., Struijs, K., Van Camp, J.: J. Sci. Food Agric., 92, 2291 (2012).
10) Barthelmebs, L., Divies, C., Cavin, J. F.: Appl. Environ. Microbiol., 66, 3368 (2000).
11) Santamaría, L., Reverón, I., López de Felipe, F., de Las Rivas, B., Muñoz, R.: Appl. Environ. Microbiol., 84, e01123-18. (2018).
12) Lin, F., Ferguson, K. L., Boyer, D. R., Lin, X. N., Marsh, E. N. G.: ACS Chem. Biol., 10, 1137 (2015).