【トピックス】
細胞の動的なパターニングのための光活性化細胞付着表面
山口哲志、小阪高広 岡本晃充、山平真也
東大院・工、東大院・工、東大院・工、京大院・生命科学
1.はじめに
近年の細胞生物学や細胞工学の進歩は、細胞培養技術に大きく依存している。細胞の培養は 19 世紀後半に始まり、100 年以上にわたって発展してきた。1952 年にヒトのがん細胞株である HeLa 細胞が報告された後1)、さまざまなタイプのヒト細胞株が樹立された。これらの細胞株は、病院から細胞を直接入手できない研究者に、ヒト細胞を供給することを可能にし、がんおよび正常細胞のモデルとして広く使用されてきた。その結果、細胞生物学において、世界中の研究者が生命現象のモデルを培養皿の上で扱えるようになり、今日知られている多くの生命分子システムの解明につながった。工学の面では、細胞培養技術は、サイトカインや抗体などのバイオ医薬品を生産するために不可欠になっている。また、培養細胞は医薬品候補の評価や探索にも使用されている。最近では、iPS細胞をはじめとした幹細胞を培養し、目的の体細胞に分化させた後、体内に投与する再生医療や細胞治療も行われている。これらの学術的な成果や医工学技術は、細胞培養技術によってもたらされている。
このような背景から、細胞培養技術には、体内における細胞本来の機能や振る舞い (表現型) を細胞外で再現することが求められてきた。そのために、さまざまな培地が開発され2)、細胞外マトリックスとして機能するコラーゲンやラミニンなどの培養足場基材も開発されてきた3)。一方で、現在においても、細胞の機能や表現型を生体外で再現するには幾つもの課題がある。体内の細胞の多くが、周囲の細胞との相互作用によってその機能を制御されている4)。例えば、脳組織においては、ニューロン間のシグナル伝達とグリア細胞との相互作用が、細胞の表現型を決定している5)。免疫細胞は、抗原を提示している様々な細胞との相互作用によって、その機能を変化させる6)。従って、このような細胞の機能を再現するには、生体内と同様の細胞間相互作用を再現する必要がある。ここで、細胞間相互作用の時間的・空間的な特徴を再現するには、複数種類の細胞の配置を望みのタイミングで操作する技術が必要となる。そのような動的な細胞配置技術として、我々の研究グループでは最近、光応答性の細胞パターニング技術を開発してきので紹介する7,8)。
2.細胞のパターニング技術
基板上に細胞を配置する技術は「細胞パターニング技術」と呼ばれ、30年ほど前から盛んに研究が進められている。以下、単一細胞レベルの精度で複数種類の細胞を配置する技術としての応用に焦点をあて、代表的な既存の技術の長短について簡単に解説する。
2-1 ソフトリソグラフィー
1997年に、Whitesides らがソフトリソグラフィーによってフィブロネクチンを基板上に配置し、血管内皮細胞をパターニングした9)。ソフトリソグラフィーは、凹凸のあるポリジメチルシロキサン (PDMS) の型を目的の分子を含むインクに浸し、表面に分子を吸着させた後、基板上に押し付けて、凸型のパターンに応じて分子を付着させる。この付着した細胞接着分子に細胞が接着して、細胞の微細なパターンが作製できる。ソフトリソグラフィーは、非常に高解像度のパターン (100~500 nm) を実現でき、単一細胞レベルの精度での配置を実現できる。また、実験室レベルで比較的簡単に実施できる。しかし、複数種類の細胞を望みの位置に望みのタイミングでパターン化するのは困難である。1種類目の細胞を配置した後、基板表面は培地に浸された状態であるため、2種類目の細胞のために分子を基板表面に押し付けるのが原理的に難しい。水中に分散しない疎水性の分子を2種類目として配置する技術も報告されているが10)、親水性の細胞接着因子の配置には不向きである。従って、一般的には、複数種類の細胞を自在に配置して、細胞間相互作用を再現するのには制限のある技術であると言える。
2-2 インクジェットプリンティング
複数種の細胞を基板上にパターニングする技術として、インクジェットプリンターを用いて精密に細胞を吐出する技術が研究されている。近年では、1細胞ずつを吐出する確実性の向上と細胞へのダメージの低減といった当初の課題が克服されつつある11)。この技術では、コンピューター上でデザインしたパターン通りに複数種類の細胞を望みのタイミングで配置していくことができる。しかし、基板への付着は細胞自身の接着性に依存するため、接着細胞にしか応用できず、接着するまでの時間にパターンが乱れてしまうという課題もある。そこで、近年、3次元造形 (3Dバイオプリンティング) への応用が主ではあるが、迅速にゲル化する材料と一緒に吐出する技術が広く利用されている12)。この手法では、ゲルとともに細胞を基板に瞬時に配置でき、上記の課題を解決できる。一方で、配置直後は隣接する細胞との間にゲル材料が存在するため、細胞間の相互作用が妨げられる。このように、単一細胞同士の相互作用を望みのタイミングで形成するのは依然として困難である。また、スケールアップにおいて、数千~数万個の細胞を1細胞ずつ正確に吐出するには時間がかかることもこの技術の課題である。
2-3 刺激応答性材料修飾基板
刺激応答性材料は、外部刺激によってその特性を遠隔操作できる。従って、刺激に応じて細胞付着性を変換できる材料を基板表面に修飾することによって、細胞の付着を特定の刺激によって操作可能となる。これまでに、熱13)や電位14)、光15-18)といった物理的な刺激や、その他の分子刺激19,20)によって操作できる基板が報告されている。これらの様々な刺激の中で、光は比較的簡便に照射でき、高い空間的、時間的な分解能を有している。そこで、光に応答して、複数種類の細胞を順次単一細胞レベルの精度で配置できる基板が報告されている21)。また、光は、基板への配線なども必要なく、光が透過できる場所であればどんな基板表面でも利用できる。大きなフォトマスクを用いて大面積に照射すれば、膨大な細胞数のパターンを容易に作ることも可能である。
しかし、従来技術は細胞自身の接着性を利用して配置するため、非接着・弱接着性の細胞には応用できない。ここで、非接着性の細胞の中には、免疫細胞や白血病細胞など、創薬や治療に関わる重要な細胞が多く含まれる。また、非特異的に吸着した細胞を洗浄除去する際に剥がれない程度の強い接着状態に至るのに数時間以上かかり、複数種類の細胞を配置するには、長時間の接着過程を繰り返す必要がある。そのため、2種類目以降の細胞の配置中に、1種類目の細胞が動いてしまったり、細胞間相互作用が始まってしまったりして、望みの配置、タイミングで細胞間相互作用を観察することが困難である。従って、細胞の接着性に関わらず幅広い細胞に応用可能で、細胞付着時間のより速い光応答性基板の開発が望まれる。
3.光反応性細胞付着表面
3-1 光反応性材料の開発と細胞パターニング技術の確立
上記の従来法の課題を解決するために、我々は、光反応性の細胞付着表面を開発した7)。この表面には、図1に示すような光反応性材料を修飾した。この材料には、ジベンゾシクロオクチン (DBCO) の光活性化可能な前駆体 (photoactivatable DBCO: pDBCO)22)を使用した。このpDBCOを長い ポリエチレングリコール (PEG) 鎖 (Mn: 5000 (g/mol)) の末端に結合し、もう一方の末端には基板表面に修飾するための活性化エステルを導入した (図1A)。この材料 (pDBCO-PEG-NHS) を基板表面に修飾すると、PEG層の上にpDBCOが提示される。ここで、PEGは、細胞の接着を阻害するために広く使用されており23)、光を照射していない表面への細胞の非特異的接着を抑制することを期待して設計した。また、pDBCOは、紫外光照射によってDBCOに変換され、クリックケミストリーとして広く知られている歪み促進型アジド-アルキン環化付加反応 (Strain-Promoted Azide-Alkyne Cycloaddition:SPAAC) を介して、生理学的条件下で、選択的にアジドと結合する (図1B)。従って、アジド基を持つ細胞付着分子を作用させると、光を照射した表面にのみ修飾される。この表面に細胞を播種すると、細胞付着分子との結合を介して、光照射領域にのみ細胞を配置できる。ここで、アジド基さえ導入できれば、どんな細胞付着分子も利用できるため、適切な細胞付着分子を選ぶことによって任意の細胞をパターニングできる。また、細胞表面に迅速に結合できる細胞付着分子を採用すれば、迅速にパターニングすることもできると考えた。
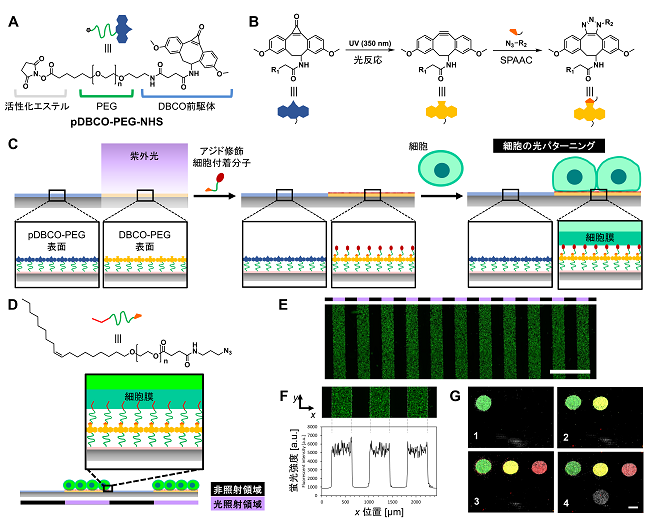

まず、細胞付着分子として、PEG脂質を用いた。PEG鎖の末端に脂質がつながったPEG脂質は、細胞表面の脂質二重膜に自発的に付着するため、細胞表層を改質する用途に広く使用されている24)。また、PEG脂質を基板に修飾すると、細胞膜への付着を介して、あらゆる種類の細胞を短時間に基板へ固定化できることも知られている25)。そこで、PEG脂質にアジドを導入した分子 (Lipid-PEG-azide) を合成し (図1D)、線状パターンの光を照射したpDBCO-PEG-NHS修飾基板に作用させた。この基板に非接着性 (浮遊性) のマウスプロB細胞 (BaF3細胞) を播種し、10分間静置後、付着していない細胞を洗い流したところ、細胞は光の照射パターンに応じて線状に配置された (図1E)。このように、本基板上でアジド化したPEG脂質を用いると、従来の基板では配置できなかった接着性の無い細胞を迅速に配置できた。また、非照射領域にはほとんど細胞の付着は見られず、高いコントラストでパターニングできることも示された (図1F)。
上記と同様にして、緑色に蛍光染色したヒト白血病T細胞 (Jurkat細胞) を円状に配置した後、①光照射と②Lipid-PEG-azideの修飾、③細胞の播種、④洗浄のサイクルを同一基板表面上の別の場所で繰り返すことによって、緑色と赤色の二色で染めた細胞、赤色で染めた細胞、無染色の細胞を順次配置することができた (図1G)。このように、数時間以内に4種類の細胞を迅速かつ精緻に配置できることが示された。また、コラーゲンで被覆したガラス基板上にpDBCO-PEG-NHSを修飾し、ヒト結腸腺癌HCT116細胞を付着して1日間培養して接着伸展させた後、BaF3細胞を同一基板上で光配置することもできた。このように、今回開発した基板は、細胞の接着性に関わらず、多種類の細胞を望みのタイミングで配置し、培養することが可能である。
3-2 1細胞アレイの構築
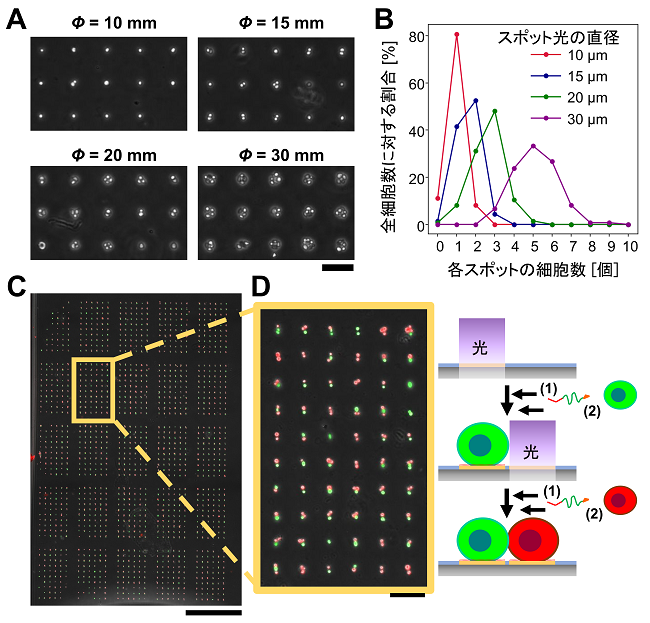
この基板上に微細な光のスポットを照射することによって、細胞を1つずつ並べることもできる7)。フォトマスクを通してサイズの異なるスポット光を照射し、Lipid-PEG-azideを用いて細胞を配置すると、Jurkat細胞の場合、直径10µmのスポット光を照射することによって80%程度のスポットに1細胞が配置された精緻な細胞アレイを構築できた (図2A, 2B)。また、レーザー描画装置を用いてスポット光を望みの位置に照射することによって、二種類の細胞を並べて配置することもできた。Jurkat細胞を緑色と赤色の二色の蛍光で染色し、まず緑色の細胞を1細胞ずつ並べた後、隣接する場所にスポット光を照射し、赤色の細胞を配置した。その結果、光を二回照射した領域のうち、43%の場所で二種類の細胞が一つずつ隣接していることが確認され、基板上に数千個の細胞ペアが並んだアレイを構築できた (図2C, 2D)。このように、基板上で複数種類の細胞を1細胞レベルの精度で配置し、観察できることが示された。

3-3 様々な細胞付着分子を介した細胞の光配置
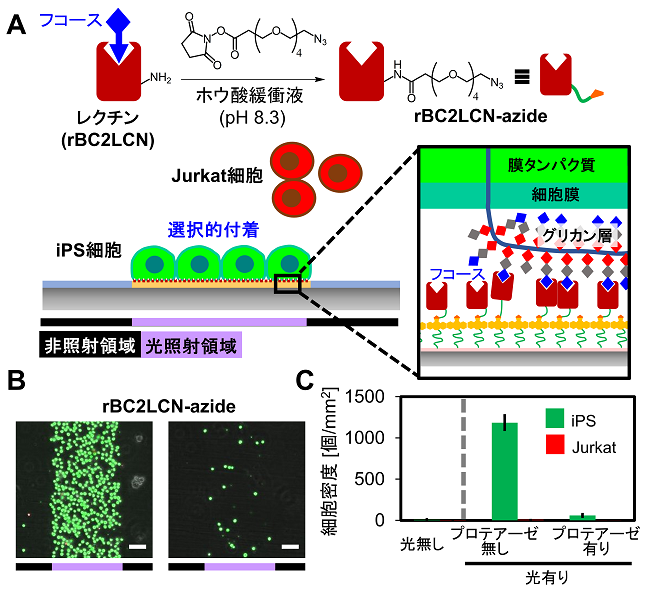
この基板の汎用性を示すために、PEG脂質以外の細胞付着分子の利用も試みた7)。まず、糖結合タンパク質 (BC2L-C) のN末端の糖結合ドメイン (rBC2LCN) を用いた。rBC2LCNは、ヒトのiPS細胞などの分化多能性細胞の表層に特異的に存在する糖鎖に結合することが知られている26)。線状のパターン光を照射した基板に、アジドを修飾したrBC2LCNを作用させて、iPS細胞とJurkat細胞の混合懸濁液を播種したところ、iPS細胞だけが選択的に光照射領域に付着した (図3)。この付着したiPS細胞にプロテアーゼを作用させると、簡単にiPS細胞が脱着した。これより、レクチンの特異的な結合を介して、iPS細胞を選択的にパターニングできることが確認された。同様に、抗体結合タンパク質であるプロテインGにアジドを導入し、光照射領域に修飾した。ヒトがん細胞表層の抗原タンパク質 (エピレギュリン) に対して結合する抗体をこの基板表面に作用させ、HCT116細胞を播種したところ、高いコントラストでHCT116細胞がパターニングされた。このように、このプロテインG修飾表面を用いれば、様々な抗体を作用させることで、望みの細胞を選択的に配置することが原理的に可能である。

以上のように、光反応性の材料を用いて、多様な細胞付着分子を介して、迅速かつ正確に、また、選択的に細胞を光配置できる表面を開発した。この表面は、細胞付着分子を望みの場所に望みのタイミングで提示できる。これは、生理条件下で細胞や培地の成分とは全く反応せずに特定の反応基同士の反応のみが迅速に進行するSPAAC反応の性質 (生体直交性) に因る。本稿では、光照射領域に1種類の細胞付着分子を修飾した例を報告したが、性質の異なる複数種類の細胞付着分子を混ぜて修飾することによって、より多様な技術的ニーズに応えられることも最近の検討で分かっている。このように望みのタイミングに特定の場所での細胞の付着を自在に設計できるこの基板の長所を利用して、一細胞ゲノミクスや細胞競合アッセイ、オルガノイド創製など、基礎細胞生物学から創薬・組織工学までの広範な研究分野への応用を現在試みている。
4.光活性化細胞付着剤
4-1 光活性化PEG脂質の開発
上記の光反応性細胞付着表面は、光照射領域に対して様々な細胞付着剤を修飾でき、多様な応用が期待される。一方で、細胞付着剤をSPAAC反応で修飾するのに30分から2時間程度の時間を要する。従来の光で細胞付着力が活性化される材料を用いた基板では、付着の機構を用途ごとに変えることはできないが、光活性化に要する時間しか必要なく、より迅速に細胞の配置を変えることができる。そこで、我々は、PEG脂質に光活性化能を付与することによって、新しい光活性化細胞付着剤を開発した8)。PEG脂質は上記のとおり、細胞の接着性に関わらず、幅広い細胞を迅速に基板上に付着できる。従って、従来の光応答性細胞付着材料における課題を解決できると考えた。
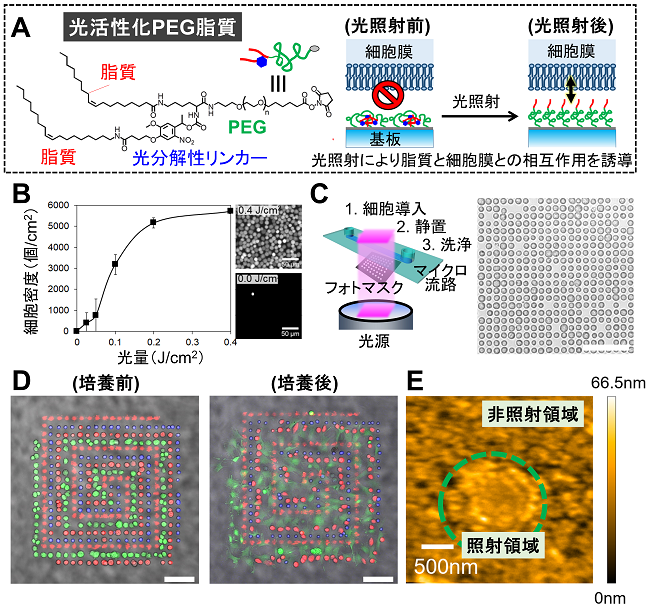
これまで我々は、光分解性のPEG脂質を合成して、光照射によって細胞が付着しなくなる表面を開発してきた27,28)。この光分解性PEG脂質表面を使って1細胞アレイを構築し、細胞の幾つかの表現型を網羅的に1細胞定量解析する応用研究を報告してきた29,30)。また、光異性化分子をPEGと脂質の連結部分に導入し、異なる二波長の光で細胞付着力を繰り返し変化させることができる表面の開発にも成功した31)。今回、光活性化型のPEG脂質の開発にあたり、脂質の本数に着目した。PEG末端に1本の脂質が連結した通常のPEG脂質を修飾した表面は、上記のとおり、強固に細胞を付着する。一方、PEG末端に2本の脂質を有するPEG脂質を修飾した表面には、細胞が付着しないことに着目した。そこで、2本の脂質のうち、片方だけを光分解性リンカーを介してPEG末端に結合し、光照射によって脂質が2本から1本になるPEG脂質を設計・合成した (図4A)8)。このPEG脂質を修飾した表面では、予想通りに光照射に応じた細胞の付着が確認された (図4B, 4C)。さらに、①光照射と②細胞の播種、③付着していない細胞の洗浄除去、のサイクルを繰り返すことで、細胞の接着性に関わらず複数種類の細胞を望みの精緻なパターンに光配置できた (図4D)。この表面では、光照射だけで細胞付着力が活性化されるため、上記の光反応性の表面と比較して圧倒的に速く複数種類の細胞のパターニングが可能であった。また、配置した細胞を培養すると、接着細胞は接着伸展し、同一パターン上で浮遊細胞との共培養も観察できた。これは従来の技術では実現が困難であり、接着伸展したがん細胞や神経細胞などと、免疫細胞との相互作用を望みの配置や距離で解析することを可能にする。

4-2 光活性化PEG脂質の分子メカニズム
上記のとおり、光活性化PEG脂質が開発できたが、脂質の本数に応じて細胞付着力が変わるメカニズムは不明であった。そこで、まず、PEG末端の2本の脂質のうち、片方の脂質の長さを変化させたところ、炭素が8個以下の脂質では細胞が付着し、12個以上の脂質では細胞の付着が抑制された。これより、脂質部分の疎水性の大きさが細胞付着力に関わることが示唆された8)。次に、PEG脂質の表面修飾密度を変えて同様の実験を行った。光照射前、低密度の場合では、脂質が2本であるにも関わらず細胞が付着した。また、この低密度条件では、光照射前後で細胞付着力に変化が無かった。従って、PEG脂質の表面密度が低いと、脂質を2本にすることによる抑制効果が解消されることが示された。これらの結果から、この抑制効果が基板表面での脂質間の疎水性相互作用に由来することが示唆された8)。そこで、原子間力顕微鏡 (AFM) を用いて、パターン光を照射した表面を観察したところ、非照射領域では球状の凹凸が観察されたが、光照射領域は表面が平坦で少し高さがあった (図4E)8)。これより、光照射前の2本鎖状態では、脂質の自己集合によってミセル様ナノ構造が形成されているが、照射後の1本鎖状態では自己集合が解消されて基板表面で脂質が分散していると考えられる。さらに、細胞の付着実験の結果を併せて考えると、脂質の疎水性や表面密度が一定の値を超えた場合、脂質の自己集合によって細胞膜との相互作用が抑制され、光分解によって脂質の疎水性が低減すると自発的に分散された脂質が細胞膜に付着すると考えられる。
4-3 細胞間相互作用の1細胞解析
上記のとおり、光活性化PEG脂質修飾表面上には、複数種類の細胞を1細胞レベルの正確さで迅速に光配置できる。そこで、異種細胞間の相互作用を網羅的に1細胞解析する技術へと応用した。本研究では、免疫細胞とがん細胞との相互作用に着目した。現在、薬剤や治療用細胞の点滴投与だけで治療できるがん免疫療法が、患者の身体への負担の少ないがん療法として注目されている。がん免疫療法では、免疫細胞ががん細胞と相互作用して細胞死を誘導し、治癒する。しかし、一回の治療に数十万円から数千万円かかるにも関わらず、奏効率 (がんが縮小する効率) が低いことが問題となっている。これまで、がん免疫療法のメカニズムや効果は、細胞集団全体の平均値によってのみ評価されてきた。そのため、免疫を回避する少数のがん細胞や、逆に、がん細胞傷害性の高い少数の免疫細胞についての情報を得るのが困難であった。そこで、1細胞ずつ免疫細胞とがん細胞との相互作用を解析する技術が求められている。
そのようなニーズに応えるために、マイクロ流路中の細孔32)や液滴33)に免疫細胞とがん細胞を1細胞ずつ閉じ込め、その相互作用を網羅的に1細胞解析する技術が報告されている。しかし、これらの方法では、細孔や液滴の中で解析するため、非接着性の細胞ペアにしか応用できない。また、狭い空間に押し込めて解析するため、細胞の形態変化などの情報と細胞傷害性との関係を調べることが不可能である。一方、我々の光活性化型の細胞付着表面を用いれば、細胞の接着性に関わらず、1細胞ずつ免疫細胞とがん細胞とを平面基板表面に隣接させて配置し、観察することが可能である。
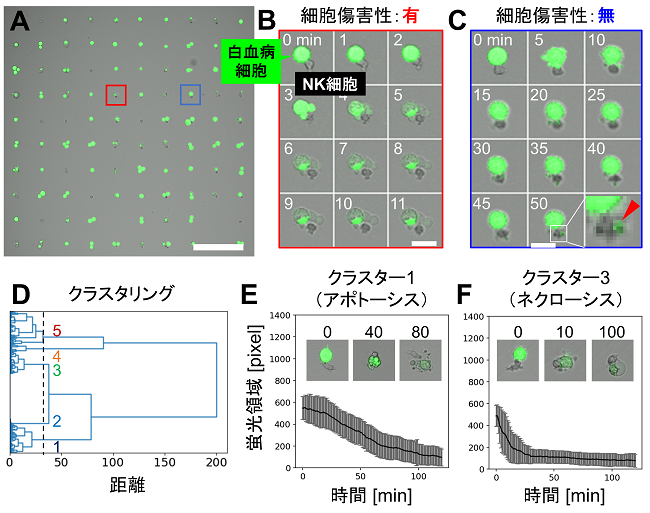
実際に、この光活性化PEG脂質修飾表面を用いて、免疫細胞とがん細胞の相互作用を1細胞解析した8)。免疫細胞としてヒトの血液から採取したナチュラルキラー (NK) 細胞を、がん細胞としてヒト白血病細胞株K562細胞を用いた。NK細胞を1細胞ずつ100µm間隔で配置した後、NK細胞に隣接する位置にカルセインで染色したK562細胞を固定化し、両者の相互作用を経時観察した (図5A)。その結果、NK細胞の一部がK562細胞を殺傷し、カルセイン蛍光が消失する様子が観察された (図5B)。一方で、K562細胞を殺傷しないNK細胞も観察され (図5C)、NK細胞の細胞傷害性の不均一性の観察に成功した。また、画像解析によって定量化したカルセイン蛍光の経時変化を機械学習によって分類したところ、K562細胞を殺傷するNK細胞の中には二種類の細胞集団が存在することが明らかとなった (図5D)。それぞれの細胞集団に対して、経時変化画像を個別に確認すると、殺傷されたK562細胞が、それぞれアポトーシス様とネクローシス様の細胞死に特徴的な形態変化を示していた (図5E, 5F)。NK細胞がK562細胞にアポトーシスとネクローシスの両方を誘導することは、細胞集団同士を混ぜて観察する従来の実験でも報告されており、細胞膜を損傷するパーフォリンとセリンプロテアーゼであるグランザイムなどから成る細胞傷害性顆粒の放出量の多寡によって、細胞死の誘導メカニズムが変わると考えられている34)。また、この誘導される細胞死メカニズムのバランスが、腫瘍微小環境における免疫原性の調節に重要であることも示唆されている。従って、本研究で開発した技術によって、がん細胞傷害性を定量的に1細胞解析することにより、病態の把握や新しいメカニズムの薬剤の探索、免疫療法のコンパニオン診断などに貢献できると期待される。

5.おわりに
生体外の培養皿の上で細胞を培養して行う細胞アッセイは、これまで、バイオメディカル研究と創薬スクリーニングの両方の分野で重要な役割を担ってきた。最近では、オルガノイドの調製技術が進歩し、細胞間相互作用の影響も含めた三次元組織としての生化学活性の評価が行われるようになってきている。このような技術の進歩に伴い、生体外で再現できる生命現象が少しずつ増えている。倫理上の問題から動物実験を代替するモデル実験の拡張が強く望まれる中、「よりリアル」に生体組織を模倣するモデルの開発が求められており、今回開発したような汎用性が高く、精緻に細胞を配置できる光応答性の細胞パターニング技術がますます重要になる。現在、我々はこの2次元の細胞パターニング技術を使って、3次元のオルガノイドを調製するための技術開発にも着手している。一方で、基礎研究や新しい創薬標的を探索するフェーズにおいては、複雑な生命現象の中の一場面だけを切り取って再現することも重要である。最後に紹介したがん細胞傷害性の1細胞解析系は、NK細胞ががん細胞と出会った後に相互作用する場面だけを切り取って解析している。その結果、細胞傷害性や細胞死誘導メカニズムの不均一性が示され、特的の表現型のNK細胞を定量することできた。また、細胞傷害性が無いNK細胞の中に、がん細胞の一部を「かじって食べる」現象 (トロゴサイトーシス)35)を示すレアな細胞が存在することもわかった (図5C)。このように、人工的な環境に細胞を置いて培養することで、これまでは気が付かなかったレアな細胞の機能を発見することもできる。そこで、このような分類・発見された表現型に応じて細胞を回収して、その表現型を担う鍵遺伝子の同定を網羅的に行うためのワークフローの開発を進めている。そのような遺伝子の中には、シグナル伝達や代謝に関わる責任酵素が含まれると考えられ、その阻害剤の開発や遺伝子編集を介して、新しい創薬や細胞治療の開発に貢献したい。このように、今回開発した細胞の光パターニング技術は、広範な研究分野への貢献が期待され、産学の幅広い研究機関と共同研究を実施していきたいと考えている。
謝辞
本研究の一部は、東京大学の長棟輝行名誉教授、および、聖路加国際大学の故平家勇司教授のご指導の下、実施されました。また、JSTさきがけ「統合一細胞」領域で同僚であった、産業技術総合研究所の舘野浩章グループ長、および、大阪大学の山下隼人助教に、レクチンの提供とAFM観察においてそれぞれご協力を賜りました。同領域の研究総括およびアドバイザーであった、京都大学の浜地格教授、および、松田道行教授、東京大学 (当時) の菅野純夫教授、また、JST未来社会創造事業「共通基盤」領域のテーママネージャーであった、株式会社島津製作所の佐藤孝明シニアフェローに、研究開発の方向性について特に重要なご助言を賜りました。
文献
1) Masters, J. R.: Nat. Rev. Cancer, 2, 315 (2002).
2) Yao, T., Asayama, Y.: Reprod. Med. Biol., 16, 99 (2017).
3) Aisenbrey, E. A., Murphy, W. L.: Nat. Rev. Mater., 5, 539 (2020).
4) Ramilowski, J. A., Goldberg, T., Harshbarger, J., Kloppman, E., Lizio, M., Satagopam, V. P., Itoh, M., Kawaji, H., Carninci, P., Rost, B., Forrest, A. R. R.: Nat. Commun., 6, 7866 (2015).
5) Fields, R. D., Burnstock, G.: Nat. Rev. Neurosci., 7, 423 (2006).
6) Havel, J. J., Chowell, D., Chan, T. A.: Nat. Rev. Cancer, 19, 133 (2019).
7) Kosaka, T., Yamaguchi, S., Izuta, S., Yamahira, S., Shibasaki, Y., Tateno, H., Okamoto, A.: J. Am. Chem. Soc., 144, 17980 (2022).
8) Yamahira, S., Misawa, R., Kosaka, T., Tan, M., Izuta, S., Yamashita, H., Heike, Y., Okamoto, A., Nagamune, T., Yamaguchi, S.: J. Am. Chem. Soc., 144, 13154 (2022).
9) Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E.: Science, 276, 1425 (1997).
10) Bessueille, F., Pla-Roca, M., Mills, C. A., Martinez, E., Samitier, J., Errachid, A.: Langmuir, 21, 12060 (2005).
11) Park, J. A., Yoon, S., Kwon, J., Now, H., Kim, Y. K., Kim, W. J., Yoo, J. Y., Jung, S.: Sci. Rep., 7, 14610 (2017).
12) Matsusaki, M., Sakaue, K., Kadowaki, K., Akashi, M.: Adv. Health. Mater., 2, 534 (2013).
13) Yamato, M., Konno, C., Utsumi, M., Kikuchi, A., Okano, T.: Biomaterials, 23, 561 (2002).
14) Yeo, W. S., Yousaf, M. N., Mrksich, M.: J. Am. Chem. Soc., 125, 14994 (2003).
15) Nakanishi, J., Kikuchi, Y., Takarada, T., Nakayama, H., Yamaguchi, K., Maeda, M.: J. Am. Chem. Soc., 126, 16314 (2004).
16) Petersen, S., Alonso, J. M., Specht, A., Duodu, P., Goeldner, M., del Campo, A.: Angew. Chem. Int. Ed., 47, 3192 (2008).
17) Ohmuro-Matsuyama, Y., Tatsu, Y.: Angew. Chem. Int. Ed., 47, 7527 (2008).
18) Lee, T. T., García, J. R., Paez, J. I., Singh, A., Phelps, E. A., Weis, S., Shafiq, Z., Shekaran, A., del Campo, A., Garc, A. J.: Nat. Mater., 14, 352 (2015).
19) Boekhoven, J., Rubert PØrez, C. M., Sur, S., Worthy, A., Stupp, S. I.: Angew. Chem. Int. Ed., 52, 12077 (2013).
20) Mosiewicz, K. A., Kolb1, L., van der Vlies, A. J., Martino, M. M., Lienemann, P. S., Hubbell, J. A., Ehrbar, M., Lutolf, M. P.: Nat. Mater., 12, 1072 (2013).
21) Kikuchi, K., Sumaru, K., Edahiro, J., Ooshima, Y., Sugiura, S., Takagi, T., Kanamori, T.: Biotechnol. Bioeng., 103, 552 (2009).
22) Poloukhtine, A. A., Mbua, N. E., Wolfert, M. A., Boons, G.-J., Popik, V. V.: J. Am. Chem. Soc., 131, 15769 (2009).
23) Du, H., Chandaroy, P., Hui, S. W.: Biochim. Biophys. Acta, Biomembr., 1326, 236 (1997).
24) Teramura, Y., Iwata, H.: Soft Matter, 6, 1081 (2010).
25) Kato, K., Umezawa, K., Funeriu, D. P., Miyake, M., Miyake, J., Nagamune, T.: BioTechniques, 35, 1014 (2003).
26) Tateno, H., Toyota, M., Saito, S., Onuma, Y., Ito, Y., Hiemori, K., Fukumura, M., Matsushima, A., Nakanishi, M., Ohnuma, K., Akutsu, H., Umezawa, A., Horimoto, K., Hirabayashi, J., Asashima, M.: J. Biol. Chem., 286, 20345 (2011).
27) Yamaguchi, S., Yamahira, S., Kikuchi, K., Sumaru, K., Kanamori, T., Nagamune, T.: Angew. Chem. Int. Ed., 51, 128 (2012).
28) Jarzębska, N. T., Yamaguchi, S., Izuta, S., Kosaka, T., Yamahira, S., Nagamune, T., Okamoto, A.: Biomater. Sci., 7, 4514 (2020).
29) Yamahira, S., Yamaguchi, S., Kawahara, M., Nagamune, T.: Macromol. Biosci., 14, 1670 (2014).
30) Tan, M., Yamaguchi, S., Yamahira, S., Nakamura, M., Nagamune, T.: Lab Chip, 17, 1933 (2017).
31) Izuta, S., Yamaguchi, S., Kosaka, T., Okamoto, A.: ACS Appl. Bio Mater., 2, 33 (2019).
32) Dura, B., Dougan, S. K., Barisa, M., Hoehl, M. M., Lo, C. T., Ploegh, H. L., Voldman, J.: Nat. Commun., 6, 5940 (2015).
33) Madrigal, J. L., Schoepp, N. G., Xu, L., Powell, C. S., Delley, C. L., Siltanen, C. A., Danao, J., Srinivasan, M., Cole, R. H., Abate, A. R.: Proc. Natl. Acad. Sci. USA, 119, e2110867119 (2022).
34) Backes, C. S., Friedmann, K. S., Mang, S., Knörck, A., Hoth, M., Kummerow, C.: J. Biol. Chem., 293, 16348 (2018).
35) Nakamura, K., Nakayama, M., Kawano, M., Amagai, R., Ishii, T., Harigae, H., Ogasawara, K.: Proc. Natl. Acad. Sci. USA, 110, 9421 (2013).