【トピックス】
酵母を用いたグリチルリチンの生産とメタボロン形成の可能性
Soo Yeon CHUNG、關 光、村中俊哉
阪大院・工
1.はじめに
近年、地球温暖化や食糧問題などの社会課題への危機意識が高まる中、バイオテクノロジーを基盤としたものづくりは国連の持続可能な開発目標 (SDGs) への取り組みに大いに貢献すると期待されている。植物や微生物などの生物を用いたバイオ合成プロセスは、従来の化学合成における高温・高圧プロセスを必要としないことから省エネルギーであり、原料を化石資源から再生可能なバイオマスに代替することで、脱炭素社会の実現も可能である1)。その中でも、合成生物学的手法を用いて酵母などの微生物から植物由来有用物質を合成する新しい生産技術は、天然資源の枯渇を防止し、持続可能な生産と消費を可能にすることから注目を浴びている。
筆者らは生薬「甘草」の主有効成分であるグリチルリチンの持続可能な生産システムの確立を目的に、グリチルリチン生合成機構の解明に向けた研究に励んできた。生薬甘草は、マメ科の多年草であるカンゾウ (Glycyrrhiza spp. ) の肥大した根と地下茎を乾燥させたものであり、漢方で最も多く処方される生薬である。甘草から抽出されるグリチルリチンは、抗炎症作用や肝機能補強作用などの薬理作用を持つことから医薬品や機能性化粧品として多用される2)。また、グリチルリチンは砂糖の約150倍以上の甘さを持つことから甘味料として味噌や佃煮、菓子類などの加工食品に添加される。しかし、国内で消費されている甘草とその抽出物のほぼ全てが中国からの輸入に依存しており、中国内の環境保全を目的とした採取規制や輸出制限に伴い輸入価格が上昇しつつある。こうした中、国内安定供給に向けてカンゾウの国内栽培や植物工場での試験栽培などが進められているが、どれも生産コストが見合わず産業化にまで至っていない。特にカンゾウの場合、栽培期間が長く (通常3年)、分布域が限られており、生育環境によってグリチルリチン含有量が大幅に変動するため、たとえ国内栽培が確立されたとしても栽培可能な地域は限定的であり、気象変動などのリスクは抱えたままになる。そこで、筆者らは植物からの抽出に依存しない生産系として酵母を用いたグリチルリチンの生産を提案し、グリチルリチン生合成経路の解明に励んできた。本稿では、筆者らがこれまで進めてきたグリチルリチン生合成酵素遺伝子の同定と、新規糖転移酵素CSyGTの発見によって示唆された酵素複合体 (メタボロン) 形成に関する最新の研究成果と今後の展望について解説する。
2.グリチルリチン生合成経路の解明
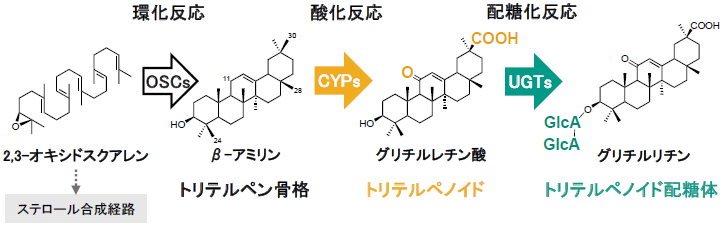
グリチルリチンはトリテルペノイド配糖体 (以下、サポニンとする) に分類され、植物が合成するサポニンにはオタネニンジン (朝鮮人参) のジンセノサイド類やミシマサイコのサイコサポニン類といった重要な漢方原料の主有効成分などが挙げられる。また、ダイズに含まれるソヤサポニン類はカンゾウを含むマメ科植物に広く分布することが報告されている3)。植物におけるこれらサポニンの生合成経路は大きく環化反応、酸化反応、配糖化反応の3ステップに分けることができる (図1)。各ステップを触媒する酵素群の多様性によって、生成されるサポニンの構造もまた多様化する。

最初のステップは、オキシドスクアレン環化酵素 (OSC) による炭素数30の鎖状化合物2,3-オキシドスクアレンの環化反応である。一般に、動物や菌類においてはラノステロール合成酵素と呼ばれる一種のOSCのみが報告されており、環化産物であるラノステロールはコレステロールやエルゴステロールなどの膜の構成成分に変換される。一方、高等植物には植物ステロール合成経路に関与するシクロアルテノール合成酵素の他にも多様なOSCが存在する。これらOSCによる環化反応によって生成されるトリテルペン骨格はおよそ100種以上であると報告されている4)。サポニンはこの基本骨格によって分類され、グリチルリチンなどβ-アミリンから派生するサポニンをオレアナン型サポニンと呼ぶ。
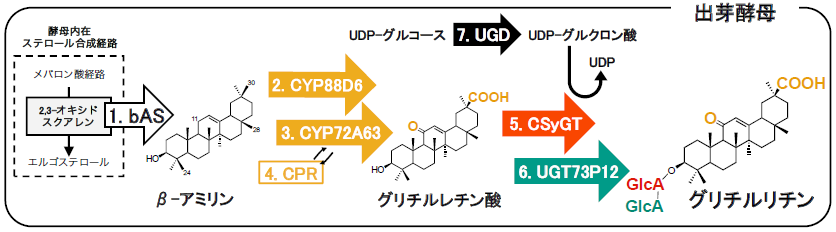
次に、シトクロムP450モノオキシゲナーゼ (CYP) による部位特異的な酸化反応によってサポニンの非糖部 (アグリコン) であるトリテルペノイドが生成する。筆者らは、これまでグリチルリチンを含む各種サポニンの生合成経路に関与する複数のCYPを同定した。グリチルリチンのアグリコンであるグリチルレチン酸は、CYP88D6によるβ-アミリンの11位炭素の酸化5)と、CYP72A154による30位炭素の酸化6)によって生成される。また、カンゾウが合成するソヤサポニン類の一つであるソヤサポニンBbのアグリコン、ソヤサポゲノールBはCYP93E3とCYP72A566によって生成される7)。カンゾウと同じマメ科のモデル植物であるタルウマゴヤシ (Medicago truncatula ) からは、β-アミリンの28位炭素の酸化を触媒し、オレアノール酸を生成するCYP716A128)と、上述のカンゾウ由来CYP72A154よりも反応位置選択性 (30位炭素の酸化) にすぐれたCYP72A636)を同定した。筆者らはさらに、β-アミリン合成酵素 (bAS) と同定した上記各種CYPとCYPの酸化反応に必要であるシトクロムP450還元酵素 (CPR) を出芽酵母に導入することで、3種のトリテルペノイド (グリチルレチン酸、ソヤサポゲノールB、オレアノール酸) をそれぞれ合成する酵母の作出に成功した。
最後に、トリテルペノイドからUDP依存型糖転移酵素 (UGT) による配糖化反応を経てサポニンが合成される。UGTは、トリテルペノイドに限らず植物特化代謝産物全般の配糖化反応に関与することが知られており、転移する糖の種類や数、位置によって化合物の極性や安定性など、化学的特性が変化する。植物は、基質となる受容体分子と糖供与体のそれぞれの選択性が異なる種々のUGT遺伝子を保持しており、その数はおよそ1ゲノムあたり100~300種程度であると推定されている9)。2005年にタルウマゴヤシからサポニン生合成経路に関与する2種のUGTが報告10)されて以来、多数のUGTが同定され、ダイズにおいてはソヤサポニン生合成に関わるUGTのほぼ全てが同定された。筆者らもまた、グリチルリチン生合成経路に関与するUGTの探索にあたってウラルカンゾウ (Glycyrrhiza uralensis) のトランスクリプトーム解析を実施した。
グリチルリチンは3位水酸基に2分子のグルクロン酸 (グルコースの6位炭素が酸化された糖の一種) からなる糖鎖が結合した構造をもつ。したがって、グリチルリチンの合成には2種の糖転移酵素が関与すると推測した。トランスクリプトームとは特定の状況下において細胞内に存在するすべての遺伝子転写産物 (mRNA) を意味し、トランスクリプトーム解析によって遺伝子の配列および発現量を把握することができる。筆者らは、ウラルカンゾウのトランスクリプトから見出した90種のUGTから、β-アミリン合成酵素やCYP88D6、CYP72A154など、既知のグリチルリチン生合成遺伝子と発現パターンが類似するUGT遺伝子を選抜し、酵素機能を解析した。その結果、1糖目のグルクロン酸に2糖目のグルクロン酸を転移するUGT73P12の同定に成功した11)。UGT73P12はUDP-グルクロン酸に対して高い糖供与体選択性を示し、また、糖が付いていないグリチルレチン酸をアクセプター分子とした時には活性を示さなかった。ウラルカンゾウの系統にはグリチルリチンの代わりに2糖目のグルクロン酸がグルコースになっている「グルコグリチルリチン」を産生する83-555系統が存在する。83-555系統から単離したUGT73P12遺伝子の配列を分析した結果、506個のうち8個のアミノ酸が異なっており、糖選択性においてはグルクロン酸転移活性をほぼ完全に失い、高いグルコース選択性を持つことを確認した。一方、残りのUGT候補に関しても30種近く酵素機能解析を実施したが、いずれもグリチルレチン酸に対しグルクロン酸転移活性を示さなかった。
3.新規糖転移酵素CSyGTの発見
同一の代謝経路に属する遺伝子群は、同じ転写制御機構のもとで同調的に発現している可能性が高いことから、CYPやUGTなど大きな遺伝子ファミリーの中から特定の生合成経路に関与する酵素を同定するには「遺伝子共発現解析」による機能予測が極めて有効である。しかし、既知のグリチルリチン生合成遺伝子 (bAS、CYP88D6、CYP72A154) と同調的に発現するカンゾウUGTの中で、1糖目のグルクロン酸転移活性を示すものは見つからなかった。そこで筆者らは、ソヤサポニン類の3位の水酸基に結合する糖鎖の組成がサポニンの種類によって多様化しているにもかかわらず、第1糖のみが共通してグルクロン酸であることに着目した。ソヤサポニンを産生する3種のマメ科植物 (カンゾウ、ダイズ、ミヤコグサ) それぞれにおいて既知のサポニン生合成遺伝子と共発現する遺伝子を、UGTだけに絞らず網羅的に探索した。その結果、セルロース合成酵素類似群 (Cellulose synthase-like、Csl) に属する酵素が、各植物種において既知のサポニン生合成遺伝子と共発現していることを発見した。
糖転移酵素は、その機能とアミノ酸配列の相同性に基づいて100種以上のファミリーに分類される。UGTはGT1ファミリーに分類され、糖供与体としてUDP-糖を用いることや、植物UGTに関してはPSPG (Plantsecondary product glycosyltransferases) ボックスと呼ばれる高度に保存されたアミノ酸配列領域がC末端付近に存在することが特徴的である12)。一方、CslはUGTとはそのアミノ酸配列も、予測される機能も全く異なるGT2ファミリーに属する。GT2ファミリーはセルロース合成酵素群 (CesA) と10種のCslファミリーで構成され、GT2ファミリー酵素の機能はセルロースやヘミセルロースなど植物細胞壁を構成する多糖類の生合成に関与すると推測されている13)。しかしながら、Cslの詳細な機能は解明されていない。そこで筆者らはCslもまた糖転移酵素の一種であることから、サポニン生合成酵素としての機能をもつかを解析することにした。
Cslは、リコンビナントタンパク質の調製が難しい膜貫通型タンパク質であるため、in vitro 酵素活性試験の代わりに上述した3種のトリテルペノイド (グリチルレチン酸、ソヤサポゲノールB、オレアノール酸) 生産酵母を用いたin vivo 実験を実施した。その際に、糖供与体となるUDP-グルクロン酸を酵母に内在するUDP-グルコースから合成するため、シロイヌナズナ由来UDP-グルコースデヒドロゲナーゼ (UGD)14)も同時に導入した。作出した酵母の培養代謝産物をLC-MSを用いて分析した結果、3種全てのトリテルペノイドに対して3位の水酸基にグルクロン酸が結合した化合物が検出された。また、UGDとCslのみを導入した酵母株の培養液に各種トリテルペノイドを基質として添加し培養した結果、Cslがβ-アミリンから派生するオレアナン型トリテルペノイドに特異的なグルクロン酸糖転移酵素であることが判明した。
グルクロン酸転移活性が認められた酵素はいずれもCslMファミリーに属しており、ダイズにおいては同定した酵素の他に4種のCslMファミリー酵素が存在する。これらについても同様の酵素活性試験を行った結果、アミノ酸配列の相同性が高かった2種にはグルクロン酸転移活性が確認されたが、残りの2種に関しては確認できなかった。筆者らはこれらの結果を踏まえて、グルクロン酸転移活性が見られたCsl酵素は既存のCslMファミリーから機能的に分化した新規糖転移酵素であると考え、CSyGT (Cellulose synthase derived glycosyltransferase) と名付けた15)。さらに、ミヤコグサCSyGTノックアウト体に、蛍光タンパク質と融合させたCSyGTを導入した結果、CSyGTが小胞体膜に局在することが観察できた。また、ノックアウト体において失われたソヤサポニン生合成能がCSyGTの導入によって再び回復したことから、CSyGTは植物内において小胞体膜に局在するソヤサポニン生合成酵素であることが証明された。
最後に、酵母にグリチルリチン生合成経路を再構築し、グリチルリチンの生産を試みた (図2)。出芽酵母に全7種の遺伝子 (bAS、CYP88D6、CYP72A63、CPR、CSyGT、UGD、UGT73P12) を導入し、得られた組換え酵母株を5日間培養した結果、微量ではあるが約530μg/Lのグリチルリチン生産に成功した。作出した酵母株は、内在するエルゴステロール生合成経路の中間代謝産物である2,3-オキシドスクアレンからグリチルリチンを合成するため、別途の基質の投与が不要なde novo 生産が可能な株である。

4.サポニン生合成経路におけるメタボロン形成の可能性
新規糖転移酵素CSyGTの発見によって全てのグリチルリチン生合成酵素の同定が完了し、酵母を用いた代替生産が可能になった。CSyGTの発見は、これまでUGTがサポニンを含む植物特化代謝産物の糖転移反応を触媒するという定説を覆し、一次代謝経路に属するセルロース合成酵素の一部が進化を遂げて二次代謝経路であるサポニン生合成に関与することを初めて見出した。しかし、未だなぜサポニンの糖鎖を構成する複数の糖のうち、3位の水酸基に直接結合するグルクロン酸のみがCSyGTによって特異的に転移されるかについて解明できていない。
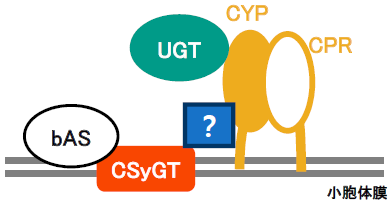
一方、筆者らはカンゾウUGTの酵素活性を調べる過程で、グリチルレチン酸の3位にグルコースを転移するUGT73F13を発見し、カンゾウには3位の水酸基に糖を直接転移するUGT73F13と、2糖目であるもののUDP-グルクロン酸に対して高い糖供与体選択性を示すUGT73P12が存在することを突き止めた。つまり、第1段階目のグルクロン酸転移活性はUGT酵素群において触媒機構的に取得が不可能な領域にあるのではなく、生合成機能とは直接的に関係しない何らかの理由によってCSyGTがUGTの代わりにサポニン生合成酵素として進化したのではないかと考えられる。そこで筆者らは、CSyGTがCYPのように小胞体膜に局在することに着目し、CSyGTとCYPが酵素複合体 (メタボロン) を形成しているのではないかと考えた。
メタボロンは、代謝経路を構成する酵素群がタンパク質間相互作用によって集積化した複合体である。メタボロンの形成によって細胞内の代謝経路が区画化され、不安定または毒性のある中間代謝物が拡散することなく次の代謝反応に直接受け渡されるチャネリング効果が生じ、代謝経路の円滑化が可能になる。また、メタボロンの形成は可逆的であることから、メタボロンを介した代謝経路の制御が可能である。現在、植物の特化代謝経路 (二次代謝経路) においてメタボロンの存在が直接的に示唆されているのは、シアン (青酸) 配糖体とフラボノイドの生合成経路である。ソルガム (Sorghum bicolor) はdhurrinと呼ばれるシアン配糖体を生合成するが、その生合成酵素であるCYP79A1、CYP71E1とUGT85B1が、CYPの還元パートナーであるPORを中心に複合体を形成し、チャネリング効果によって不安定な中間代謝物が拡散せず配糖体として蓄積すると報告されている16)。一方、フラボノイド生合成においては、シロイヌナズナ、ダイズ、キンギョソウなど数種類の植物においてメタボロンの形成が報告されている。いずれの報告事例においても複合体はCYPを中心に小胞体膜上に形成されており、CYPは触媒的役割だけではなく、メタボロン形成のためのハブとして構造的役割を担うとされている17)。植物CYPは、一般に膜貫通ドメインをN末端に保持しており、触媒ドメインは細胞質側に突き出た状態で小胞体膜に局在する18)。したがって、筆者らはCSyGTが小胞体膜に局在する膜貫通型タンパク質として、CYPと同様にサポニン生合成メタボロンの形成に必要なハブとしての構造的機能があるのではないかと推測した。
タンパク質間相互作用解析には、共免疫沈澱、プルダウンアッセイ、 二分子蛍光補完法 (BiFC)、架橋タンパク質相互作用解析法など、いくつかの実験方法があるが、筆者らはSplit-ubiquitin (SU) 法を用いたYeasttwo-hybridを活用した。SU法は、二つに分断されたユビキチンをそれぞれ解析したいタンパク質に融合させ、相互作用によってユビキチンが再構築されると、酵母に内在する脱ユビキチン化酵素によって切断され、ユビキチンに接合していた人工転写因子が核に移行し各種レポーター遺伝子を活性化する原理である。CSyGTと各種生合成酵素 (bAS、CYPs、UGTs) との相互作用を解析した結果、実験当初期待していたCSyGTと各種CYPとの相互作用はみられず、CSyGTとbASとの間のみ相互作用が観察された。これは、今までCYPを中心に報告されていたメタボロンの構成とは異なり、サポニン生合成経路においてメタボロンの形成を示唆する初めてのタンパク質間相互作用解析結果である。現在、筆者らはCSyGTを中心としたタンパク質間相互作用解析を継続しており、生合成酵素としては機能しない“仲介役”タンパク質を介した相互作用まで視野に入れて研究に励んでいる (図3)。実際、植物の二次細胞壁の構成要素であるリグニンの生合成において、2種類の膜ステロイド結合タンパク質 (MSBP1、MSBP2) が足場タンパク質として3種のCYP (CYP73A5、CYP98A3、CYP84A1) と相互作用し、メタボロンを形成する実験結果が報告されているため、“仲介役”タンパク質の存在は十分可能性がある19)。

5.おわりに
本稿では、組換え酵母を用いたグリチルリチン生産を中心に新規糖転移酵素CSyGTの発見とメタボロン形成の可能性について紹介した。CSyGTは、細胞質タンパク質である植物UGTとは対照的に小胞体膜に局在する膜貫通型タンパク質であることから、同じく小胞体膜に結合しているCYPとメタボロンを形成すると考えられた。しかし、SU法を用いた実験結果によると、CSyGTはサポニン生合成酵素の中でbASのみと相互作用することが明らかになった。bASはステロール合成経路とサポニン合成経路との分岐点にある重要な酵素である一方、CSyGTやUGTによる糖転移反応は、疎水性であるトリテルペノイドに親水性の糖を付与することで化合物を水に溶けやすくし、より安定化させることができる。したがって、bASとCSyGTとの相互作用は中間代謝産物であるトリテルペノイドが細胞内に拡散せず、確実に配糖化されるために必要な制御機構の一つとも考えられる。とはいえ、今回の相互作用解析はまだ初期段階であり、BiFCなど他の実験手法を用いた検証が必要である。
組換え酵母を用いたアルテミシニック酸 (抗マラリア薬原料アルテミシニンの前駆物質) の生産20)を筆頭に、微生物を活用した植物有用物質生産の事業化に向けた研究が活発に行われている。しかしながら、グリチルリチン生産系を含むバイオによるものづくりの社会実装において高い生産コストがボトルネックとなっており、生産性向上に向けた更なる合成生物手法の革新が求められている。そんな中、メタボロン形成機構の解明は、生合成経路の高次元的な「システム化」に応用可能であり、代謝経路のより精密な制御及び劇的な効率化が期待される。
謝辞
本稿で紹介した研究の一部は、科研費補助金 (JP19H02921、JP20J10530、21K19082)の助成を受けておこないました。また、本研究は、農業・食品産業技術総合研究機構 (次世代作物開発研究センターと生物機能利用研究部門) ・石本政男研究領域長、理化学研究所環境資源科学研究センター・斉藤和季センター長 (千葉大学植物分子科学研究センター センター長兼任) ら、多くの研究者と共同でなされたものであり、ここに感謝申し上げます。最後に、Split-ubiquitin法Y2Hシステムをご提供いただきました東北大学の中山亨教授と和氣駿之助教に深く感謝申し上げます。
文献
1) de Lorenzo, V., Prather, K. L., Chen, G.-Q., O’Day, E., von Kameke, C., Oyarzún, D. A., Hosta-Rigau, L., Alsafar, H., Cao, C., Ji, W., Okano, H., Roberts, R. J., Ronaghi, M., Yeung, K., Zhang, F., Lee, S. Y.: EMBO rep, 19, e45658 (2018).
2) Hayashi, H., Sudo, H.: Plant Biotechnol., 26, 101 (2009).
3) Hayashi, H., Sakai, T., Fukui, H., Tabata, M.: Phytochem., 29, 3127 (1990).
4) Sawai, S., Saito, K.: Front. Plant Sci., 2, 25 (2011).
5) Seki, H., Ohyama, K., Sawai, S., Mizutani, M., Ohnishi, T., Sudo, H., Akashi, T., Aoki, T., Saito, K., Muranaka, T.: Proc. Natl. Acad. Sci. USA, 105, 14204 (2008).
6) Seki, H., Sawai, S., Ohyama, K., Mizutani, M., Ohnishi, T., Sudo, H., Fukushima, E. O., Akashi, T., Aoki, T., Saito, K., Muranaka, T.: Plant Cell, 23, 4112 (2011).
7) Tamura, K., Yoshida, K., Hiraoka, Y., Sakaguchi, D., Chikugo, A., Mochida, K., Kojoma, M., Mitsuda, N., Saito, K., Muranaka, T., Seki, H.: Plant Cell Physiol., 59, 783 (2018).
8) Fukushima, E. O., Seki, H., Ohyama, K., Ono, E., Umemoto, N., Mizutani, M., Saito, K., Muranaka, T.: Plant Cell Physiol., 52, 2050 (2011).
9) Yonekura-Sakakibara, K., Hanada, K.: Plant J., 66, 182 (2011).
10) Achnine, L., Huhman, D. V., Farag, M. A., Sumner, L. W., Blount, J. W., Dixon, R. A.: Plant J., 41, 875 (2005).
11) Nomura, Y., Seki, H., Suzuki, T., Ohyama, K., Mizutani, M., Kaku, T., Tamura, K., Ono, E., Horikawa, M., Sudo, H., Hayashi, H., Saito, K., Muranaka, T.: Plant J., 99, 1127 (2019).
12) Coutinho, P. M., Deleury, E., Davies, G. J., Hnrissat, B.: J. Mol. Biol., 328, 307 (2003).
13) Little, A., Schwerdt, J. G., Shirley, N. J., Khor, S. F., Neumann, K., O’Donovan, L. A., Lahnstein, J., Collins, H. M., Henderson, M., Fincher, G. B., Burton, R. A.: Plant Physiol., 177, 1124 (2018).
14) Klinghammer, M., Tenhaken, R.: J. Exp. Bot., 58, 3609 (2007).
15) Chung, S. Y., Seki, H., Fujisawa, Y., Shimoda, Y., Hiraga, S., Nomura, Y., Saito, K., Ishimoto, M., Muranaka, T.: Nat. Commun., 11, 5664 (2020).
16) Laursen, T., Borch, J., Knudsen, C., Bavishi, K., Torta, F., Martens, H. J., Silvestro, D., Hatzakis, N. S., Wenk, M. R., Dafforn, T. R., Olsen, C. E., Motawia, M. S., Hamberger, B., Møller, B. L., Bassard, J. E.: Science, 354, 890 (2016).
17) 中山 亨、和氣駿之、高橋征司: 植物の成長調節, 56, 14 (2021).
18) 中山 亨、兪 東燦、 高橋征司: 生物工学, 90, 576 (2012).
19) Gou, M., Ran, X., Martin, D. W., Liu, C. J.: Nat. Plants, 4, 299 (2018).
20) Paddon, C. J., Westfall, P. J., Pitera, D. J., Benjamin, K., Fisher, K., McPhee, D., Leavell, M. D., Tai, A., Main, A., Eng, D., Polichuk, D. R., Teoh, K. H., Reed, D. W., Treynor, T., Lenihan, J., Jiang, H., Fleck, M., Bajad, S., Dang, G., Dengrove, D., Diola, D., Dorin, G., Ellens, K. W., Fickes, S., Galazzo, J., Gaucher, S. P., Geistlinger, T., Henry, R., Hepp, M., Horning, T., Iqbal, T., Kizer, L., Lieu, B., Melis, D., Moss, N., Regentin, R., Secrest, S., Tsuruta, H., Vazquez, R., Westblade, L. F., Xu, L., Yu, M., Zhang, Y., Zhao, L., Lievense, J., Covello, P. S., Keasling, J. D., Reiling, K. K., Renninger, N. S., Newman, J. D.: Nature, 496, 528 (2013).