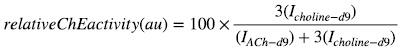【トピックス】
質量分析イメージングの基礎と応用
新間秀一
阪大院・工/大阪大学先導的学際研究機構/阪大島津分析イノベーション協働研究所
1.はじめに
質量分析イメージング (MSI: mass spectrometry imaging) を用いた生体有機分子の可視化は、1990年代にマトリックス支援レーザー脱離イオン化法 (MALDI:matrix-assisted laser desorption ionization) を用いてR. M. CaprioliやB. Spenglerらにより初めて行われた1-3)。2002年に質量分析法を用いたタンパク質のイオン化でノーベル化学賞が受賞されたことから、多くの研究者がMALDIを用いてタンパク質のMSIに挑んだが、現在では生体内小分子 (代謝物や脂質) や薬物などのMSIが主たる研究分野となっている。本稿では、まずMSIの基礎について解説し、続いて食品への応用として「米麹における代謝物可視化」を取り上げる。次に、もう一つの応用例として、近年筆者が取り組んでいる新しい酵素活性可視化手法について説明する。
2.質量分析イメージングの基礎
MSIのコンセプトは試料表面での直接質量分析である。試料表面に存在する分子をMALDIでイオン化し質量分析部で検出することにより、強度分布をマッピングできる。MSIのワークフローを図1に示す。試料は、動物、植物および食品でも対応が可能である。ただし、すでに述べた通り、MSIは試料表面で質量分析を行うため、試料採取が必要となる。例えば、ヒト試料を対象とする場合には、手術検体や生検により採取され、動物試料であればマウスなどのげっ歯類から臓器や腫瘍組織を採取する。採取された試料は、一般にドライアイスや液体窒素を用いて凍結されるが、分子の拡散や流出を防ぐため通常化学固定などは行わず、試料採取後、迅速に凍結を行う。凍結された試料は、クライオミクロトームを用いて厚さ5-20µm (試料の性状によるパラメータとなる) で凍結切片を作製した後、導電性を有する透明なガラスプレートに載せられる。ここで用いるガラスプレートとして、通常インジウムスズ酸化物でコーティングされたITOガラスを使用する。その後、イオン化補助剤である「マトリックス」を試料表面に供給し、MALDIを用いて分析を行う。分析では、組織表面にデータ取得点を設定し、その位置情報とともに各点でマススペクトルを取得する。なお、マススペクトルとは横軸が質量をイオンの価数で除したm/z、縦軸がイオン強度で表されたグラフデータである。

全てのデータ点でマススペクトルを取得した後、得られたマススペクトルからイメージング対象となる成分のm/zに相当するピークを選択する。選択したピーク強度分布を専用のソフトウェアでマッピングすることにより、MSIのイメージングデータとなる。また、近年では得られた複数のイメージングデータを演算することで、別の物理量に変換することも可能になっている。この一連の流れから、MSIの特徴は試料表面でイオン化し検出された全てのピークについて分布を描くことが可能である。すなわち、可視化のためのプローブを特段利用することなく様々な分子の分布情報が得られる。一方、質量分析法ではMS/MSやMS/MS/MSと呼ばれる分子の構造情報を得るためのタンデム質量分析法と呼ばれる測定法がある。タンデム質量分析を直接組織上で行うことも可能であり、このようなデータを取得することで、測定対象は限られるが非常に特異性の高いイメージングデータを取得できる。
3.米麴におけるMSIの応用4)
日本酒造りにおいて米麴は重要な要素の一つである。酒造りにおける米麴の役割は、主にデンプンとタンパク質の分解酵素の供給と考えられている。また、出来上がった米麴の成分は酒質 (味や香り) に大きな影響を与えることも知られている。しかし、その品質の良し悪しの判断はこれまで杜氏の経験によるところが多く、科学的な知見が十分に得られている状況にはなく、開拓の余地が残された領域であると言える。杜氏が米麴の品質を判断する際には、外観や触感という物理的な構造を指標の一つとしている。かつては、走査型電子顕微鏡を用いた米麴の内部構造に関する研究が行われていたが、近年まで米麴の構造と成分の関連性を評価する研究はほとんど進められてこなかった。ここでは、醗酵食品の一つである米麴にMSIを適用し、醗酵過程で産生される代謝物の分布変化の可視化を試みた。
本実験では、精米歩合70%の山田錦の蒸米と米麴を用いた。これらの試料は非常にもろいことから、クライオミクロトームで切片を作製し、得られた切片を粘着性クライオフィルムにて回収した。切片作製において、それぞれの米粒は4%カルボキシメチルセルロースを用いて包埋後、−80℃で凍結させた。切片の厚みは20μmとし、得られたフィルムは松浪ガラス製ITOコートガラス (MASコート無し、表面抵抗100 Ω/m2) に3Mより購入した導電性両面テープを用いて固定した (図2A)。


切片作成後のマトリックス供給についてN-(1-naphthyl) ethylenediamine dihydrochlorideを用い、50%メタノールで7 mg/mLの濃度で調製した溶液を噴霧した。
米麴の主な役割は、醸造段階で酵母の栄養素を生成するための様々な酵素を供給することである。主に観察される酵素は、酵母成長のための栄養素としてグルコースを生成するα-アミラーゼまたはグルコアミラーゼである。さらに、α-アミラーゼは米麴の菌糸侵入 (ハゼ込み) に影響を与える最も重要な酵素である可能性が報告されている。これまでの研究では製麴後のグルコースの増加は報告されているが、本実験では様々な糖および糖アルコールが増加する様子が見られた (図2B)。また、その局在も米麴外周に局在するものと中央部に局在するものなど様々に観察されており、ハゼ込みとの関係も報告している。
4.MSIを用いた酵素活性可視化法の開発5,6)
組織内での酵素分布を知る方法として、免疫組織化学 (immunohistochemistry: IHC) が一般的に用いられている。IHCでは、酵素の存在は可視化できるがその活性を知ることはできない。IHCでは得られない酵素活性分布を可視化する手法として、酵素組織化学が古くから知られている7,8)。酵素組織化学では、試料表面へ基質を供給し、内在性の酵素反応により産生された物質に対し、呈色反応を行うことで可視化する。既存の酵素組織化学では、この呈色反応のステップに汎用性があるとは言い難い。すなわち、呈色反応のステップを都度、設計する必要があることから、酵素組織化学自体の汎用性が低いと言える。ここでは、これらの課題を解決するために酵素反応で産生された分子をMSIで可視化する方法を検討し、マウス脳ならびにマウス脊髄に適用した。
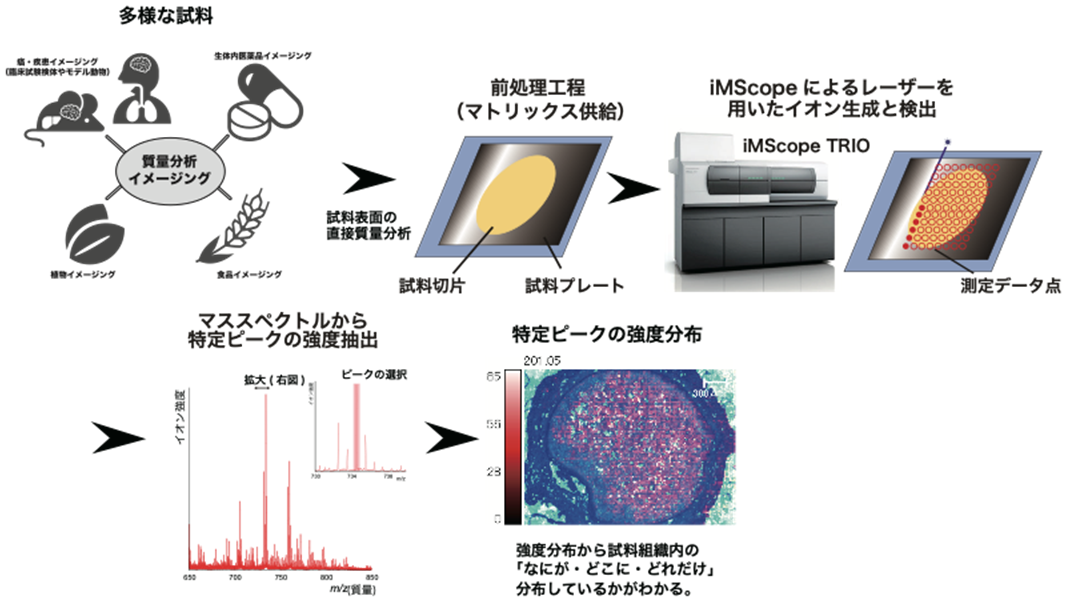
以下では野生型マウス脳と脊髄を用いて,アセチルコリンエステラーゼ (acetylcholine esterase: AChE) ならびにコリンアセチルトランスフェラーゼcholine acetyltransferase:ChAT) の活性分布の可視化を試みた.AChEは,アセチルコリンを基質としコリンと酢酸に分解する酵素であり、ChATはその逆反応としてアセチルCoAとコリンからアセチルコリンを合成する.したがって、AChEの活性を検出する場合にはアセチルコリンを試料表面に供給し、分解産物であるコリンを検出すればいい。ただし、内在性のコリンと区別しなければならないため、基質として重水素ラベル化されたアセチルコリン-d9を用い、コリン-d9を検出することにした (図3A)。ChATの場合は、その逆反応であるためコリン-d9とアセチルCoAを供給しアセチルコリン-d9を検出した。ここで、ChAT活性のイメージングに際し、合成されたアセチルコリン-d9は速やかにAChEにより分解されるため、基質供給の前にコリンエステラーゼ阻害剤であるフィソスチグミンを供給した。なお基質を含め全ての試薬の供給はマニュアルスプレーで行った。マトリックスは、α-シアノ-4-ヒドロキシケイ皮酸 ( α-CHCA,シグマアルドリッチ) を用い、その供給にはiMLayer (島津製作所) による蒸着とα-CHCAのスプレー噴霧を組み合わせた9)。
得られたコリン-d9の分布結果とアセチルコリン-d9の分布結果から、以下の式を用いて画像演算を行い最終的な相対酵素活性分布を作成した。なお、ここでIcholine-d9の前に置かれた係数はアセチルコリンとコリンのイオン化効率の比を表し、アセチルコリンはコリンよりも3倍イオン化効率が高かったことから導入した。
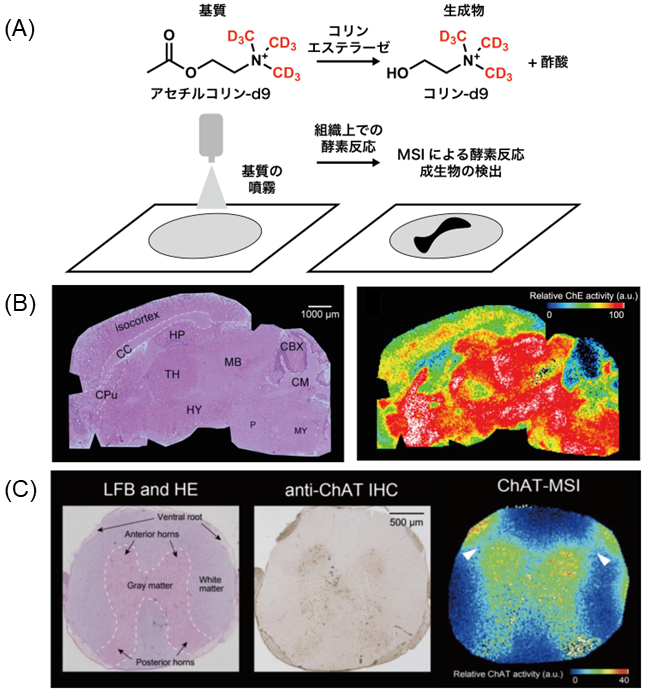

図3Bに示す通り、AChE活性は線条体 (CPu)、海馬 (HP) ならびに視床下部 (TH) で高くなり、脳梁 (CC) 並びに小脳皮質 (CBX) では低い傾向を示すことがわかった。この結果を、既存の酵素組織化学の結果と比べたところ、非常に良い一致が得られたため本手法の原理実証をすることができた。
一方、ChAT活性イメージングの場合、得られたコリン-d9とアセチルコリン-d9の分布結果は同様に演算されるが、その式は上式中の分子をIACh-d9に変えたものになる。図3Cにマウス脊髄でのChAT活性イメージング結果をルクソールファーストブルー (LFB) とChATの免疫染色 (IHC) 結果とともに示した。なお、LFBは脳または脊髄中の神経構造を可視化するためによく使われる染色法である。LFBの結果より脊髄組織で典型的に見られるバタフライ型の灰白質とその周辺を取り囲む白質が見られた。免疫染色結果では、バタフライ型の灰白質内部に茶褐色に染まった陽性部位を認め、組織外周の神経節 (ventral root: 前根) で特に強く染色された。一方、ChAT活性イメージング結果ではその前根と中央部の灰白質で活性が高いことがわかる。ここで興味深いことにIHC結果とChAT活性分布を比べると、前根とanterior hornと呼ばれる前角部がIHCでは繋がっておらず、ChAT活性分布では繋がっていることがわかる (図3C中矢頭)。この理由として、ChATには膜貫通型ChATと可溶型ChATの存在が原因であると考えている。一般的なIHCでは、染色工程に多数の洗浄工程を含む。この際、可溶型ChATは染色されずに洗い流されてしまうと考えられる。一方、MSIによる手法では洗浄工程は含まないため、膜貫通型ChATと可溶型ChATのいずれも可視化できていると考えている。すなわち、前根と前角をつなぐChATは可溶型ChATであると結論づけた。以上のように、MSIを用いた酵素活性可視化手法は、酵素の機能を見るだけではなく、既存の染色手法では見ることのできなかったタンパク質の存在をも知ることができる優れた手法であると考えている。
現在、筆者のグループではこの手法の拡張性を確認するために、様々な酵素と試料 (マウスやヒト組織だけではなく米麹や植物を含む) を対象として研究を進めているところである。
5.MSIの社会実装を目指したスタートアップの起業
以上、ごく一部であるがMSIの応用について触れた。導入部でも述べた通り、MSIはどのような試料でも切片作成が可能であればさまざまな分子を見ることが可能である。例えば、医薬品のイメージングの場合、動物やヒト試料で任意の臓器を採取しその中で医薬品そのものを検出することによって、非常に説得力のあるデータを提供することができる。しかし、これを実現しようとすると思った場合、装置のみならずサンプル作成のノウハウが必要となり、このノウハウがMSI普及におけるボトルネックであると考えている。
このような背景から、筆者は2019年12月16日にMSIの受託分析を行う株式会社ミルイオン (https://www.miruion.com/) を立ち上げた。なお、代表取締役は、別専攻の学部学生が勤めている (現在、CEO業に専念するために休学中)。起業してから2年が経過したが、若きCEOの努力の甲斐もあってベンチャーキャピタルからの投資を受けることなく、自社で研究開発が行える状態になっている。
今後、ミルイオンが注力する分野は毛髪のイメージングによるヘルスモニタリングである。毛髪は、人体の状態を記録しながら平均1 cm/月の速度で伸長する。したがって、毛髪の長手方向でMSIによるマーカー分子の可視化を行えば、さまざまな疾患のモニタリングが可能になると考えている。今後、ミルイオンの毛髪分析が日本から世界に発信されることを期待している。
謝辞
本稿を執筆するにあたり、大阪大学大学院工学研究科生物工学専攻生物資源工学領域 福崎英一郎教授、大阪大学島津分析イノベーション協働研究所 飯田順子所長、また筆者のチームより2020年度に博士課程を修了した竹尾映美さん並びにAdinda Putri Wismanさんに感謝いたします。
文献
1) Caprioli, R. M., Farmer, T. B., Gile, J.: Anal. Chem., 69, 4751 (1997).
2) Spengler, B., Karas, M., Bahr, U., Hillenkamp, F.: Ber. Bunsenges. Phys. Chem., 93, 396 (1989).
3) Spengler, B., Hubert, M.: J. Am. Soc. Mass Spec., 13, 735 (2002).
4) Wisman, P. A., Tamada, Y., Hirohata, S., Fukusaki, E., Shimma, S.: Mass Spectrom. (Tokyo), 9, A0089 (2020).
5) Takeo, E., Fukusaki, E., Shimma, S.: Anal. Chem., 92, 12379 (2020).
6) Takeo, E., Sugiura, Y., Ohnishi, Y., Kishima, H., Fukusaki, E., Shimma, S.: ACS Chem. Nurosci., 12, 2079 (2021).
7) Takamatsu, H.: Trans. Soc. Path. Japan, 29, 429 (1939).
8) Gomori, G.: Proc. Soc. Exp. Biol. Med., 42, 23 (1939).
9) Shimma, S., Takashima, Y., Hashimoto, J., Yonemori, K., Tamura, K., Hamada, A.: J. Mass Spectrom., 48, 1285 (2013).