【トピックス】
自己組織化ペプチドを用いたバイオ機能超分子材料の創製
若林里衣、神谷典穂、後藤雅宏
九大院工
1.はじめに
自己組織化とは、分子が分子間に働く様々な相互作用により自発的に集まり特定の秩序だった構造を形成する現象であり、自然界のあらゆる場所で見られる。形成される構造体は、分子に導入した機能部位の集積化や外部刺激に対する応答性、自己修復能等の一分子同士の足し合わせでは成し得ない機能を持つ点から超分子と呼ばれ、特に多数の分子が一次元に集積化し形成される超分子ポリマー材料は、既存のポリマー材料にはない、あるいは既存のものよりも優れた機能を示す材料として、エレクトロニクスやバイオテクノロジー、医療等、様々な分野での応用が期待されている。我々は特にバイオ分野への応用を目指し、水中で自己組織化する両親媒性ペプチド (PA)1)を用いた新たな超分子材料の開発を行ってきた。本稿では、我々が最近開発したサイズ制御と酵素反応により事後修飾が可能な超分子ポリマーに関して、その設計戦略からバイオ応用展開までを解説する。
2.サイズ制御可能なPA超分子ポリマー
2-1 相補的相互作用を用いた超分子ポリマーのサイズ制御
通常、超分子ポリマーを形成するようなモノマー分子は、媒体中に溶解後、自己組織化温度以下で自発的に集合する。超分子ポリマーの一次元方向のサイズ、すなわちポリマーの伸長方向における“重合度”は、重合に複数の比較的強い分子間相互作用が使われることや、重合の開始位置を指定できないことから、制御が困難とされてきた。しかしながら最近では、ポリマー化の“種”となる小さな会合体を重合の開始位置として利用したり2)、重合能力のないモノマー分子を開始剤として利用する3)等の戦略により、従来の高分子重合におけるリビング重合に相当する「超分子リビング重合」により、重合度 (サイズ) 制御の可能な超分子ポリマーが報告されるようになってきた。その大半は未だ有機溶媒中で集合する超分子に関する報告であるが、部分水系あるいは完全水系における超分子も報告され始めている4)。
我々はPAからなる超分子ファイバーの伸長方向のサイズ (超分子ファイバーの長さ) を制御するために、2種類のモノマー分子間の相補的相互作用を利用した手法を報告した (図1A)5)。ここでは、各々の分子は自己組織化せず、両者が共存し相補的相互作用が形成されて初めて集合が生じる、相補的相互作用が集合の起点となる設計とした。このようにランダムな自己組織化を抑制することで、PA分子に導入したサイズ決定因子により超分子のサイズ制御が可能ではないかと考えた。相補的相互作用部位として3:3の相補的水素結合ネットワークを形成するシアヌル酸誘導体 (Cya) とメラミン誘導体 (Mel) を用いた。CyaとMelをそれぞれPAと蛍光性小分子nitrobenzofurazan (NBD) に導入したCya-PAとMel-NBDを合成した。ここで、Cya-PAに導入するアルキル基の数を変えることで、これをサイズ決定因子として超分子ポリマーの成長度合いを変化させ、サイズの制御が可能かどうかを確かめた (図1B)。
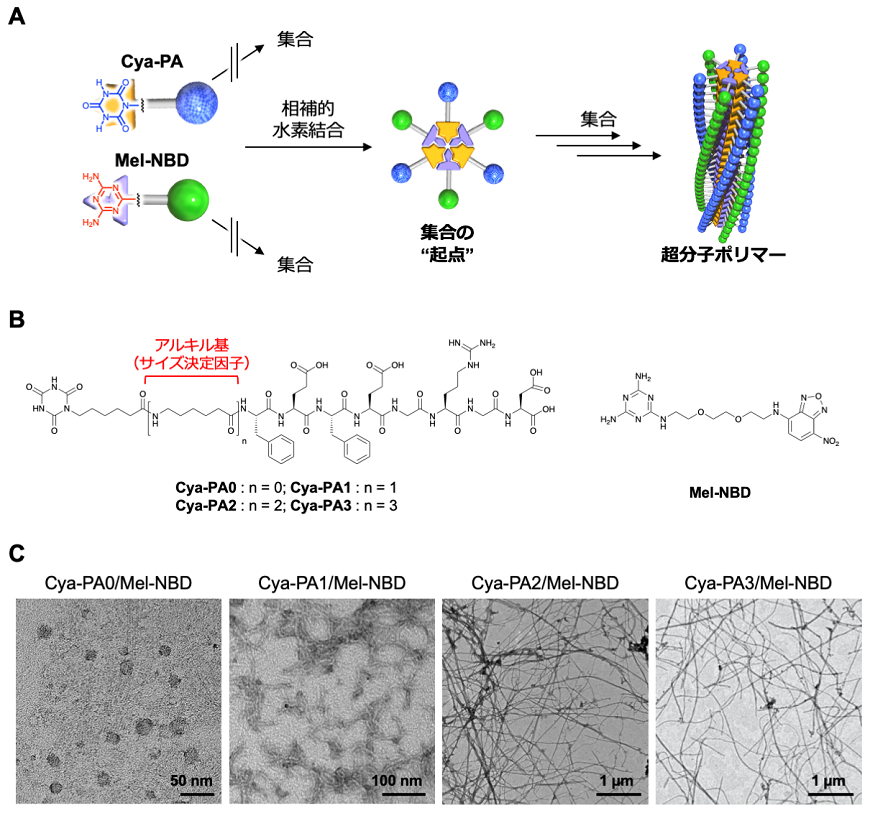

透過型電子顕微鏡 (TEM) や走査型プローブ顕微鏡 (SPM) により観察した結果、Cya-PAとMel-NBDを1:1のモル比で混合させた場合に超分子が形成された。またCya-PAに導入したアルキル基の数を0、1、2、3と増加させるのに従い、超分子ファイバーの伸長方向の成長が促され、アルキル基数が0のCya-PA0では数十 nm程度の粒子状の超分子が観察されたのに対し、アルキル基数が1のCya-PA1では200–300 nm程度の長さのロッド状超分子、アルキル基数が2と3のCya-PA2とCya-PA3では長さが数マイクロメートル以上の超分子ファイバーが形成された (図1C)。フーリエ変換赤外分光法 (FT-IR) を用いて分子間相互作用を解析した結果、いずれの超分子においてもCyaとMel間の相補的水素結合は形成されるが、PAのペプチド間水素結合には差異があり、アルキル基数を増加させるとペプチド間水素結合が増強され、これがサイズの差異に繋がることが示唆された。
以上のように、相補的相互作用を集合の起点とすることで、自己組織化分子であるPAに導入したアルキル基数をサイズ決定因子として、超分子ファイバーのサイズ制御が可能であることが示された。
2-2 サイズ制御した超分子の細胞内移行性
PAからなる超分子ポリマーに細胞膜上のレセプターに対するリガンドを導入することで、細胞に親和性を持つ人工細胞外マトリクスやドラッグデリバリーキャリア材料の開発につながる。本材料は、細胞と比較してサイズが小さい (数十 nm~数 µm) ため、ドラッグデリバリーキャリアとしての展開を指向し、細胞内移行性の評価を行った。 (ナノ) 材料は細胞内に、エネルギー依存的なエンドサイトーシスと非依存的な非エンドサイトーシスのいずれかの経路により移行する。いずれの経路においても、材料界面に存在するリガンド等の生物学的因子だけでなく、材料のかたちやサイズ、電荷等の物理化学的因子が影響を及ぼすことが報告されている。しかし、多くの材料において複数の物理化学的因子が相互に影響し合うため、一つの因子による影響を見極めるのは困難である。2-1項で紹介した我々の超分子は、超分子内部のアルキル基数を変えるだけでサイズ制御が可能なものであり、表面電荷やリガンドの密度を一定に保つことができることから、材料の細胞内移行におけるサイズ依存性を調査するための有用なツールになるのではないかと期待した。なお、我々は当初よりこの展開を期待し、本超分子にはがん細胞に高発現するインテグリンに対するリガンド配列Arg-Gly-Asp (RGD) を導入している。
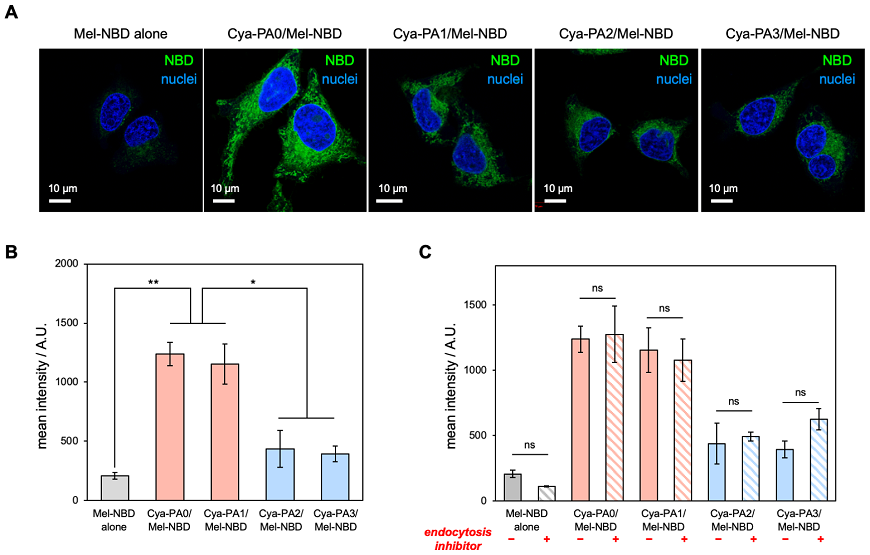
ヒト子宮頸がん由来HeLa細胞に対し種々のサイズを持つ超分子Cya-PA0/Mel-NBD、Cya-PA1/Mel-NBD、Cya-PA2/Mel-NBD、Cya-PA3/Mel-NBDを添加したところ、細胞内部にNBD由来の緑色蛍光が観察され、これら超分子ががん細胞に内在化することが確認された (図2A)。フローサイトメトリを用いて細胞内移行性の定量評価を行った結果、球状構造のCya-PA0/Mel-NBDとロッド状のCya-PA1/Mel-NBDにおいて、ファイバー状のCya-PA2/Mel-NBD、Cya-PA3/Mel-NBDと比較して有意に高い移行性が示された (図2B)。さらに細胞内移行における経路を調査するため、エンドサイトーシス経路を阻害した際の細胞内取り込みを定量すると、いずれの超分子も阻害の有無で変化がなかったことから、エネルギー非依存的な経路、すなわち細胞膜を直接介した経路で細胞内に取り込まれていることが示唆された (図2C)6)。このような非エンドサイトーシス経路は、物質を直接細胞質に送達することができるため、効率のよいドラッグデリバリー法として注目を集めるが、この経路で取り込まれる (ナノ) 材料は多くはない7)。まだ詳細は明らかではないが、我々の超分子は、相補的相互作用を核とした集合により形成されているため、一般的な両親媒性分子が形成する構造体と比較して隙間の多い構造であり、脂質二重膜との親和性が高いのではないかと推測している。

2-3 サイズ制御した超分子の相選択性とカスケード酵素反応への展開
2-2項において、超分子のサイズに応じて細胞内移行性が異なることを報告した。これは、膜のある二相間 (脂質二重膜で区切られた細胞外と細胞内) の移行において、サイズ依存性があることを示している。それでは、膜のない相間の移行に関してはどうであろうか?
近年、細胞内での液-液相分離により生じる核酸やタンパク質等が高濃度で存在するドロップレットが、“膜のないオルガネラ”として翻訳や代謝等の細胞内における重要な化学反応を制御する反応場として機能していることが注目されている8)。このドロップレットは、膜がないため外界との素早い物質のやり取りが可能であり、非常に動的な構造体である。また、細胞内の超分子ポリマーと言える微小管やアクチン繊維の重合や局在にも関わっていることが報告されている9)。
このような液-液相分離状態は人工的に容易に模倣することができ、例えばポリエチレングリコール (PEG) と多糖デキストラン (Dex) をある濃度以上で水に溶解するとPEGに富む相とDexに富む相に分離した水性二相分離を示し、PEG連続相の中にDexに富むドロップレットが形成される。そこで、サイズの異なる超分子である、ロッドを形成するCya-PA1/Mel-NBDとファイバーを形成するCya-PA3/Mel-NBDをPEG/Dex系に導入し、共焦点レーザー顕微鏡 (CLSM) によりその局在を確認した。その結果、Cya-PA1/Mel-NBDには殆ど相選択性が認められなかったが、Cya-PA3/Mel-NBDはDex相に対する選択性を示し、本超分子はサイズに応じた異なる相選択性を示すことが明らかとなった (図3A)。Dex相に選択性を示すCya-PA3/Mel-NBDをPEG/Dex環境下で形成させた場合、あるいはCya-PA3/Mel-NBDを先に形成させPEG/Dex系に導入した場合のいずれの場合にも局在に変化はなかったことから、この相選択性は超分子の生成のしやすさではなく、形成した超分子の性質によるものであることが示唆された。
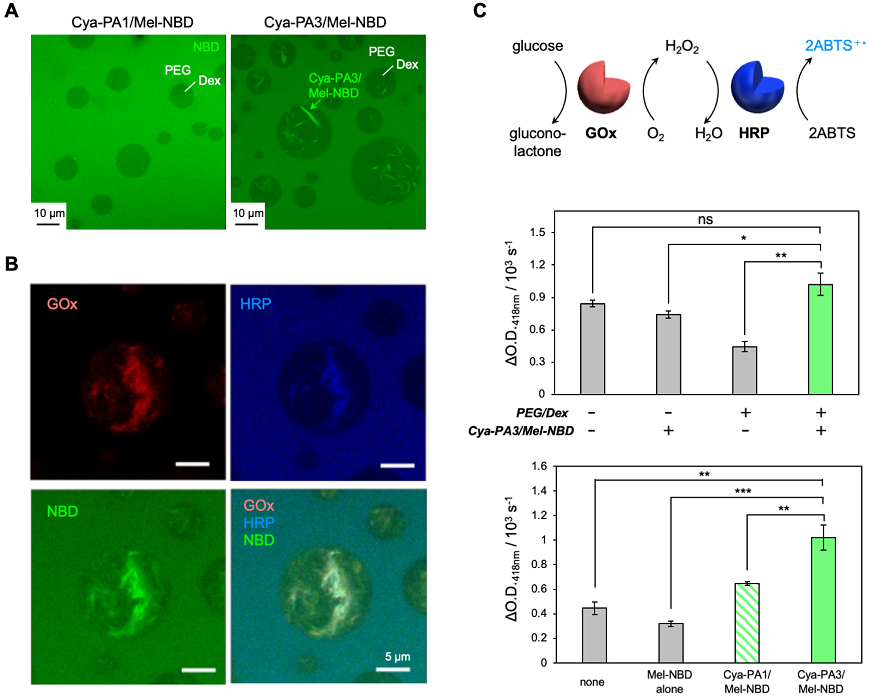

本検討に用いているPAベースの超分子は、種々の相互作用により、タンパク質を物理吸着する。実際、Cya-PA3/Mel-NBDは蛍光タンパク質や酵素を構造体界面に物理的に吸着させることが実験的に確かめられた。この超分子ファイバーは生理条件下で負に帯電しているが、正負いずれの表面電荷を持つタンパク質であっても、あるいは塩存在下においても物理吸着が生じることから、静電相互作用だけでなく、例えば水素結合や疎水性相互作用等の様々な分子間相互作用が働くことで物理吸着するのではないかと考えられる。そこで、Cya-PA3/Mel-NBDファイバーがPEG/Dex系においてDex相に選択性を示すこと、タンパク質を物理吸着させることの二つの特徴を利用し、連続反応を触媒する酵素群をDex相中のファイバー上に吸着させ、系中で近接化させることで、反応効率の向上が行えるのではないかと考案した。グルコースオキシダーゼ (GOx) と西洋わさび由来ペルオキシダーゼ (HRP) をカスケード酵素ペアとして用い、この概念実証を行った。緩衝液中でCya-PA3/Mel-NBDとGOx、HRPを混合すると、いずれの酵素もCya-PA3/Mel-NBDファイバー上に物理吸着することが確かめられた。PEG/Dex系において、GOx単体はDex相、HRP単体はPEG相にそれぞれ均一に存在し、異なる局在を示したが、Cya-PA3/Mel-NBDファイバーを共存させると、Dex相に局在するファイバー上にGOxとHRPが共局在した (図3B)。カスケード酵素反応により生じる生成物の生成速度 (図3C、上) を比較すると、PEG/Dex系において、Cya-PA3/Mel-NBDの共存により大幅に速度が上昇した。この生成速度は、緩衝液中でCya-PA3/Mel-NBDが共存する場合と比較して有意に高く、Cya-PA3/Mel-NBD非存在下のフリーな酵素同士と比較しても向上した (図3C、中)。また、緩衝液中でファイバー上に酵素を吸着させた際には生成速度の上昇は見られなかったことから、Dexドロップレット内の限られた空間内においてファイバー上に酵素が共局在することが重要なのではないかと考えられる。興味深いことに、PEG/Dex系に共存する超分子の種類によって、この生成速度が異なることが確かめられ、超分子のサイズにより液-液相分離系での局在やタンパク質吸着性が変わることで、酵素反応性を制御できる可能性が示唆された (図3C、下)10)。
3. 酵素反応により事後修飾が可能なPA超分子ポリマー
3-1 酵素反応部位を持つPAの設計と事後機能化
自己組織化は分子間の相互作用により生じるため、光や熱、pH等の外部刺激に応答した分子構造変化を利用して集合を制御することができる。最近、外部刺激として酵素反応を用い、自己組織化分子の分子構造変換により集合を促す取り組みが盛んに行われており、プロテアーゼやホスファターゼ等の酵素を用いた例が報告されている11)。特に細胞内外に存在する酵素に応答した分子を設計することで、細胞内や細胞表層で自己組織化を促し、細胞機能に変化を与えることができる12,13)。一方で、集合した超分子に対して架橋酵素を作用させることで、超分子に別の因子を付与する「超分子の事後機能化」が可能となる (図4A)。特にタンパク質等の複雑な構造を持つ生体高分子を機能化することができれば、より高度な機能を発現するバイオ材料になりうる。しかし、この戦略に用いられる酵素はトランスグルタミナーゼ14)やソルターゼ15)等数種類の酵素に限られ、短いペプチド配列からなる超分子で反応部位を厳密に制御した報告例は皆無であった。
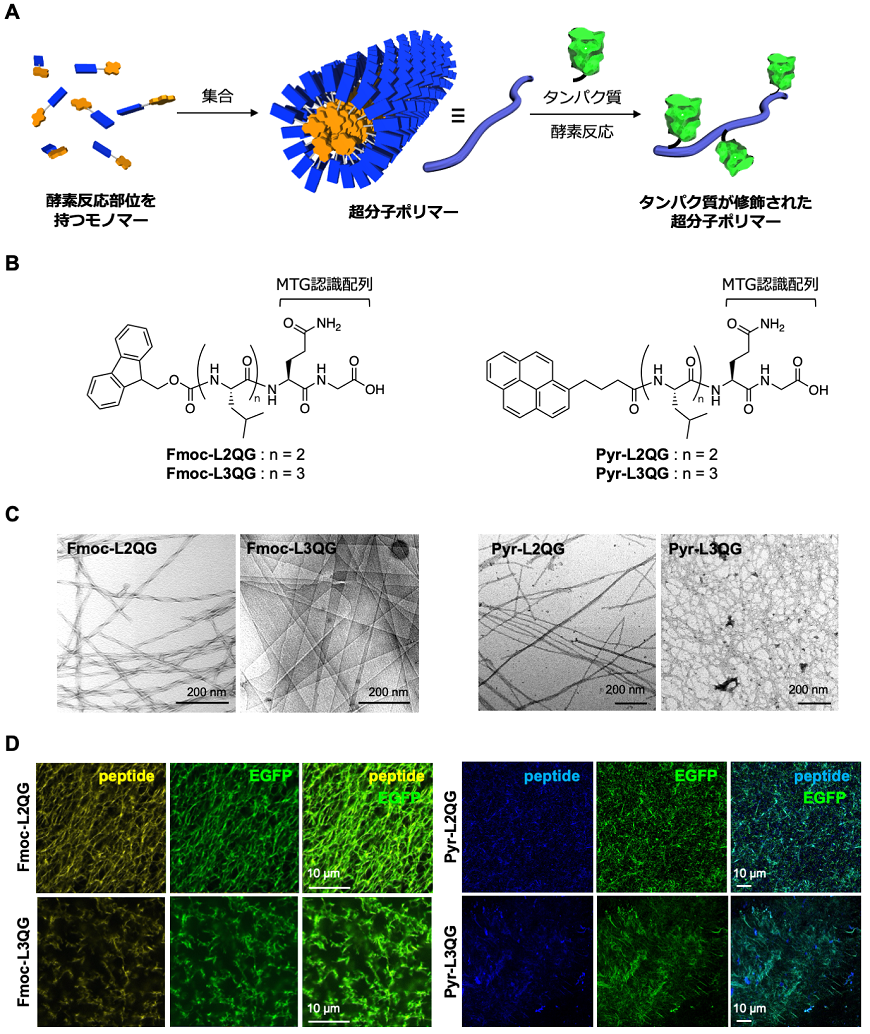

我々は、特定の配列中のGln (Q) 残基とLys (K) 残基の側鎖間の架橋反応を触媒する翻訳後修飾酵素、微生物由来トランスグルタミナーゼ (MTG) を用い、タンパク質の部位特異的修飾による事後機能化が可能な自己組織化ペプチドの開発に取り組んだ16)。MTGが認識するGln基質のN末端側には疎水性あるいは芳香族性のアミノ酸が選択されることから、これを自己組織化部位として活用することを考案し、芳香族性の9-fluorenylmethyloxycarbonyl (Fmoc) 基あるいはpyrenyl (Pyr) 基、および疎水性アミノ酸Leu残基を複数導入した計四種類の自己組織化ペプチド、Fmoc-LnQG (n=2, 3)、Pyr-LnQG (n=2, 3) を設計・合成した (図4B)。これらのペプチドは緩衝液中においてFmoc基あるいはPyr基間のπ-π相互作用とペプチド間の水素結合により自己組織化し超分子を形成した。興味深いことに、Fmoc-LnQGに関して、Leu残基を2つ有するFmoc-L2QGは幅10–20 nm程度の細いリボン/ファイバー構造を、3つ有するFmoc-L3QGは幅100–200 nm程度の平らなテープ状構造を持つことが確認された (図4C、左)。Fmoc-L2QGとFmoc-L3QGの比較およびpHを変化させた際の蛍光およびFT-IRスペクトル変化から、Fmoc-L3QGではLeu残基数が1増えたことによりペプチド間水素結合が増強され、疎水性のLeu側鎖間の相互作用が生じやすい平らな構造に転じたと考えられる。これに対し、より疎水性が高く広いπ平面を持つPyr-LnQGに関しては、Leu残基数に関わらずファイバー状構造に集合し、形成する超分子の構造はπ-π相互作用とペプチド間の水素結合のバランスにより決定されることが示された (図4C、右)。
蛍光小分子を用いてFmoc-LnQG超分子の酵素反応性を調査すると、Fmoc-L3QGよりもFmoc-L2QGが高反応性を示し、またpHを増加させるに従い酵素反応率が向上した17)。この結果に関して、超分子の構造や表面電荷の違いにより超分子とMTG酵素との接近性・認識に差異が生じたことによると考えているが、詳細はまだ不明である。またMTG反応性のLys残基を持つ反応タグを導入した緑色蛍光タンパク質 (Ktag-EGFP) も部位特異的に反応し、いずれの超分子上にもタンパク質の事後機能化が可能であることが示された (図4D)。
以上のように、MTG反応部位を持つ自己組織化ペプチドを用いて、タンパク質を部位特異的に事後修飾可能な超分子システムを構築した。修飾されたタンパク質側から見ると、自己組織化部位を修飾されることでタンパク質が非共有結合的に集積化した材料とみなすことができる。類似の構造体を得る方法として、タンパク質に遺伝子工学的に自己組織化ペプチドタグを導入する手法18)が報告されているが、本項で紹介した手法は、自己組織化特性を持つ疎水性のペプチド配列を導入することによるタンパク質の発現・フォールディングに与える影響を考慮する必要がなく、また非天然アミノ酸や人工小分子の利用も可能であるという点から、より汎用性の高い手法と言えるのではないだろうか。
3-2 抗原タンパク質修飾超分子による抗原デリバリーとワクチン応用
ワクチンは抗原となるペプチド・タンパク質や弱毒化した病原体、あるいは抗原をコードしたmRNA等の核酸を体内に投与し抗原特異的な抗体を産生する医薬品である。高いワクチン効果を得るためには、抗原を免疫細胞へ効率的に送達し、免疫細胞を活性化する必要がある。最近、自己組織化ペプチドが形成する超分子ファイバーがアジュバント (=免疫賦活剤) として機能することが報告され、エピトープペプチドを導入した超分子ファイバーワクチンが盛んに研究され始めている19)。前項で紹介した超分子ファイバーは抗原タンパク質のデリバリーキャリアとして有効なワクチン材料となりうる。そこで抗原モデルタンパク質としてKtag-EGFP、超分子としてPyr-LnQG (n=2, 3) が形成する超分子ファイバーを用い、抗原タンパク質デリバリー能とワクチン効果の検証を試みた。
Pyr-LnQG超分子ファイバーを形成後にKtag-EGFP、MTGを添加し2時間酵素反応を行うことで、Ktag-EGFP修飾超分子ファイバー、Ktag-EGFP/Pyr-LnQGを調製した。高速液体クロマトグラフィー (HPLC) により解析した結果、Ktag-EGFPの修飾率はいずれのPyr-LnQGの場合にも80%以上であることが確かめられた。得られたKtag-EGFP/Pyr-LnQGをマウス由来樹状細胞DC2.4に添加し、抗原タンパク質の細胞内デリバリー能を調査した。その結果、Ktag-EGFP単体と比較してKtag-EGFP/Pyr-LnQGでは十~数十倍の有意に高いタンパク質デリバリー能を示した (図5A)。Ktag-EGFPとPyr-LnQG超分子ファイバーを物理混合したサンプルでは、このタンパク質デリバリー能の向上は見られなかったことから、抗原タンパク質が直接超分子ファイバーに修飾されていることが重要であることが示された。またデリバリー能は超分子ファイバーの種類にも依存し、Pyr-L2QGと比較してPyr-L3QGファイバーを用いた場合において有意に高くなった20)。この要因については調査中であるが、疎水性のLeu残基を多く持つことでより安定なファイバーを形成したことによるのではないかと考えている。
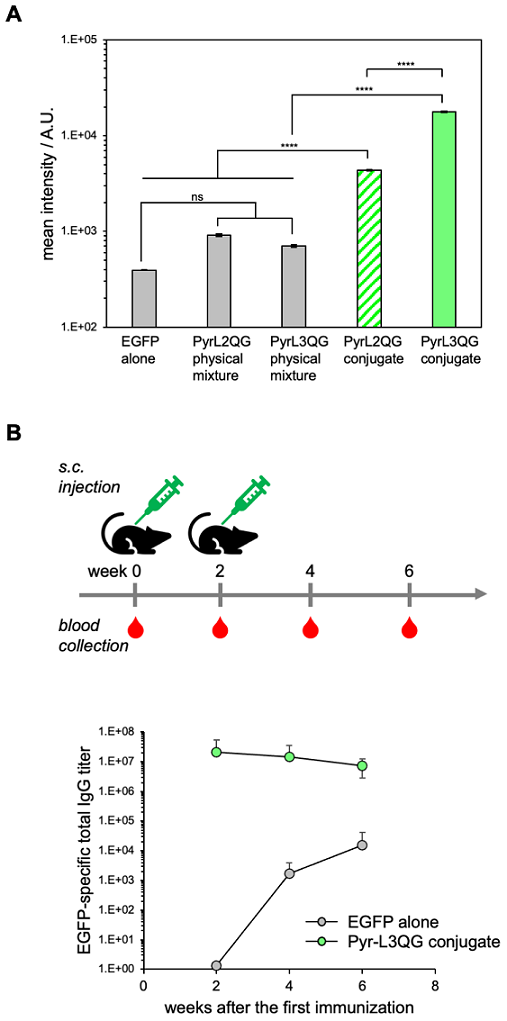

高い抗原タンパク質デリバリー能を示したKtag-EGFP/Pyr-L3QGを用いたワクチン効果を調査した。C57BL/6NマウスにKtag-EGFP、Ktag-EGFP/Pyr-L3QGを皮下投与し、血清中における抗Ktag-EGFP抗体の産生量をELISA法により評価した (図5B)。その結果、Ktag-EGFP投与群と比較して、Ktag-EGFP/Pyr-L3QG投与群では有意に高い抗体産生が確認された。Ktag-EGFP/Pyr-L3QG投与群では、一回目の免疫化直後から抗体価が非常に高く、その後ほぼ一定の値を示した。Ktag-EGFP投与群においては、免疫開始からの経過時間とともに抗体価が上昇したものの、免疫開始から6週間後迄において、Ktag-EGFP/Pyr-L3QG投与群を上回ることはなかった。
以上のように、MTG酵素反応により抗原タンパク質を修飾可能な超分子ファイバーは、ワクチン材料として有用であることが示唆された。現在進めている免疫メカニズムについての検討を基に、本ワクチン材料が有効な対象疾患の免疫治療にもつなげたいと考えている。
4.おわりに
本稿では、自己組織化ペプチドを用いたバイオ機能超分子材料の創製に関して、我々が最近取り組んでいる、サイズの制御された超分子と酵素反応により事後機能化が可能な超分子について、その設計戦略から応用展開までを概説した。自由な発想を基に材料を創ることで、サイズ依存的に直接膜を介して細胞内移行する超分子、膜のない界面をタンパク質と共に移行し局在化する超分子、あるいは生体内でワクチン効果を示す超分子等、新たな機能を示す超分子の開発に向けた芽が出てきたところである。このような機能を何故示すのかというメカニズムを明らかにすることでより高機能な材料開発につながり、真にバイオテクノロジーや医療に役立つ材料を創れると信じ、進んで行きたいと考えている。
謝辞
本稿で紹介させて頂いた研究は全て、九州大学大学院工学研究院の後藤・神谷研究室で行ったものであり、一緒に研究を進めてくれた学生の皆さんに心より感謝申し上げます。また研究の実施に際し、種々の研究費 (科研費No. JP20H05229, JP18K04855, 池谷科学技術振興財団研究助成金、資生堂女性研究者サイエンスグラント、稲盛財団 稲盛研究助成、豊田理化学研究所 豊田理研スカラー、新化学技術推進協会 新化学技術研究奨励賞) のご支援をいただきました。ここに感謝申し上げます。最後になりましたが、本稿の執筆の機会を賜りました酵素工学研究会の先生方に深く御礼申し上げます。
文献
1) Sato, K., Hendricks, M. P., Palmer, L. C., Stupp, S. I.: Chem. Soc. Rev., 47, 7539 (2018).
2) Ogi, S., Sugiyasu, K., Manna, S., Samitsu, S., Takeuchi, M.: Nat. Chem., 6, 188 (2014).
3) Kang, J., Miyajima, D., Mori, T., Inoue, Y., Itoh, Y., Aida, T.: Science, 347, 646 (2015).
4) Fukaya, N., Ogi, S., Kawashiro, M., Yamaguchi, S.: Chem. Commun., 56, 12901 (2020).
5) Wakabayashi, R., Obayashi, H., Hashimoto, R., Kamiya, N., Goto, M.: Chem. Commun., 55, 6997 (2019).
6) Obayashi, H., Wakabayashi, R., Kamiya, N., Goto, M.: to be submitted.
7) Goswami, R., Jeon, T., Nagaraj, H., Zhai, S., Rotello, V. M.: Trends Pharm. Sci., 41, 743 (2020).
8) 白木賢太郎編: 相分離生物学, 現代化学増刊, 46 (2020).
9) Nakatani, N., Sakuta, H., Hayashi, M., Tanaka, S., Takiguchi, K., Tsumoto, K., Yoshikawa, K.: ChemBioChem, 19, 1370 (2018).
10) Obayashi, H., Wakabayashi, R., Kamiya, N., Goto, M.: to be submitted.
11) Williams, R. J., Mart, R. J., Ulijn, R. V.: Biopolymers, 94, 107 (2010).
12) Feng, Z., Han, X., Wang, H., Tang, T., Xu, B.: Chem., 5, 2442 (2019).
13) Maruyama, T., Restu, W. K.: Polym. J., 52, 883 (2020).
14) Collier, J. H., Messersmith, P. B.: Bioconjugate Chem., 14, 748 (2003).
15) Ohshima, T., Sakono, M.: Bioconjugate Chem., 28, 2687 (2017).
16) Wakabayashi, R., Suehiro, A., Goto, M., Kamiya, N.: Chem. Commun., 55, 640 (2019).
17) Wakabayashi, R., Higuchi, A., Obayashi, H., Goto, M., Kamiya, N.: Int. J. Mol. Sci., 22, 3459 (2021).
18) Hudalla, G. A., Sun, T., Gasiorowski, J. Z., Han, H., Tian, Y. F., Chong, A. S., Collier, J. H.: Nat. Mater., 13, 829 (2014).
19) O’ Neill, C. L., Shrimali, P. C., Clapacs, Z. P., Files, M. A., Rudra, J. S.: Acta Biomaterialia, DOI: 10.1016/
j.actbio.2021.05.003.
20) Fathullah, G. D. S., Wakabayashi, R., Cui, H., Minamihata, K., Kamiya, N., Goto, M.: to be submitted.