【トピックス】
微細藻類と従属栄養微生物との共培養系による二酸化炭素固定
山田亮祐
阪府大・院・工、JST・さきがけ
1.はじめに
化石資源の大量消費などが主な原因となり、大気中の二酸化炭素濃度は年々増加している。1984年における二酸化炭素の世界平均濃度は344 ppmであったのに対し、2019年では411 ppmとなった。また、二酸化炭素濃度の年間増加量も増加傾向にあり、2018年から2019年までの年平均の増加量は+2.6 ppmとなった (世界気象機関温室効果ガス年報)。大気中の二酸化炭素濃度の増加は、地球温暖化、海面上昇、洪水、海洋酸性化、生態系の乱れなどの多くの環境問題を引き起こしている可能性があり、二酸化炭素濃度の増加に対する懸念が高まっている1)。2015年に国連サミットで採択された持続可能な開発目標 (SDGs) に掲げられた、2030年までに達成すべき17の目標には、世界のエネルギーミックスにおける再生可能エネルギーの割合を大幅に拡大させる「エネルギーをみんなにそしてクリーンに」、気候変動及びその影響を軽減するための緊急対策を講じる「気候変動に具体的な対策を」などの項目が含まれており、大気中の二酸化炭素濃度の低減は世界的に重要な課題となっている。
二酸化炭素を固定し、大気中の二酸化炭素濃度を低減させる手法として、物理化学的固定法、地中貯留、生物学的固定法など様々な方法が研究されている2)。その中でも、植物や緑藻などの光合成生物を用いる生物学的固定法は、常温常圧の温和な条件下で、比較的低濃度の二酸化炭素を固定することができるため、環境負荷の低い二酸化炭素固定法として注目されている2)。
緑藻などの光合成微生物は、植物と比較して、増殖速度が速いため、環境負荷が低く、効率の高い二酸化炭素固定法として特に高い注目を集めている。これまでに、天然の光合成微生物や遺伝子組換え光合成微生物を用い、二酸化炭素を、アルコール、有機酸、油脂などの様々な有用物質に変換し固定した例が報告されている2)。一方で、緑藻を用いて、二酸化炭素を固定する場合、二酸化炭素が希薄な大気雰囲気下では、緑藻の増殖速度が遅く、二酸化炭素固定効率が低いことが問題となる。Chinnasamyらは、緑藻Chlorella vulgarisを、異なる二酸化炭素濃度の雰囲気下で10日間培養し、その細胞量を測定した3)。その結果、大気雰囲気下に近い360 ppmの二酸化炭素濃度下では約3.5 mg-biomass/Lの細胞生産量であったのに対し、最適条件であった60000 ppmの二酸化炭素濃度下では約210 mg-biomass/Lの細胞生産量となり、約60倍の値を示した。この結果は、緑藻を用いた生物学的二酸化炭素固定において、効率的に二酸化炭素を固定するためには、大気二酸化炭素よりも高濃度の数万ppm程度の二酸化炭素濃度が必要であることを示している。現在、世界中で実用化されている微細藻類培養設備の多くは、工場や発電所などの二酸化炭素固定排出源の近隣に立地し、固定排出源から得られる高濃度の二酸化炭素を利用している。従って、実用的な微細藻類培養設備はその立地条件に制約があることが問題となる。また、微細藻類は、植物とは異なり、二酸化炭素の排出抑制には寄与できるが、大気中の希薄な二酸化炭素を固定し、その濃度を直接的に低減することは困難であることも問題となる。
近年、光合成を行う微細藻類と、光合成を行わない従属栄養微生物を共培養することにより、二酸化炭素が希薄な大気雰囲気下においても、効率的な二酸化炭素の固定が行える微細藻共培養系が注目を集めている (図1)。このような共培養系では、従属栄養微生物の呼吸により生じる二酸化炭素により、微細藻類の増殖能が向上している可能性が指摘されている4)。また、この他にも、微細藻類にとってストレスになりうる酸素を従属栄養微生物が消費することや、種々の化合物を微生物間で授受している可能性が指摘されている。微細藻共培養系には、二酸化炭素が希薄な大気雰囲気下において微細藻類を効率的に培養可能であるため、培養設備の立地条件に制約がないという強みや、大気中の希薄な二酸化炭素を直接的に固定できるという大きな強みがある。従って、微細藻共培養系による生物学的二酸化炭素固定技術は、世界中のどのような地域でも利用可能という高いポテンシャルを持つ、非常に有望な技術であると考えられる。
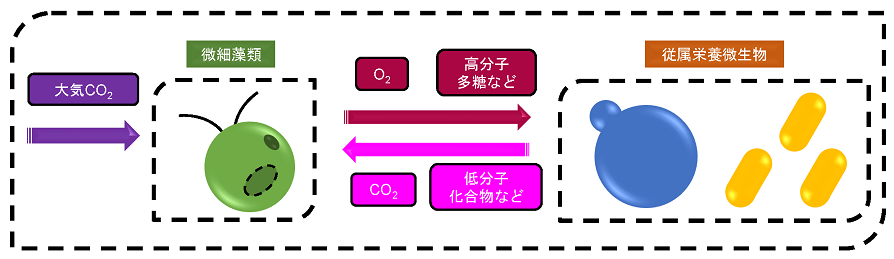
図1 微細藻類と従属栄養微生物との共培養系
本稿では、微細藻共培養系に着目し、二酸化炭素からの有用物質生産に主眼をおいた「微細藻共培養系による有用物質生産」、および排水処理に主眼をおいた「微細藻共培養系による排水処理」について解説する。また、筆者らの研究に関して、緑藻と大腸菌からなる共培養系において、その微生物間相互作用の一端を解明した成果についても解説する。
2.微細藻共培養系による有用物質生産
1項で述べたように、光合成微生物を用いた生物学的二酸化炭素固定法は、温和な条件下での二酸化炭素の固定を可能にする有望な技術であるが、二酸化炭素が希薄な大気雰囲気下での固定効率は低いという問題がある。これまでに様々な微細藻類を用い、二酸化炭素を、アルコール、油脂、イソプレノイド、アルカン、有機酸、糖、バイオプラスチックなどに変換・固定した例が報告されている2)。しかし、それらの研究の多くは、少なくとも10000 ppm以上の二酸化炭素濃度下で実施されており、これは大気二酸化炭素濃度の24倍以上に相当する。従って、微細藻類による有用物質生産の設備は、工場などの二酸化炭素固定排出源の近隣に設置する必要があり、立地条件に大きな制約がある。
このような問題を解決するために、光合成を行う微細藻類と、光合成を行わない従属栄養微生物とを共培養することで、希薄な二酸化炭素から有用物質を生産する試みが行われている (表1)。微細藻共培養系による有用物質生産で最も報告例の多い目的化合物の一つは油脂である。Kitchaらは緑藻Chlorella spp.と油脂酵母Trichosporonoides spathulataとの共培養について報告している5)。大気雰囲気下において、Chlorella spp.とT. spathulataを共培養したところ、培養72時間後に5.74 g/Lの油脂を生産することに成功している。これは、油脂生産を担うT. spathulataを単独で培養した場合の1.6倍の値であった。また、これらの微生物をアルギン酸ビーズ内に包括して培養しても、同等の増殖能や油脂生産性を示すことも合わせて報告しており、細胞や油脂の回収を容易にする可能性についても言及されている。
表1 微細藻共培養系による有用物質生産
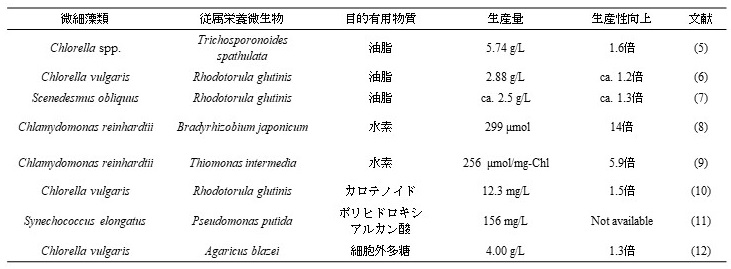
微細藻共培養系を用いた水素生産に関しても、複数の報告がある。Wuらは、緑藻Chlamydomonas reinhardtiiと窒素固定細菌Bradyrhizobium japonicumとの共培養による水素生産について報告している8)。大気雰囲気下において、C. reinhardtiiとB. japonicumを共培養したところ、培養19日後に299µmolの水素を生産することに成功している。これは、水素生産を担うC. reinhardtiiを単独で培養した場合の14倍の値であった。この共培養系において、水素生産性が向上した原因は、共培養により、培地中の酸素濃度が低下したことやC. reinhardtiiの増殖能が向上したことであると考えられている。
その他の微細藻共培養系を用いた有用物質生産の例としては、緑藻C. vulgarisと油脂酵母Rhodotorula glutinisの共培養によるカロテノイド生産10)、シアノバクテリアSynechococcus elongatusと細菌Pseudomonas putidaとの共培養によるポリヒドロキシアルカン酸生産11)などが挙げられる。共培養系による二酸化炭素からの有用物質生産の報告例は、微細藻類を単独で用いた場合と比較して少ないのが現状である。しかし、共培養系による二酸化炭素からの有用物質生産には、二酸化炭素が希薄な大気雰囲気下においても、効率的な有用物質生産が実現できるという大きな優位性があるため、今後も盛んに研究が進められていくものと考えられる。
3.微細藻共培養系による排水処理
微細藻共培養系を、排水処理に応用する研究も高い注目を集めている。国や地域にも依存するが、一般的な排水処理方法では、窒素、リン、有機炭素の除去率が低いことが問題になる場合が多い13)。排水からこれらの物質を除去するためには、排水に曝気を行い、微生物の働きを利用する活性汚泥法がよく用いられる。また、より高い除去率が要求される場合には、微生物を用いた高度処理が行われるケースもある。しかし、このような、微生物を用いた排水処理には、通常は多くの酸素を必要とするため、曝気を行う必要がある。この曝気には多くの電力を必要とし、総排水処理費の30%を占めるとの報告もある13)。従って、この曝気にかかるコストを低減することは、排水処理全体のコストを低減することに大きく寄与すると考えられる。
前述のとおり、微細藻類は光合成により二酸化炭素を素へと変換できるため、微細藻類を排水処理に用いることで、曝気コストの低減や、排水処理における二酸化炭素の排出を抑制することが期待できる。微細藻類を単独で用いた排水処理のアイデアについては、1960年頃にすでに報告されている14)。しかし、今日まで、微細藻類を用いて、産業規模で排水処理を実施している例は極めて稀である。この原因は、微細藻類の増殖速度の遅さに起因する排水処理効率の低さや、排水処理後に発生する細胞回収の困難さなどにあると考えられる4,15)。
微細藻類を単独で用いた排水処理の欠点を克服するため、微細藻共培養系を用いた排水処理に関する研究が注目されている (表2)。de-Bashanらは、緑藻C. vulgarisと、緑藻の増殖を促進する細菌であるAzospirillum brasilenseを共包括したアルギン酸ビーズを排水処理に用いることで、C. vulgarisのみを用いた場合と比較して、窒素やリンを高い効率で除去できることを報告している16)。同様に、Liangらは緑藻C. vulgarisと細菌Bacillus licheniformisとを組合せた場合に17)、Mujtabaらは緑藻C. vulgarisと細菌Pseudomonas putidaを組合せた場合に18)、排水から窒素、リン、有機炭素などを効率的に除去できることを報告している。微細藻類を従属栄養微生物と共培養することにより増殖速度が向上するという特徴は、排水処理においては、排水処理効率を向上させることに繋がるため、微細藻共培養系は、排水処理においても非常に有用であると考えられる。
表2 微細藻共培養系による排水処理
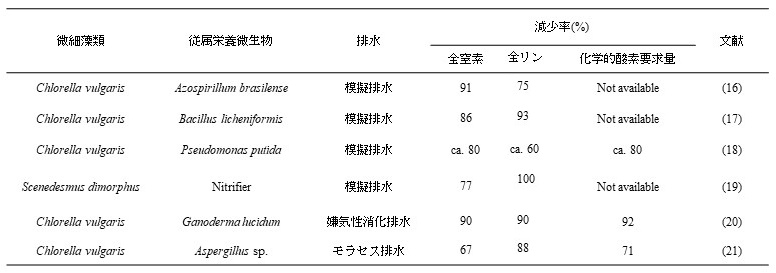
微細藻共培養系を排水処理に用いるもう一つの利点は、細胞の回収が容易になる場合があるという点である。微生物による排水処理では、その過程で大量の微生物細胞が発生するため、その分離にも多くのコストが必要となる15)。従って、排水処理において、効率的な細胞回収技術も重要な開発要素となる。微細藻類の細胞は凝集塊を形成しづらいためサイズが小さい、運動性がある、細胞表面が負に帯電している、細胞密 度が低いなどの理由から、経済的に分離することが困難である15)。そこで、凝集しやすい従属栄養微生物と微細藻類を共培養し、共凝集を引き起こすことで、排水処理の結果として生じた細胞の分離・回収を容易にする技術が注目されている。Zhaoらは、緑藻C. vulgarisと糸状菌Ganoderma lucidumを共培養することで3–4 mm程度の共凝集塊を形成し、容易に培養液から分離できることを明らかにした20)。この共凝集塊を用いて、排水処理を行い、90%程度の窒素、リン、有機炭素の除去率を達成している。Yangらも同様に、緑藻C. vulgarisと糸状菌Aspergillus sp.を共培養することで共凝集塊を形成し、容易に培養液から分離できることを報告している21)。また、回収した細胞は多量の油脂を含んでおり、バイオディーゼル燃料用油脂として用いることが可能であるとしている。
以上より、微細藻共培養系は、高い排水処理効率や、共凝集による細胞分離性の高さから、排水処理においても非常に有望な技術であると考えられる。しかし、大規模な排水処理への適用に向けては、微細藻類に光を供給する培養設備のために広大な土地面積が必要となること、共培養系を安定に長期間維持することなど解決するべき課題は多い。今後より一層の研究の進展が期待される。
4.緑藻-大腸菌共培養系における微生物間相互作用の解明
2項および3項で解説したように、微細藻共培養系は、有用物質生産や、排水処理などに非常に有望な技術である。今後この技術をより発展させていくためには、共培養系における微生物間の相互作用をより詳細に明らかにしていく必要があると考えられる。そこで筆者らは、全ゲノムが解読されており、遺伝子組換えが可能であるなどの特徴を有する緑藻C. reinhardtiiと、遺伝子組換えが容易であり、比較的少ない栄養条件下でも生育可能であるなどの特徴を有する大腸菌Escherichia coliとの共培養において、2種の微生物間の相互作用の一端を解明するために研究を行った。
C. reinhardtiiとE. coliを共培養したところ、C. reinhardtiiの細胞数は、培養14日目に単独培養時と比較して、約1.9倍に向上した (図2A)。一方で、E. coliの細胞数は、単独培養時も共培養時も同様の傾向を示した。また、クロロフィルaの生成量は、培養14日目に単独培養時と比較して、約2.2倍に向上した (図2B)。従って、C. reinhardtiiとE. coliとの共培養では、C. reinhardtiiの増殖能だけが向上することがわかった。
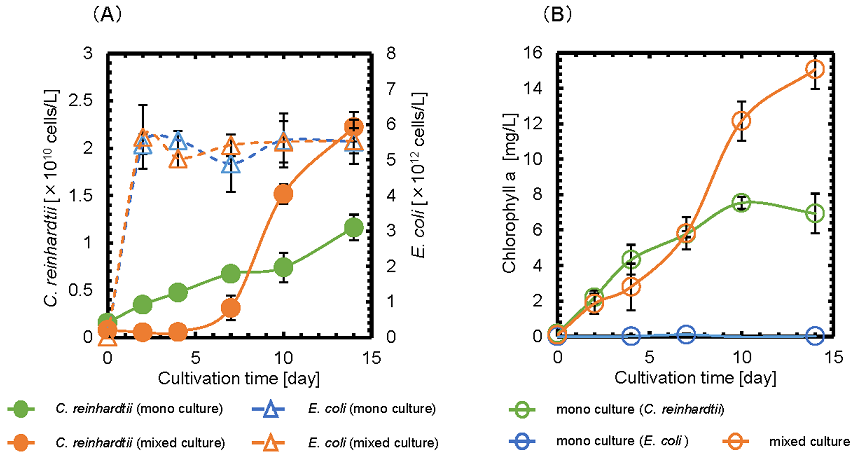
図2 (A) C. reinhardtiiとE. coliの細胞数の経時変化 (B) クロロフィルaの経時変化
次に、C. reinhardtiiとE. coliとの共培養による、C. reinhardtiiの遺伝子発現の変化を調べるため、培養14日目の、単独培養時に対する、共培養時の相対遺伝子転写量を測定した (図3)。共培養により、C. reinhardtiiの、二酸化炭素濃縮機構に関わる遺伝子 (HLA3、CCP1、CAH3、CAH6)、および酸化ストレスに関わる遺伝子 (GSTS1) の転写量が減少した。一方で、窒素同化に関わる遺伝子 (GLN1、GDH1) の転写量が増加した。また、共培養により、C. reinhardtiiの光合成の明反応に関わる遺伝子 (LHCBM6、psbA) および暗反応に関わる遺伝子 (RbcS1、GAP3、SEBP1、PRK1) の転写量が減少した。一方で、光エネルギーを吸収する役割を持つクロロフィルの生成に関わる遺伝子 (GSA) の転写量は増加した。
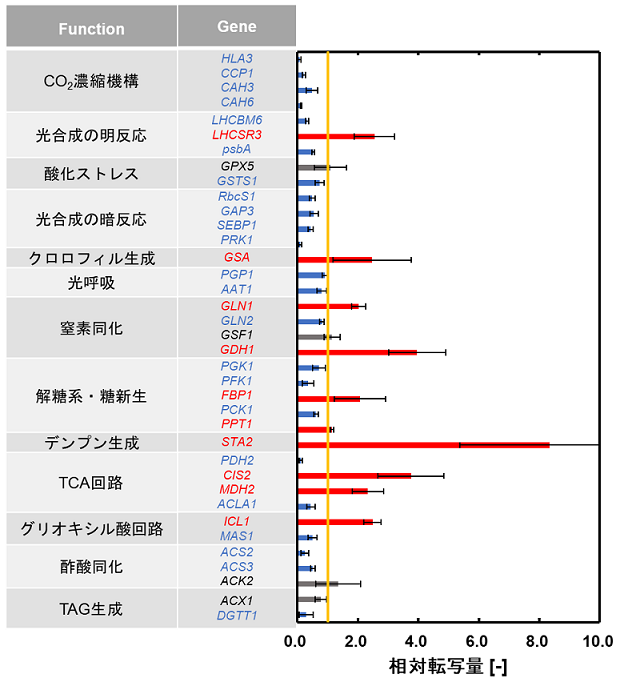
図3 C. reinhardtiiの遺伝子転写量
次に、C. reinhardtiiとE. coli間での炭素化合物の授受について検討するため、単独培養および共培養における、培地中の全無機炭素 (TIC) および全有機炭素 (TOC) の経時変化を測定した (図4)。E. coliの単独培養および共培養において、TICは、培養2日後に急激に増加した後、緩やかに減少した。一方で、TOCは培養2日後に減少した後、10日後まではほぼ一定であった。以上より、E. coliが培地中の有機炭素を消費し、無機炭素をC. reinhardtiiに供給することで、C. reinhardtiiの無機炭素の利用が促進され、共培養におけるC. reinhardtiiの増殖能が向上した可能性が考えられる。
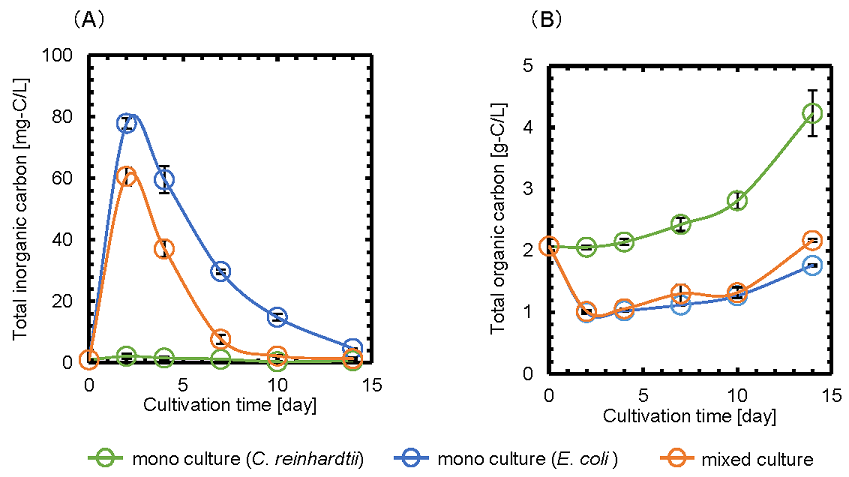
図4 (A) 全無機炭素の経時変化 (B) 全有機炭素の経時変化
次に、C. reinhardtiiとE. coli間での窒素化合物の授受について検討するため、単独培養および共培養における、培地中の全窒素 (TN) の経時変化を測定した (図5)。C. reinhardtiiの単独培養では、TNは、培養7日後までにほとんど変化がなかった。一方で、E. coliの単独培養では、TNは、培養4日後まで減少し、それ以降10日後まではほぼ一定となった。また、共培養では、培養10日後まで緩やかに減少した。既往の研究において、タンパク質等の有機窒素化合物を細菌が分解し、微細藻類が容易に利用可能なアンモニウム塩等の形態に変換する可能性があることが報告されている22)。したがって、本研究において、E. coliが培地中の有機窒素化合物を分解することで、C. reinhardtiiによる窒素利用が促進され、共培養におけるC. reinhardtiiの増殖能向上に寄与したと考えられる。
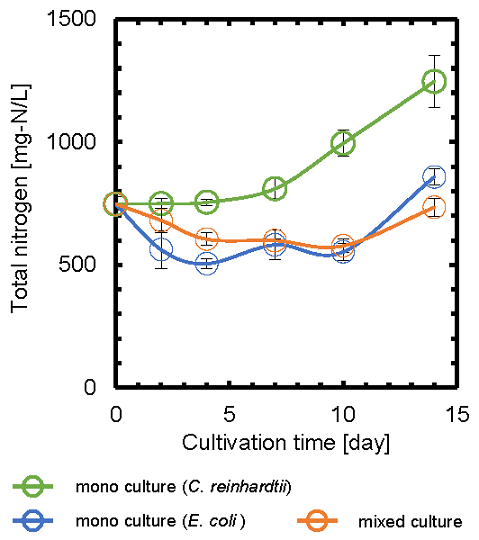
図5 全窒素の経時変化
最後に、共培養によるC. reinhardtiiのデンプン生成への影響を検討するため、単独培養および共培養における、培養14日目の細胞内に蓄積されたデンプン量を測定した (図6)。共培養において、C. reinhardtiiの細胞内デンプン量は、単独培養時と比較して、約2.5倍に向上した。これは、遺伝子転写量の測定において、共培養により、デンプン生成に関わる遺伝子STA2の転写量が増加していたことと一致する。
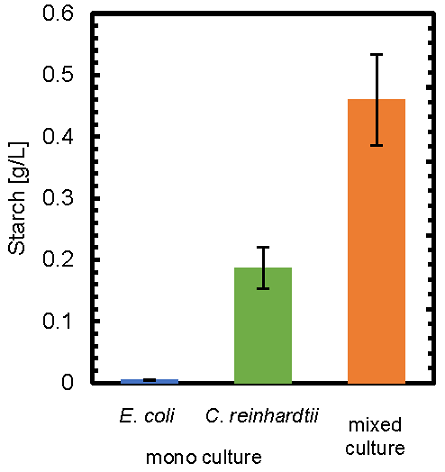
図6 細胞内デンプン量
本研究では、微細藻共培養系における微生物間の相互作用を明らかにするため、C. reinhardtiiとE. coliの共培養について検討した。C. reinhardtiiとE. coliの共培養では、C. reinhardtiiの増殖能が向上することが明らかとなった。また、共培養によるC. reinhardtiiの遺伝子発現や代謝物の変化を検討した結果、E. coliによる酸素の消費、二酸化炭素の生成、およびC. reinhardtiiが利用しやすい形態の窒素源の生成が、共培養におけるC. reinhardtiiの増殖能向上に寄与したことを明らかにした。 さらに、共培養により、C. reinhardtiiの細胞内のデンプン量が増加することを明らかにした。
5.おわりに
本稿では、微細藻共培養系に注目し、「微細藻共培養系による有用物質生産」および「微細藻共培養系による排水処理」について解説した。また、筆者らの研究に関して、緑藻と大腸菌からなる共培養系において、その相互作用の一端を解明した成果についても解説した。
「微細藻共培養系による有用物質生産」では、微細藻類を共培養することにより、二酸化炭素が希薄な大気雰囲気においても、種々の有用物質を効率的に生産可能であることが示されつつある。今後はより多種類の有用物質の生産や、より高効率の有用物質生産を目指して研究が展開されていくものと予想される。
「微細藻共培養系による排水処理」では、微細藻類を共培養することにより、曝気コストや細胞回収のコストを低減したり、排水処理の効率を向上したりすることが可能であることが示されつつある。今後は、大規模な排水処理に向けた培養設備の改良や、共培養系を安定に長期間維持する技術の開発を目指して研究が展開されていくものと予想される。
「緑藻-大腸菌共培養系における微生物間相互作用の解明」では、筆者らによる、C. reinhardtiiとE. coliとの共培養系における微生物間相互作用の一端を解明した研究について紹介した。C. reinhardtiiとE. coliとの共培養系では、E. coliによる酸素の消費、二酸化炭素の生成、およびC. reinhardtiiが利用しやすい形態の窒素源の生成が、C. reinhardtiiの増殖能向上に寄与したことを明らかにした。 さらに、共培養により、C. reinhardtiiの細胞内のデンプン量が増加することを明らかにした。この成果は、今後の微細藻共培養系による有用物質生産や排水処理の高効率化に関する研究においても有用な知見になると考えられる。
微細藻共培養系は二酸化炭素の希薄な大気雰囲気においても、効率的に二酸化炭素を固定できる、極めて有用な生物学的二酸化炭素固定法であると考えられる。今後は、微細藻類やそのパートナーとなる従属栄養微生物における効率的な遺伝子組換え技術、微細藻類を効率的に培養可能な大型培養設備、ソフトセンサーやデータサイエンスなどの先端技術を駆使した共培養系安定制御技術などの要素技術を開発し、産業規模での微細藻共培養系による有用物質生産や排水処理が実現されることが期待される。
謝辞
本研究の一部はクイーンズランド大学Ben Hankamer教授のグループと共同で実施しました。また、本研究の一部は、公益信託ENEOS水素基金およびJSPS科研費国際共同研究加速基金 (国際共同研究強化 (A) ) (JP18KK0413) の助成を受けて実施しました。
文献
1) Ghommem, M., Hajj, M. R., Puri, I. K.: Ecol. Model., 235-236, 1 (2012).
2) Salehizadeh, H., Yan, N., Farnood, R.: Chem. Eng. J., 390, 124584 (2020).
3) Chinnasamy, S., Ramakrishnan, B., Bhatnagar, A., Das, K. C.: Int. J. Mol. Sci., 10, 518 (2009).
4) Acién, F. G., Gómez-Serrano, C., Morales-Amaral, M. M., Fernández-Sevilla, J. M., Molina-Grima, E.: Appl. Microbiol. Biotechnol., 100, 9013 (2016).
5) Kitcha, S., Cheirsilp, B.: Appl. Biochem. Biotechnol., 173, 522 (2014).
6) Cheirsilp, B., Suwannarat, W., Niyomdecha, R.: New Biotech., 28, 362 (2011).
7) Yen, H.-W., Chen, P.-W., Chen, L.-J.: Bioresour. Technol., 184, 148 (2015).
8) Wu, S., Li, X., Yu, J., Wang, Q.: Bioresour. Technol., 123, 184 (2012).
9) Ge, B., He, J., Zhang, Q., Wei, Y., Xi, L., Khan, N. U., Huang, F.: Process Biochem., 82, 110 (2019).
10) Zhang, Z., Pang, Z., Xu, S., Wei, T., Song, L., Wang, G., Zhang, J., Yang, X.: Appl. Biochem. Biotechnol., 189, 193 (2019).
11) Löwe, H., Hobmeier, K., Moos, M., Kremling, A., Pflüger-Grau, K.: Biotech. Biofuels, 10, 190 (2017).
12) Angelis, S., Novak, A. C., Sydney, E. B., Soccol, V. T., Carvalho, J. C., Pandey, A., Noseda, M. D., Tholozan, J. L., Lorquin, J., Soccol, C. R.: Appl. Biochem. Biotechnol., 167, 1092 (2012).
13) Rashid, N., Park, W.-K., Selvaratnam, T.: Chemosphere, 194, 67 (2018).
14) Oswald, W. J., Gotaas, H. B.: Trans. Am. Soc. Civ. Eng., 122, 73 (1957).
15) Leng, L., Li, W., Chen, J., Leng, S., Chen, J., Wei, L., Peng, H., Li, J., Zhou, W., Huang, H.: Bioresour. Technol., 330, 125008 (2021).
16) de-Bashan, L. E., Moreno, M., Hernandez, J.-P., Bashan, Y.: Water Res., 36, 2941 (2002).
17) Liang, Z., Liu, Y., Ge, F., Xu, Y., Tao, N., Peng, F., Wong, M.: Chemosphere, 92, 1383 (2013).
18) Mujtaba, G., Rizwan, M., Lee, K.: Biotechnol. Bioprocess Eng., 20, 1114 (2015).
19) Choi, K.-J., Han, T. H., Yoo, G., Cho, M. H., Hwang, S.-J.: KSCE J. Civ. Eng., 22, 3215 (2018).
20) Zhao, Y., Guo, G., Sun, S., Hu, C., Liu, J.: Bioresour. Technol., 289, 121656 (2019).
21) Yang, L., Li, H., Wang, Q.: Bioresour. Technol., 275, 35 (2019).
22) Miller, R., Wu, G., Deshpande, R. R., Vieler, A., Gärtner, K., Li, X., Moellering, E. R., Zäuner, S., Cornish, A. J., Liu, B., Bullard, B., Sears, B. B., Kuo, M.-H., Hegg, E. L., Shachar-Hill, Y., Shiu, S.-H., Benning, C.: Plant Physiol., 154, 1737 (2010).