【トピックス】
世界一変わり者のウイルス:古細菌ウイルスの世界
望月智弘
東工大・地球生命研究所 (ELSI)
1.はじめに
地球上の全ての細胞性生物は、古細菌 (Archaea)、細菌 (Bacteria)、真核生物 (Eukarya) の3ドメインに大別され、その全てにウイルスは存在する。古細菌を宿主とする古細菌ウイルス、中でも熱水系から発見され80℃以上で増殖する超好熱古細菌ウイルスは、形態的にも遺伝的にも独自の世界を構成している。宿主である古細菌の研究は、20世紀後半にカール・ウーズが主要な細菌とは異なる原核微生物群の存在を提唱し始めたのとほぼ同時期に1,2)、カール・シュテッターらが世界各地の熱水環境から次々と新種の超好熱古細菌を発見したことで花開いた。その耐熱酵素の有用性の観点などからも、今日までに古細菌に関わる研究は大きな飛躍を遂げたと言える。特に21世紀に入ってからは、難培養性の常温性の古細菌も数多く分離され、非培養依存のメタゲノム法なども駆使することで、古細菌の全体像は徐々に明らかになりつつある。しかしそのウイルスとなると、培養株は漸く100株を超えた程度で (表1)、まだまだその全体像の理解にはほど遠い。その研究の進捗状況は、関わる研究者の数が少ないこともあり、宿主である古細菌の研究から数十年分、後塵を拝すかのような状況にある。しかしながらウイルスは微生物生態系の重要な構成員であるばかりか、生命の起源を研究する上でも欠かせない存在であり、未知の耐熱酵素の宝石箱でもある。本トピックスでは、世界で最も多種多様な古細菌ウイルスを発見している筆者が、地球上で最も忘れられた生物群とも言える古細菌ウイルスの世界を、超好熱古細菌ウイルスの粒子 (ビリオン) 形態や遺伝子の多様性、生命の起源研究との関わりなどを中心に紹介する。
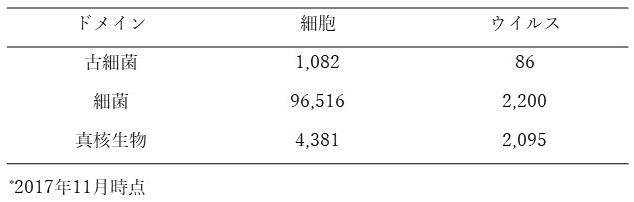
表1 NCBIに登録されているゲノム数*
1-1 意外に乏しい細菌ウイルス (ファージ) の多様性
本題である古細菌ウイルスを説明する前に、同じ原核生物であり頻繁に比較される細菌を宿主とするウイルス (ファージ) の多様性に関する概略から紹介したい。細菌ウイルスで最も良く知られている形状は、正二十面体の頭部から細胞表層に付着する尾部が伸びた、月着陸船に似た形状であろう。T4ファージなどに代表されるこのhead-tail型ウイルスは、ウイルス分類学上、Caudovirales目に属し、主に尾部の形状などからMyoviridae科、Podoviridae科、Siphoviridae科の3科に分類される (厳密には、Ackermannviridae科など近年になり新設された科も複数含む)。我々にとって身近な土壌や水圏から単離された細菌に感染する分離株ウイルス、ならびに環境サンプルからウイルス様粒子 (VLP:Virus Like Particle) を直接電子顕微鏡で観察した際も、約95%はこのhead-tail型のCaudovirales目ウイルスであるとされている3)。残り数%は、尾部を有さない正二十面体のTectivirdae科や、線状のInoviridae科ウイルスなどが占める。70℃程度で増殖するThermus属などの好熱性細菌を宿主とするウイルスも、大半がCaudovirales目ウイルスであり、一部Tectiviridae科やInoviridae科が発見されるのは同様である4)。このように、冷温域から高温域まで、またグラム陽性菌から陰性菌まで、細菌そのものは極めて多様性が高い反面、そのウイルス叢(virosphere)は思いのほか多様性に乏しい。そのため、国際ウイルス分類委員会(ICTV)による公式分類では、数千種登録されている細菌ウイルスは、12科に分類されているが、既知種の再分類や、メタゲノムデータによる新規配列の分類を除くと、新規培養株に対する新科の新設は約40年間起こっていない3)。
1-2 多様なる超好熱古細菌ウイルスの形状:レモン/紡錘型
超好熱古細菌を宿主とするウイルスが初めて報告されたのは1991年である。好酸性の好熱菌であるSulfolobus shibatae (培養温度78℃、pH3) から発見されたウイルスは、Sulfolobus spindle-shaped virus 1 (SSV1)と名付けられ、Fuselloviridae科が新設された5)。Spindleは紡錘(糸まき)のことであるが、このウイルスはレモンのような紡錘形をしている。このレモン/紡錘型のウイルスは、幅広い超好熱古細菌のみならず、好塩性古細菌や、土壌や水圏などの常温環境に普遍的に存在するアンモニア酸化古細菌からも発見されている6,7) (図1B)。一方でこの形状のウイルスは、細菌や真核生物を宿主とするウイルスからは1例も報告されていないため、まさに古細菌ウイルスを象徴する粒子形状と言える。一般的に、環境試料を0.22µmフィルターなどでろ過しウイルス画分を直接電子顕微鏡で観察したVLPでは、粒子の形状情報のみから宿主を同定することはほぼ不可能である。しかしこのレモン型VLPのみは、宿主が古細菌であると推定できる唯一の例と考えられる。
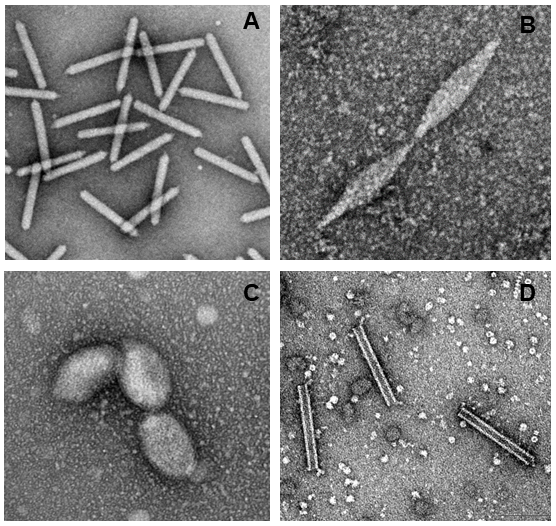

綺麗なレモン型以外にも、細胞外に放出されてから時間の経過とともに両端が伸びるBicaudaviridae科ウイルスや、一方のみが伸長してボウリングのピンの様な形状になるものなど、明らかにレモン型から進化したと考えられる変異型ウイルス群も多数発見されている8-10)。このように広範囲の古細菌から認められる一群のレモン型ウイルスは、古細菌の共通祖先(LACA: Last Archaeal Common Ancestor)の時点で存在していたことが確実視されているウイルス系統である11)。
なおこの記念すべきSSV1は、その宿主となった古細菌の種小名からも想像できる通り、日本原産である。別府温泉(大分県)にある「血の池地獄」から採取されたサンプルから、ドイツの研究グループにより単離されている。
1-3 多様なる超好熱古細菌ウイルス:ボトルやバネなどその他
筆者を含む多くの人にとっても最も奇異と思える粒子形状が、ボトル型ウイルスであろう。先のSulfolobus属の近縁種であるAcidianus属 (78℃、pH3) を宿主とるするAmpullaviridae科ウイルスABV (Acidianus bottleshapedvirus)は、その名の通り、ビール瓶やワインボトルのようなボトル型をしている12)。フランスのワインはボトルの形状から、いかり肩のボルドー型と、なで肩のブルゴーニュ型に分けられるが、このABVは明らかにブルゴーニュ型ボトルに分類することができるくらい、キレイななで肩ボトルの形状をしている。残念ながらこの稀有なウイルスは、研究グループがドイツからフランスに移った際に再培養に失敗したため、その後の研究が長らく途絶えていた。しかし最近、同グループがあらためて採取したイタリアの熱水サンプルの集積培養産物から、再度ボトル型VLPが電子顕微鏡下で確認された13)。今後、彼らにより2種目が単離培養され、この特異な粒子の形成機構も解明されることが大いに期待される。
筆者が鹿児島県の温泉から発見したSpiraviridae科ACV (Aeropyrum coil-shaped virus) も奇妙なバネ/コイル型をしている14) (図1D)。このウイルスも残念ながら継代に失敗したため詳細な粒子形成機構は不明であるが、部分分解した粒子などの電子顕微鏡観察から、(1)一本鎖DNAゲノムの周りをmajor capsid proteinが覆い、(2)輪ゴムを捩じるようにヌクレオプロテインがツイストして一本の直線状のヒモを形成、(3)そのヒモをバネのように巻く、という一連のプロセスによりバネ型ウイルス粒子が形成されているものと推察されている。
このようなボトル型やバネ型ウイルスも、細菌や真核生物のウイルスからは報告されていない極めて珍しい粒子形状である。一方でレモン型とは異なり、その宿主域/分布は広範囲の古細菌に及ぶわけではないことから、これらの系統は進化的には比較的最近に誕生したのではないか、と考えられている。
その他、他のドメインにおいて高頻度で見いだされる正二十面体や線状ウイルスも報告されている15,16)。先述した通り、細菌が優占する70℃あたりの熱水環境ではhead-tail型のCaudovirales目ウイルスが圧倒的に優占しているが、古細菌が優占する90℃以上ではどの形状が優占するとは言い切れないほど多様性が豊かである。一般的に細胞性微生物は、90℃以上になるとその多様性が低下すると言われている。しかしウイルスの多様性に関しては全くの逆である。なぜ超好熱性の古細菌ウイルスがここまで多様なのかは大きな謎である。
1-4 好塩性古細菌、メタン生成古細菌などのウイルス
歴史を紐解くと、最初に発見された古細菌ウイルスは好塩性の古細菌ウイルスである。1974年にHalobacterium salinarum (NaCl濃度20%、37℃ )から、head-tail型Caudovirales目ウイルスが発見されている17)。しかし、Halobacterium属という名称が示す通り、当時は「大部分の細菌とは異なる菌」という概念が無く、よくある細菌ウイルス(ファージ)の近縁種という認識であった。その後も多くの好塩性古細菌ウイルスが発見されているが、そのほとんどは同様のCaudovirales目ウイルスである。興味深いことに、細菌において報告されているMyoviridae科、Podoviridae科、Siphoviridae科の主要3科も全て報告されている。また僅かながら、活性汚泥などから、メタン生成古細菌に感染するCaudovirales目ウイルスも発見されている18)。
一方で、好塩性古細菌のみで見いだされるウイルス群も報告されている。その代表が、通常のウイルスで見られるタンパク質から成るキャプシド(殻)を有さない、脂質膜と表層タンパク質のみから成る珍しい構造のPleolipoviridae科ウイルスである19)。また、正二十面体のSphaerolipoviridae科は、好塩性古細菌と好熱性細菌との間で共有されているウイルス系統である20)。Caudovirales目ウイルスがそうであったように、好塩性古細菌と好熱性細菌との間にウイルス叢の結びつきがある傾向が見受けられる。このことは、太古からのウイルス進化過程を考察する上でも興味深い点である。
2.古細菌ウイルスのゲノム性質
2-1 ゲノム核酸型
ここまでに示した通り、形状に豊かな多様性が認められることが古細菌ウイルスの大きな特徴である。しかしながらその全てがDNAウイルスであり、RNAウイルスが1種も報告されていないこともまた、大きな特徴である。また、head-tail型Caudovirales目ウイルスやレモン型ウイルスをはじめ、その大半は二本鎖DNA(dsDNA)ゲノムを有する16)。
数少ない一本鎖DNA(ssDNA)ウイルスは、好塩性古細菌を宿主とする脂質膜性のPleolipoviridae科と、超好熱古細菌を宿主とするSpiraviridae科のみである。なおPleolipoviridae科はこれまでに8種報告されているが、ssDNAとdsDNAの両方のゲノムタイプが発見されている、珍しい特徴を併せ持っている。超好熱性のSpiraviridae科ウイルスは、単離源となった熱水環境は100℃以上に達し、培養温度も90℃であり、ssDNAゲノムとしては最も高温域から発見されている。その上、ゲノムサイズがそれまでに知られていた最大のssDNAウイルスの2倍以上あり、このような超高温環境下においても、脆弱な長鎖ssDNAがゲノムとして安定的に存在していること自体が驚きであった。前述した奇妙な粒子構造が、高度にssDNAを安定化させるのに役立っているものと考えられているが、現時点で詳細は不明である。
2-2 遺伝子配列の特徴
Head-tail型Caudovirales目ウイルスなどを除くと、レモン型ウイルスをはじめとした様々な形状の古細菌ウイルスは、ゲノム上にコードされる遺伝子群もまた、多様性に富んでいる。そのため、既知種に近縁種が存在しない新科ウイルスが発見された場合、ゲノム配列から推定されるORFを用いてBLAST検索を行っても、ほとんどがデータベース上のいかなる遺伝子とも相同性を示さない21)。一部、近縁種を含めた宿主菌由来の遺伝子や、他の古細菌ウイルスの遺伝子などに相同配列が見出されることもあるが、概ね70-80%ほどのORFは、データベース上に相同遺伝子が全く存在しない。
ウイルスには16S/18S rRNA遺伝子のような共通遺伝子が一つも存在しないため、菌の分類と比較して、ウイルス分類学は難航していた。これに対して近年、ほぼ全てのウイルスゲノムがコードする主殻タンパク質 (MCP: major capsid protein) の遺伝子を主たる指標とする分類法が徐々に確立しつつある。しかしながら古細菌ウイルスでは、MCP遺伝子ですら多様であるため、ゲノム配列データのみから当該ORFを断定するのは難しい14)。例えばその特異な粒子形状から同じ系統に属することがほぼ明らかなレモン型ウイルスですら、宿主の分類群が異なるとMCP遺伝子の配列保存性は著しく低下し、配列解析からMCP遺伝子を特定するには至らないことが多い10)。そのため多くの場合、MCP遺伝子を同定するには、古典的にSDS-PAGEから質量分析法などにより実験的に同定することが求められる。
3.生命の起源との関わり
3-1 RNAワールド仮説に対する検証法
古細菌、その中でもより進化的に古いとされる超好熱古細菌においてRNAウイルスが存在するか否かは、環境ウイルス学のみならず、生命進化を考察する上でも非常に重要である。なぜならば、熱水中においてRNA分子がゲノムとして存在しうるか否かは、生命の起源における教科書的セオリーである「熱水系RNAワールド仮説」の妥当性に対する議論を呼び起こすものとなるからである。
生命の起源においてもはや定説ともされるRNAワールド仮説では、生命は約40億年前にRNAゲノム細胞として始まった、とされている22)。その後の好熱菌の系統解析の結果から、それはおそらく好熱菌であったとされる。しかしながらRNA分子は一般的に60℃以上の高温下では、数十秒~数十分程度で分解されてしまう。そのため、一見、熱水環境下では、まだ未熟で複製にも時間を要するような弱々しい原始細胞が、不安定なRNA分子をゲノムとして利用し、途絶えることなく安定的に複製・増殖できた、と考えるのには無理があるように思える。他方、90℃以上の超高温下ではdsDNAも二本鎖の解離が起きてしまうため不安定である、とするのが物理化学的な法則である。しかし現に100℃を越える温度で増殖できる超好熱古細菌は多数発見されている。このことからも明らかなように、生命は必要とあらば、物理化学的リミットを突破するような「裏技 (酵素等) 」を発明しうる。なお、現在の培養実験における世界記録は、オートクレーブを越える122℃でも増殖する超好熱古細菌である23)。
同様に高温環境下でのRNA分子の安定性も、物理化学的には一見不可能なように見えるが、初期生命がそれを克服する裏技を先に持っていたとするならば、可能であろう。もし何らかの原始的メカニズムにより、高温下でのRNAゲノム細胞の存在を可能にしていたとするならば、現代においてもその機構を脈々と、熱水中のRNAウイルスに受け継がれていたとしても驚きではない。一方で、ある一定温度まではRNAウイルスが存在するが、それを越えると一切RNAウイルスが存在しない「RNAウイルスの上限温度」が明らかとなった場合はどうなるか。その場合は、RNAワールド仮説が真であるとするならば、生命の起源はその上限温度以下であったと考えるのが妥当である。つまり、現代の好熱性RNAウイルスの有無が、生命の起源の温度帯を推定する「疑似的温度計」としての役割も担うであろう。または逆に、どれほど探しても熱水環境から一切RNAウイルスが存在しないことが確定した場合は、生命の起源の教科書的仮説である「RNAワールド仮説」そのものを再検証する必要に迫られるであろう。
現在のところ、細菌ウイルスも含め、熱水環境中に生息する好熱性RNAウイルスの存在を示す確固たる証拠は得られていない。最も肉薄した研究例が、イエローストーン国立公園(米国)の熱水試料を対象にしたメタゲノム解析であり、未知のRNAウイルス様配列が検出されたことを報告するものである24)。しかし一般的に、メタゲノム法を用いて未知のウイルス配列を見出した場合、配列データのみからその宿主を推定することは、ドメインレベルですら困難である。そのため、この研究例で検出された新規RNAウイルス様配列は、例えば、偶然に風に乗って熱水に着水した動植物等の未知RNAウイルスである可能性も排除できない。好熱性RNAウイルスの存在を示す最も確かな方法は、その単離培養に成功することである。
3-2 太古代のウイルス叢
全ての現生細胞が、太古の熱水中に生息したであろうLUCA (Last Universal Common Ancestor) を共通祖先とする、という考えは、既に1990年代から提唱されていた。ウイルスに関しては、おそらく起源がかなり古く、既にLUCAの時代にも高確率で存在していたであろう、ということは広く想定されていたものの、具体的にどの系統が太古より受け継がれていたかに関しては、長らく不明であった。これは、繰り返しになるが、全ウイルスに共通する遺伝子が存在しないため、全ウイルスの系統樹を表すことができないことが最大の要因である。一部の研究者の間では、現代のRNAウイルスの一部は太古のRNAワールドの生き残りではないか、と考える説も根強い。
その祖先系統がLUCA時代にまで遡ることが示された初めての例が、好酸性超好熱古細菌Sulfolobus属(増殖温度78℃、pH 3)に感染し、2004年にイエローストーン国立公園から発見された正二十面体のTurriviridae科STIV (Sulfolobus turreted icosahedral virus) (dsDNAウイルス)である25)。このウイルス粒子の詳細な立体構造は、既に細菌と真核生物から発見されていた別の正二十面体ウイルスと極めて類似していた。このことから、それらの共通祖先であるLUCA時代に、このウイルスの祖先系統は存在していた、と考えられている。しかし、それぞれが分岐してから約三十億年ほど経過しているため、DNAやアミノ酸などのシーケンス解析からはもはや相同性は認められない。
前半の1-1.1-3などで示した、原核生物界では最も著名なウイルス系統であるhead-tail型Caudovirales目ウイルスに関しては、長らく超好熱古細菌から発見されていなかった。極めて複雑で精巧な構造であることもあり、生命進化の初期から存在していたとは考えづらく、耐熱性にも限界があると考えられていた。そのためこのウイルス系統は、まずLUCAから細菌ドメインに枝分かれが起きた後にマイルドな熱水環境で誕生し、何らかの形でドメインの障壁を越える感染が起こり、メタン生成古細菌や好塩性古細菌の世界にも広がった、と考えられていた。しかし近年、80℃で増殖する超好熱メタン生成古細菌Methanocaldococcus属に感染するCaudovirales目ウイルスが発見された26)。この大発見によりこのウイルスの耐熱機構は80℃以上とされる超好熱菌の定義の範疇に耐えうるものであり、超好熱菌であったとされる古細菌の祖先菌にもhead-tailウイルスが存在していた可能性が一気に広がった。細菌ドメインでは普遍的に存在していることは周知の通りであったため、ついに両者の祖先であるLUCAの時代にも既にこのウイルス系統が存在していたと示唆されるに至った11)。
現在、LUCA時代に存在していたことが確実視されるウイルス系統はこの2系統のみである。特筆すべきはこの2系統ともdsDNAウイルスであることである。LUCA時代に存在が確実視されているRNAウイルス系統はこれまでのところ確認されていない。しかしこれも、仮に今後、熱水環境から超好熱古細菌に感染する新規RNAウイルスが発見された場合、覆ることになるかもしれない。
いずれにしろ、約20年前には具体的なウイルス系統に関して太古代における存在を示唆するものは全く存在しなかったものの、今では2系統のみながらも具体例を挙げられるようになったのは当該分野における大きな飛躍である。このように、生命の起源や初期進化に関して多角的な知見を与えうる超好熱古細菌ウイルスは、究極の生きた化石である、と筆者は感じている。
4.今後の展望
4-1 酵素学的展望
残念ながらこれまでのところ、古細菌ウイルスから見いだされた酵素で商品化に至ったものは存在しない。ウイルス由来の酵素には、T4-ligaseや逆転写酵素などに代表される様に、DNAやRNAをエディットする酵素が多数存在する。また (超) 好熱菌由来の酵素と言えば、PCRで利用されるTaq、KOD、Pfuなど各種DNAポリメラーゼが有名である。ウイルスの多くは独自のポリメラーゼをコードすることから、超好熱古細菌ウイルスからも既存のポリメラーゼの能力を超える新規酵素が発見されることは、当初充分に期待されていた。しかし、残念ながら古細菌ウイルスのほとんどは、独自のポリメラーゼをコードしないことが明らかとなっている。十年ほど前までは、古細菌ウイルスのゲノム上にコードされている大量の機能未知遺伝子の中に、未知のポリメラーゼが隠れていることも疑われていた。しかし、ドメイン/モチーフ解析などのより詳細な解析の結果、DNAbinding domainなどがそもそも存在しないため、やはりポリメラーゼはほぼ存在せず、古細菌ウイルスはそのゲノムの複製には宿主ポリメラーゼを拝借していると考えられている。
しかしながら2-2で述べた通り、古細菌ウイルスのゲノムには機能未知な耐熱性酵素が多数コードされていることは事実である21)。特に、ゲノムDNAを高温下で安定化させるための未知酵素は、ほぼ間違いなく存在していると考えられる。例えば、筆者が発見した前述のSpiraviridae科ウイルスACVには、長鎖一本鎖DNAを高度に保護するDNA結合タンパク質が存在しているはずである14)。いくつかの超好熱古細菌ウイルスでは遺伝子改変系なども構築されており、今後ジェネティクス技術を用いた機能解析の研究も増えていくことが期待される。これらの中から将来、バイオテクノロジーに有用な「裏技酵素」が発見される可能性はかなり高いのではないだろうか。
4-2 超好熱古細菌ウイルスの応用研究の一例
最後に、筆者が現在携わっている酵素工学に少し関連した応用研究例を一つ紹介したい。現在、人間社会は新型コロナウイルス(SARS-CoV-2)による感染症(Covid-19)により大混乱に陥っている。これを終息させるには、特効薬の開発か、ワクチンによる集団免疫を確立させることが必須であるとされている。ワクチンは、ファイザー社やモデルナ社による新しいワクチン技法であるmRNAワクチンが、いち早く導入されている。一方でこのmRNAワクチンは、超低温冷凍庫が必要なように、厳密な保管・輸送体制が求められるという問題点も呈している。
より古典的なワクチン生産法として、無害なウイルスを用いたウイルスベクター法が挙げられる。ウイルスベクター法に用いられる代表的なウイルスには、アデノウイルス (宿主:チンパンジー細胞) やバキュロウイルス (宿主:昆虫細胞) などがある。どちらも長らく研究されてきたことにより、効率的な開発系が既に構築されている。しかし、これらのウイルスは、常温~体温程度の温度で培養するため、雑菌の混入 (コンタミ) には脆弱である。特に工業規模での培養を行う際は、厳密に管理された大規模滅菌培養システムを必要とするため、どこでも誰でも簡単に生産することはできない。
現在筆者が取り組んでいるのは、超好熱古細菌ウイルスを用いた新たなウイルスベクター系の開発である。実用化するには技術的な障壁がまだまだ大きいが、最大の利点として、培養温度が90℃のためにコンタミの影響を一切受けないことである。そのため、例えば発展途上国などを含めた大規模滅菌培養設備の整わない環境でも、原理的にはワクチン用の抗原の生産が可能である。
4-3 おわりに
最初にも述べた通り、古細菌ウイルスの研究例は、他の生物群と比較すると大きく水をあけられている。これはひとえに携わる研究者の数が著しく少ないためである。現在、日本で古細菌ウイルスをメインに研究しているのは筆者のみである。世界でも、古細菌ウイルスを主テーマとする研究室は10カ所にも満たない。しかし序盤でも述べた通り、細菌ウイルスにおいては分類学上の新奇性の高い新科ウイルスは近年ではほとんど発見されていない反面、古細菌ウイルスではほぼ毎年、新科が設立されているほど業界全体をあげての新たな面白いウイルスのハンティングは盛んである16)。
これは筆者の偏った見方ではあるが、これほどまでに面白い微生物はいないと思っている。感染症を心配する必要は皆無で、滅菌操作などを含め多少雑に扱ってもビクともせず、各地に温泉が豊富な日本では簡単に研究ができ、高頻度で完全に未知のウイルスが発見でき、ほとんどの酵素が機能未知で、応用研究への展開の可能性も高く、生命の起源の研究にも繋がる。筆者自身は大学の学部4回生の4月にこの研究テーマと出会い、以来15年以上にわたり一度も方向転換することなく、当時のワクワク感をそのままに研究を続けている。新たなウイルスを発見するたび、電子顕微鏡でそれまで見たことのない形状のウイルスを見つけるたびに、新たなゲノム配列がアッセンブルされるたびに、昆虫採集に熱中している夏休みの小学生のような興奮を覚えている。「デカいクワガタつかまえたー」「レア・ポケモン ゲットだぜー」と同じ興奮度で「レア・ウイルス ゲットだぜー」をやっているのである。
今後は、酵素工学的側面に関心のある研究者との共同研究を、是非とも行いたいと思っている。来るべきその日に、より多くのウイルスコレクションを提示するためにも、私はこれからも採水器を片手に各地の温泉を廻っていようと思う。
謝辞
本トピックで紹介した筆者の一部の研究成果は、JSPS科研費 (17H05229 、17H05811、19H04827、18K14372)、JST J-RAPID (JPMJJR2005)、住友財団 基礎科学研究助成 (200673) によって得られたものである。本記事に利用したデータの一部は、東京工業大学オープンファシリティーセンター分析部門の協力により得られている。また筆者の研究は、全国の温泉施設の厚意により支えられている。ここに御礼申し上げる。さらに、私がこの分野に進む機会を与えて下さった左子芳彦名誉教授、四半世紀にわたり当該分野を牽引し、私の博士課程における指導教官であったDavid Prangishvili教授、Patrick Forterre教授の3名にも心より御礼申し上げる。
文献
1) Woese, C. R., Fox, G. E.: Proc. Natl. Acad. Sci. USA, 74, 5088 (1977).
2) Woese, C. R., Kandler, O., Wheelis, M. L.: Proc. Natl. Acad. Sci. USA, 87, 4576 (1990).
3) Ackermann, H. W., Prangishvili, D.: Arch. Virol., 157, 1843 (2012).
4) Yu, M. X., Slater, M. R., Ackermann, H. W.: Arch. Virol., 151, 663 (2006).
5) Palm, P., Schleper, C., Grampp, B., Yeats, S., McWilliam, P., Reiter, W. D., Zillig, W.: Virol., 185, 242 (1991).
6) Bath, C., Dyall-Smith, M. L.: J. Virol., 72, 9392 (1998).
7) Kim, J. G., Kim, S. J., Cvirkaite-Krupovic, V., Yu, W. J., Gwak, J. H., López-Pérez, M., Rodriguez-Valera, F., Krupovic, M., Cho, J. C., Rhee, S. K.: Proc. Natl. Acad. Sci. USA, 116, 15645 (2019).
8) Häring, M., Vestergaard, G., Rachel, R., Chen, L., Garrett, R. A., Prangishvili, D.: Nature, 436, 1101 (2005).
9) Erdmann, S., Garrett, R. A.: Methods Mol. Biol., 1311, 223 (2015).
10) Mochizuki, T., Sako, Y., Prangishvili, D.: J. Bacteriol., 193, 5412 (2011).
11) Krupovic, M., Dolja, V. V., Koonin, E. V.: Nat. Rev. Microbiol., 18, 661 (2020).
12) Häring, M., Rachel, R., Peng, X., Garrett, R. A., Prangishvili, D.: J. Virol., 79, 9904 (2005).
13) Baquero, D. P., Contursi, O., Piochi, M., Bartolucci, S., Liu, Y., Cvirkaite-Krupovic, V., Prangishvili, D., Krupovic, M.: ISME J., 14, 1821 (2020).
14) Mochizuki, T., Krupovic, M., Pehau-Arnaudet, G., Sako, Y., Forterre, P., Prangishvili, D.: Proc. Natl. Acad. Sci. USA, 109, 13386 (2012).
15) Prangishvili, D., Forterre, P., Garrett, R. A.: Nat. Rev. Microbiol., 4, 837 (2006).
16) Prangishvili, D., Bamford, D. H., Forterre, P., Iranzo, J., Koonin, E. V., Krupovic, M.: Nat. Rev. Microbiol., 15, 724 (2017).
17) Torsvik, T., Dundas, I.: Nature, 248, 680 (1974).
18) Meile, L., Jenal, U., Studer, D., Jordan, M., Leisinger, T.: Arch. Microbiol., 152, 105 (1989).
19) Pietilä, M. K., Roine, E., Paulin, L., Kalkkinen, N., Bamford, D. H.: Mol. Microbiol., 72, 307 (2009).
20) Pawlowski, A., Rissanen, I., Bamford, J. K., Krupovic, M., Jalasvuori, M.: Arch. Virol., 159, 1541 (2014).
21) Prangishvili, D., Garrett, R. A., Koonin, E. V.: Virus. Res., 117, 52 (2006).
22) Gilbert, W.: Nature, 319, 618 (1986).
23) Takai, K., Nakamura, K., Toki, T., Tsunogai, U., Miyazaki, M., Miyazaki, J., Hirayama, H., Nakagawa, S., Nunoura, T., Horikoshi, K.: Proc. Natl. Acad. Sci. USA, 105, 10949 (2008).
24) Bolduc, B., Shaughnessy, D. P., Wolf, Y. I., Koonin, E. V., Roberto, F. F., Young, M.: J. Virol., 86, 5562 (2012).
25) Rice, G., Tang, L., Stedman, K., Roberto, F., Spuhler, J., Gillitzer, E., Johnson, J. E., Douglas, T., Young, M.: Proc. Natl. Acad. Sci. USA, 101, 7716 (2004).
26) Thiroux, S., Dupont, S., Nesbø, C. L., Bienvenu, N., Krupovic, M., L'Haridon, S., Marie, D., Forterre, P., Godfroy, A., Geslin, C.: Environ. Microbiol., doi:10.1111/1462-2920.15271 (2020).