【トピックス】
Ferulic acid decarboxylase の合理的設計による人工代謝経路の構築
森裕太郎、白井智量
理化学研究所・環境資源科学研究センター
1.はじめに
現在、化石資源の枯渇問題や気候変動などの環境問題に対応するために、持続可能社会の実現に向けた取り組みが全世界で行われている。大気中に含まれる温室効果ガスである二酸化炭素の量が、ここ10年の平均で年に51億炭素トンのペースで増加しており、産業革命以前からの地球の平均表面温度上昇を1.5℃以内に抑え、自然と人間のシステムに及ぶリスクを回避するために、社会のあらゆる側面においてこれまでに前例のない移行が必要となっている1)。そうした中で、食糧問題と競合しない再生可能な非食糧バイオマスから、あるいは直接的に二酸化炭素から、これまで化石資源から作られてきた化学物質や材料を生産することに大きな関心が寄せられている。
このバイオリファイナリーの分野においては、微生物を物質生産工場として捉え、再生可能資源を炭素源として目的化合物を生産する検討が多く行われてきた2,3)。近年では、合成生物学や代謝工学技術の進展に伴って、「これまで微生物によって生産されてきた既知の化合物の生産効率と生産量を向上させる」だけでなく、「これまでに生産が達成されていなかった新規の有用化合物を微生物で作る」ことが可能になってきている。化石資源由来の化合物空間に対して、生合成可能な化合物空間はその全てを網羅するには至っていないことから、特に後者の研究が求められている。ここで重要となるのが、目的の非天然化合物の生産を行うための代謝経路の設計 (=酵素触媒反応の選定) と、その人工代謝反応を触媒する酵素の開発である。
本稿においては、非天然化合物である1,3-ブタジエンを目的化合物とし、選択した酵素の基質特異性を合理的に改変することによって、炭素源であるグルコースから直接1,3-ブタジエンを生産可能な新規人工代謝経路の構築に成功した最新の研究成果について紹介する。
2.1,3-ブタジエン生成のための新規人工代謝経路の設計
2-1 研究背景
微生物を用いた物質生産の目的化合物として、ポリマー原料としての利用が可能な、二重結合を持つ有機化合物の需要が高まっている。1,3-ブタジエンは最も単純な構造を持つ炭素数4の共役ジエンであり、スチレン・ブタジエンゴム (SBR) などの合成ゴム、アクリロニトリル・ブタジエン・スチレン樹脂 (ABS樹脂) などの主原料であり、非常に重要な工業原料である。従来、1,3-ブタジエンは、ナフサクラッキングによるエチレン製造時の副生C4留分を原料として、全生産量の98%が製造されており、バイオリファイナリー社会を構築する上では、石油に依存しないバイオベースの1,3-ブタジエンへの転換が求められていた。
上記のような背景から、近年、バイオベースの1,3-ブタジエン生産に関する研究は活発化してきている。これまでに、前駆体化合物としてブタンジオールなどを微生物発酵により生産し、蒸留・精製を行った後、化学触媒によって前駆体化合物を脱水することで、バイオベース1,3-ブタジエンの生成が達成されている4)。一方、1,3-ブタジエンは常温で気体であることから、微生物で直接生産することが出来れば、発酵生産と同時に培養ガス中から回収できる1stepプロセスが可能である。しかしながら、自然界において1,3-ブタジエンを生合成する代謝経路は未だ発見されておらず、バイオプロセスのみを用いたグルコースからの1,3-ブタジエン直接生産はこれまで達成されていなかった。
2-2 人工代謝経路設計ツールBioProV
近年、次世代シークエンシング技術の発展に従って、様々な生物のゲノム全体の配列だけでなく、非培養生物を含む環境DNAサンプル (メタゲノム) からも情報が得られるようになり、新規に有用で可能性のある酵素の情報蓄積が進んでいる。それに伴い、KEGGやBRENDA、MetaCycなどの各種データベースには、本稿執筆時点で16,986の生体内代謝反応、16,861種の生体内化合物、そして12,992種もの酵素が登録されている。これら莫大な情報の中から如何にして関連情報を抽出し、目的の化合物に応じた代謝経路を設計するのか、また如何にして使用する酵素反応と反応前駆体の決定を行うかが重要な技術開発要素となってきている。1,3-ブタジエンの人工代謝経路に関しては、これまでに既存の人工代謝経路設計ツールを用いることで、生体内化合物であるクロトニル-CoA、エリスロ-4-リン酸、マロニル-CoAから始まる3つの異なる1,3-ブタジエン生成経路が提案されているものの、生物学的プラットフォームを用いた1,3-ブタジエン合成に成功した例は報告されていない。
上記、既存の設計ツールに存在する大きな制限の一つは、基本的に経由する化合物の構造が天然に存在する生体内化合物に縛られるということであり、目的化合物生産のための反応経路や使用することのできる酵素もまた限られてしまっていた。そのような問題を解決するために、著者らは独自の人工代謝経路設計ツールBioProVを開発した (図1a)。このBioProVの概要としては、1) KEGGデータベース上の個々の基質特性を持つ酵素という概念を除外し、各反応のみに着目し、化学反応パターンはSMIRKSで、前駆体と生成物をSMILESで記述してコンピューターに酵素反応パターンを学習させた。2) そして目的化合物を入力すると、反応パターンに沿って前駆体をさかのぼり、ランダムかつ網羅的なシミュレーションを行う。3) 最終的に既知の生体内化合物まで到達すれば、シミュレーションが成功であり、つまりその既知の生体化合物を出発物質として、設計された人工代謝反応を実現することができれば、目的化合物の生合成が達成される。このBioProVの大きな特徴としては、通常生体内には存在しない非天然化合物を経由した人工代謝経路も設計することが可能ということである。このBioProVを用いて1,3-ブタジエンを生産するための人工代謝経路の設計を行ったところ、cis,cis-ムコン酸 (ccMA)を出発化合物として2段階の脱炭酸反応を経て1,3-ブタジエンを生成する経路が提案された (図1b)。ccMAは微生物による安息香酸等の芳香族化合物の分解経路に位置する化合物として、古くから知られている炭素数6の共役ジエンを有する不飽和カルボン酸であり、グルコースから複数の経路での生産が報告されている2)。この人工経路における反応中間体である2,4-ペンタジエン酸 (PA)は生体内には存在しない非天然化合物であり、BioProVを用いて初めてこの新規1,3-ブタジエン生成人工代謝経路が設計されたことが分かる。よってこの人工代謝経路を生体内で実現するため、次にccMAの脱炭酸反応を実際に触媒する酵素の検討を行うこととなった。
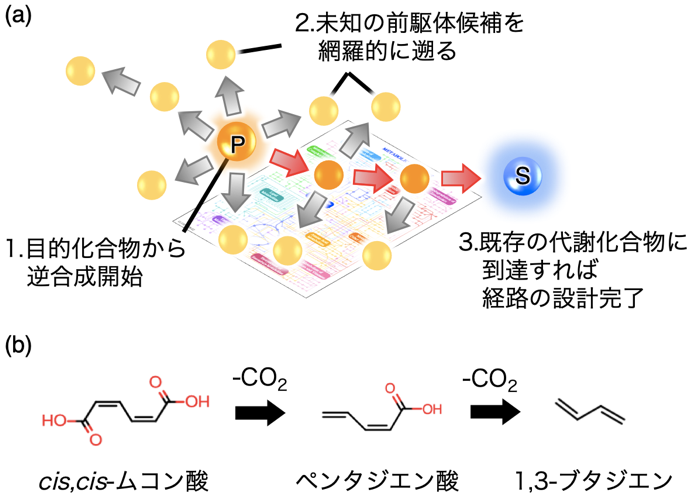
![]()
2-3 Ferulic acid decarboxylase (FDC) についての新発見
そんな折、2015年にフェルラ酸脱炭酸酵素であるFDCについての大きな発見が報告された5)。FDCは、フェルラ酸や桂皮酸などの芳香族不飽和カルボン酸R-C=C-COOHの側鎖末端を脱炭酸し、R-C=Cへと変換する酵素であり、FDCを用いたスチレン生産など古くから研究が行われてきた。このFDCによる脱炭酸反応には共役系に基づく電子移動が伴うとされ、これまでFDCが脱炭酸可能な基質は芳香環を持つ化合物だけであると考えられてきた。しかし、Aspergillus nigerやSaccharomyces cerevisiae由来のFDCが、フラビンモノヌクレオチド (FMN) がプレニル化されたprFMNを補酵素として持つことが明らかになった。prFMNは、prenyl transferaseと新たに名付けられたubiXやpad1相同体によって、ジメチルアリルリン酸 (DMAP) とFMNから合成される。このprFMNを持つFDCは、二重結合の横に位置するCOOH基を脱炭酸することが可能であり、FDCを始めとしてprFMNを持つUbiD相同体の酵素に関する研究が盛んに進められている6)。このprFMNが触媒する脱炭酸反応によって、prFMNを持つFDCは様々な置換基のついた芳香族化合物だけでなく、芳香環を持たない不飽和カルボン酸も脱炭酸反応により末端アルケンへと変換することが可能なことが報告された。この他、脱炭酸反応機構や、一度活性型となったprFMNは光によって不活性型となり脱炭酸触媒機能を喪失してしまうこと7)、一部のpad1はDMAPだけでなく、ジメチルアリル二リン酸を使ってprFMNを形成できること8)など、現在進行系でFDC周りの基礎情報が解明されつつある。今回設計した1,3-ブタジエン生成のための人工代謝経路における出発化合物ccMAは、FDC反応モチーフR-C=C-COOHが2つ連結した構造である。よってFDCを鋳型酵素として基質特異性を改変し、ccMAを基質として、2回の脱炭酸により1,3-ブタジエン生成を可能とするFDC変異体の開発を行った。
3. FDCの基質特異性改変による1,3-ブタジエン生成酵素の開発
3-1 目的に応じた酵素変異体の合理的設計
自然界において生物は、必要とする生体内化学変換を触媒する酵素を獲得することで多様な環境の中で生存するために、驚くほど多くの酵素を進化させてきた。その一方で、目的とする化合物を生成するために、我々が必要としている様々な化学反応を触媒する酵素の多くは、天然ではあまり存在しておらず、またそのような酵素があったとしても、熱耐性、酵素活性、基質特異性などの酵素機能が必要値に満たないことがある。そのような場合、目的の機能を持つ酵素を開発するためにタンパク質工学は大いに貢献する。近年の情報工学の発展により、in silicoにおいてタンパク質構造モデルの構築や酵素-基質結合モデルのドッキングシミュレーションが可能になってきたことから、目的とする生成物および反応前駆体に合わせて、ピンポイントにアミノ酸変異導入を行う、コンピューターを用いた合理的な酵素デザインのアプローチに強い関心が寄せられている。このコンピュータエイドな戦略によって、基質特異性を改変し、非天然の化合物への活性向上を行った研究が実際に多数報告されており、この目的の機能を持つ酵素変異体を、酵素と基質の種類を問わず設計可能な合理的アルゴリズムの開発は、多くの研究室で取り組まれている9)。本稿においても、FDCの基質特異性を改変しccMAを基質として1,3-ブタジエンへと変換させるため、FDC変異体のin silicoデザインを試みた。
3-2 FDC変異体の開発
酵素変異体を開発するにあたり、まず知見が豊富で、結晶構造も報告されているA. niger由来FDC (AnFDC) を選択した。AnFDCの基質結合部位を観察したところ、天然の基質であるalpha-メチルケイヒ酸の最安定化配座において、R173の主鎖及び側鎖が天然の基質であるケイヒ酸の反応性カルボキシル基αと水素結合を形成しており、その近傍には活性中心残基であるE282が位置している (図2)。そして芳香環の周辺には、疎水性アミノ酸残基がクラスター化しており、これにより結合安定化と基質認識を行っている様子が観察された。次に、ccMAをリガンドとしてドッキングシミュレーションを行うことで共結晶構造モデルを構築した。その結果、alpha-メチルケイヒ酸と比べてccMAは基質結合ポケット入り口側に位置し、奥に空隙ができる様子が見られた。そこで著者らは、脱炭酸反応が行われるccMAの反応性カルボキシル基αとAnFDCとの相互作用を維持しながら、その反対側のカルボキシル基βを補足して基質が安定化できるように、AnFDCの基質結合部位を設計することによって、ccMAの脱炭酸反応が達成できるのではという仮設を立てた。そこで我々は、酵素-基質複合体を基質結合と触媒に関連する相互作用に分解し、反応メカニズムに基づく基質の立体配座とエネルギー計算のため統合シミュレーションソフトMOEを用いて、ccMAの基質結合部位を計算で最適化・安定化することとした。まず基盤となる変異体情報の収集のために、AnFDCの疎水性クラスターを形成しているアミノ酸残基について、変異を導入した一残基変異体モデルを構築し、ccMAとのドッキングシミュレーションを行って変異導入前後での親和力変化を計算した。次に、安定化度合いでランク付けを行い、親和力の向上順に24変異体を選択し、実際に変異体の作成を行った。そしてEscherichia coliをタンパク質発現用の宿主として選択し、AnFDC変異体とE. coli由来prenyl transferaseであるUbiXを共発現させることで、prFMNの形成と、holo-AnFDCの構築を狙った。AnFDCの活性測定のため密閉したバイアル中で基質としてccMAを供し、HS-GC/MSを用いてバイアル内の気相の分析を行った結果、驚くべきことに野生型AnFDCについて1,3-ブタジエンの生成が確認され、野生型AnFDCはccMAを基質として認識できるということが明らかとなった。これはつまり、AnFDCはccMAと、その一段階目の反応の生成物PAの両方に対して脱炭酸反応を触媒できるということである。次に、作成した24変異体について同様に活性測定を行ったところ、いくつかの変異体において1,3-ブタジエン生産能力の向上が見られ、特にT395Q変異体について、野生型と比較して最大で109倍の比活性という顕著な活性の向上が確認された。こちらについてAnFDC変異体-ccMA複合体モデルを確認したところ、Y394と導入したT395Qが、ccMAのカルボキシル基βと相互作用している様子が確認され、よってこの親和力向上によって、効率的な基質との結合が行われたものと思われた (図3)。
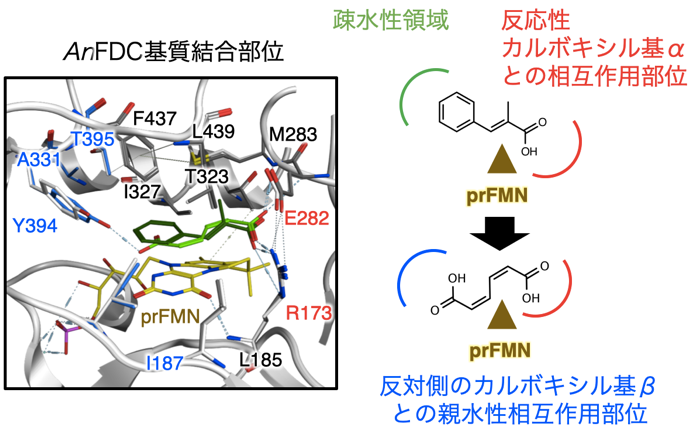
図2 AnFDC基質結合部位 (4ZA7) と1,3-ブタジエン生成酵素の設計
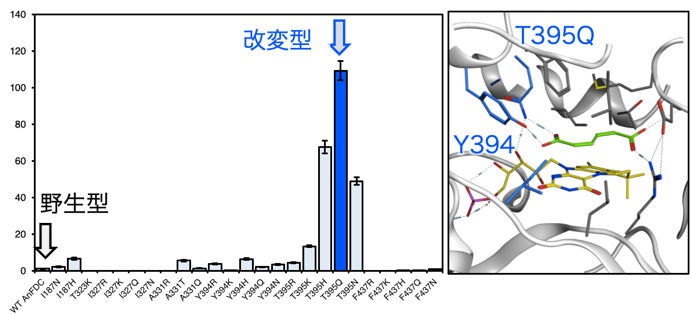
図3 AnFDC変異体を用いた1,3-ブタジエン生成活性測定結果とAnFDC T395変異体-ccMA複合体モデル
次に、この一残基変異体の変異体モデル情報と1,3-ブタジエン生成能力を基盤情報として、AnFDC多重変異体の構築を試みた。これら情報を変異空間にフィードバックし、より高性能な多重変異体の開発を行うにあたって、独自の判定ルールを設けスコアリングを行った。その結果を基に最大で四重変異体までの120変異体を選択・実際に構築し、1,3-ブタジエン生成能力の評価を行った。その結果、複数の変異体において1,3-ブタジエン生成能力の向上が見られ、Y394H:T395Q変異体について最大で野生型の1,003倍の活性向上を達成した。Y394H:T395Q変異体-ccMA結合モデルを観察したところ、導入した2つのアミノ酸残基がccMAのカルボキシル基βと相互作用している様子が確認された。これより、基質であるccMAに合わせた合理的なAnFDC変異体の設計によって、少ない変異体作成数で目的とする1,3-ブタジエン生成酵素の開発を達成した。また今回開発したccMAを効率的に脱炭酸するための酵素デザインをS. cerevisiae由来FDC (ScFDC) に適用して、応用可能性の検討を行った。基質ポケット周辺のアミノ酸残基を眺めるとAnFDCとScFDCは非常によく似通っておりA331:Y394:T395に相当する箇所が、V334:F397:I398となっている。野生型のScFDCについて活性測定を行ったところ同様の1,3-ブタジエン生成が見られ、更にScFDCF397H:I395Q変異体は基となったAnFDC Y394H:T395Q変異体よりも優れた1,3-ブタジエン生成能力を示した。これより、ある鋳型酵素で得られた望ましい変異体の設計を、より活性の高い酵素へと移し替えることで、さらなる酵素機能の強化を達成できる可能性を示した。
3-3 グルコースからの1,3-ブタジエン直接生産
開発した1,3-ブタジエン生成酵素ScFDC F397H:I395QおよびprFMN形成のために必要なUbiXを、代謝改変により生産能力の強化を行ったムコン酸生産大腸菌に導入することで、グルコースからの1,3-ブタジエンの直接生産を試みた結果、培養開始48時間後において、41 mg/Lの1,3-ブタジエンの生産を達成した。これはグルコースからの1,3-ブタジエンの直接生産を達成した世界で初めての成功例である。13Cグルコースを用いて同様の培養を行ったところ、[13C4]1,3-ブタジエンの割合が95%以上であったことから、確かにグルコースを炭素源とした1,3-ブタジエン人工代謝経路の構築を達成したことを確認した。
最後に、1,3-ブタジエンの生産量を向上させるために、1Lジャーファーメンターを用いた培養を行った (図4)。培養条件について検討を行った結果、培養時の溶存酸素量 (DO) とpHが1,3-ブタジエンの生産量に大きく影響することが明らかとなった。今回設計した1,3-ブタジエン生産経路においては、経路前半においてFDCの基質であるccMAを生産するために酸素が必要であり、好気条件下での培養が望ましい。次に、FDCが脱炭酸反応を行うために必要な補酵素prFMNは、FDCに取り込まれる前に酸素による酸化を受けると不活性型となってしまうため脱炭酸能力を示さなくなる一方で、FDCに取り込まれた後の酸素酸化がなければ活性化しないため10)、経路後半においては完全な嫌気状態ではccMAからの1,3-ブタジエンの生成を行うことができない。よって、培養開始後18時間において、好気から微好気へとDO条件を切り替える2段階培養を行った。pHに関しては、生成した基質であるccMAおよびPAは培地中へと放出されてしまうため、培養時に低pHを維持することにより培地中からの基質取り込みの促進を狙った。最終的にpHを制御しつつDO条件を培養途中で変更する、DOstatによる流加培養を行うことにより、反応中間体であるccMAやPAは培養液中に残存しているものの、培養開始96時間後においてグルコースからの2.1 g/Lの1,3-ブタジエンの生産を達成した11)。
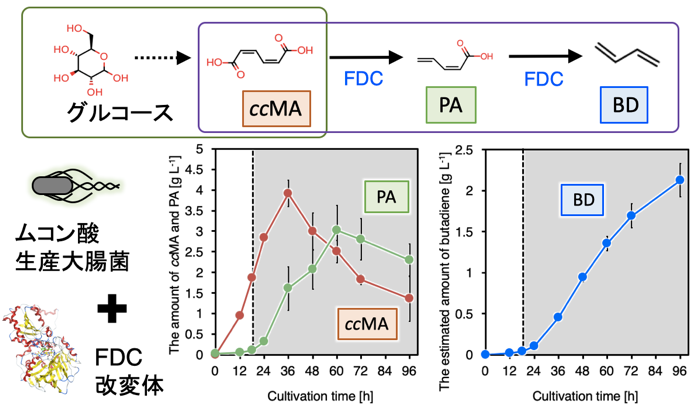
図4 1,3-ブタジエン生産大腸菌のDO-stat流加培養
4.おわりに
本稿では、現在の再生可能資源からの非天然化合物生産についての取り組みを紹介するとともに、実際に非天然化合物である1,3-ブタジエンの生産を目的として人工代謝経路を設計し、コンピューターシミュレーションに基づく合理的設計により、ccMAの脱炭酸反応を触媒する酵素開発を行った。現在は本稿で紹介した合理的改変設計アルゴリズムを、全く他の反応を触媒する酵素に応用し、汎用性を検討するとともに情報蓄積を行っているところである。今後、本研究のように非天然化合物生産に向けた酵素変異体開発と培養試験の更なる発展により、これまで石油からしか作られていなかった化合物が、一つ一つ再生可能資源から直接的に生産できるようになることで、真のサーキュラーバイオエコノミー社会の実現が近づくであろう。
文献
1) Hoegh-Guldberg, O., Jacob, D., Taylor, M., Guillén, Bolaños, T., Bindi, M., Brown, S., Camilloni, I. A., Diedhiou, A., Djalante, R., Ebi, K., Engelbrecht, F., Guiot, J., Hijioka, Y., Mehrotra, S., Hope, C. W., Payne, A. J., Pörtner, H.-O., Seneviratne, S. I., Thomas, A., Warren, R., Zhou, G.: Science, 365, eaaw6974 (2019).
2) Noda, S., Kondo, A.: Trends Biotechnol., 35, 785 (2017).
3) Matsumoto, T., Tanaka, T., Kondo, A.: Bioresour. Technol., 245, 1362 (2017).
4) Sun, D., Li, Y., Yang, C., Su, Y., Yamada, Y., Sato., S.: Fuel Process. Technol., 197, 106193 (2020).
5) Payne, K. A., White, M. D., Fisher, K., Khara, B., Bailey, S. S., Parker, D., Rattray, N. J., Trivedi, D. K., Goodacre, R., Beveridge, R., Barran, P., Rigby, S. E., Scrutton, N. S., Hay, S., Leys, D.: Nature, 522, 497 (2015).
6) Leys, D.: Curr. Opin. Chem. Biol., 47, 117 (2018).
7) Bailey, S. S., Payne, K. A. P., Fisher, K., Marshall, S. A., Cliff, M. J., Spiess, R., Parker, D. A., Rigby, S. E., Leys, D.: J. Biol. Chem., 293, 2272 (2018).
8) Arunrattanamook, N., Marsh, E. N. G.: Biochemistry, 57, 696 (2018).
9) Welborn, V. V., Headgordon, T.: Chem. Rev., 119, 6613 (2019).
10) Balaikaite, A., Chisanga, M., Fisher, K., Heyes, D. J., Spiess, R., Leys, D.: ACS Chem. Biol., 15, 2466 (2020).
11) Mori, Y., Noda, S., Shirai, T., Kondo, A.: Nat. Commun., in press.