【トピックス】
接着タンパク質・接着微生物を利用した効率的バイオプロセスの構築
石川聖人、堀 克敏
名大院・工/阪大・太陽エネ化/JST・さきがけ、名大院・工
1.はじめに
菅義偉総理大臣は10月26日に招集された臨時国会における所信表明演説で、脱炭素社会に向けて2050年までに温室効果ガスの排出を全体としてゼロにすると表明した。株式市場では脱炭素に積極的に取り組む企業とそうでない企業では時価総額に差が出るようになったとの報道もされた。脱炭素社会の実現に向けて二酸化炭素の排出量を削減することはもはや、“大企業・先進国としての責務”ではなく、“大企業・先進国として生存するための戦略”となったといえよう。本稿の読者の皆様はご承知の通り、酵素を触媒とする物質生産・物質変換は常温・常圧下で実施できるため、化学触媒を用いるよりも省エネルギー化できる。これまで化学工業プロセスで生産されてきた製品がバイオプロセスによって生産されるようになれば、脱炭素社会の実現に大いに貢献すると期待される。しかし、タンパク質である酵素は化学触媒と比べて脆弱で、製造コストが高いこともあり、化学工業プロセスからバイオプロセスへの転換は容易ではない。
微生物の細胞自体を触媒として用いる“全細胞触媒”は、細胞から分離して用いられる酵素よりも安定性が高いことに加え、細胞内に含まれる複数の酵素によって多段階のカスケード反応を進行させることができる。酵素を細胞から分離精製する手間がないため、製造コストも低く抑えられる。とはいえ、化学触媒よりも脆弱で高価であることは変わりなく、全細胞触媒はできる限り長期間安定で繰り返し利用できることが望ましい。こうした理由から、微生物の固定化はバイオプロセスの構築において古くから実施されてきた。固体表面に微生物を固定、もしくは高分子ゲルなどに微生物を包括すると、熱・pH・阻害物等に対する耐性が向上することが知られている。加えて、固定化された微生物は生産物との分離を容易にし、繰り返し利用することや、連続反応プロセスに適用することを可能とする。しかし一方で、固定化に伴う微生物の活性低下や、固定化工程におけるコストの発生、固定化担体表面または内部における物質輸送律速による反応速度の低下などのデメリットがある。特に、物質輸送律速については省エネルギー化の観点からは注意しなくてはならない。基質や酸素等の物質輸送を高めるために激しい撹拌や曝気操作を行うと、バイオプロセスであっても省エネルギーとはいえなくなる。我々はこれらのことを考慮しながら、真の意味で省エネルギーかつ効率的なバイオプロセスの構築に向けた研究を行ってきた。本稿では独自に開拓してきた接着タンパク質AtaAと接着微生物を利用したバイオプロセス構築について解説する。
2.接着ナノファイバータンパク質AtaA
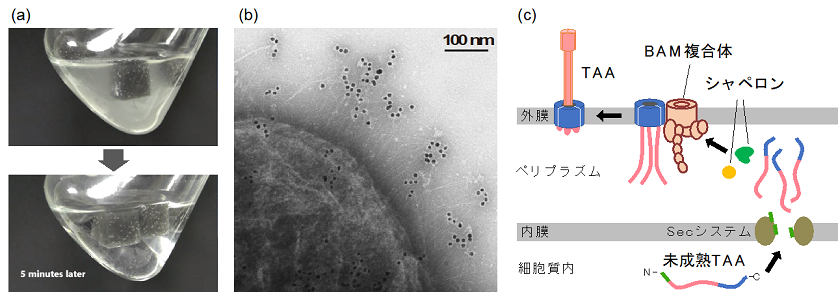
排ガスリアクターより単離されたトルエン分解細菌Acinetobacter sp. Tol 5は、固体表面に対して驚異的な付着性を示す1,2)。微生物が固体表面に付着している状況としてはバイオフィルムがよく知られているが、Tol 5の付着特性はバイオフィルム形成と明確に区別できる。バイオフィルムは、微生物細胞が増殖しながら細胞外多糖類を分泌することで細胞を固体表面に繋ぎ止め、時間をかけて形成される。一方、Tol 5は炭素源・窒素源の含まれない、増殖のできない無機塩培地中であっても、固体表面へ迅速に付着する2)。例えば、細胞懸濁液にスポンジ担体を入れて撹拌すると、ものの数分でほとんど全ての細胞が担体に付着する (図1a)。表面としては材質を選ばず、疎水的なプラスチックから親水的なガラス、金属表面にまで付着する。
我々は、Tol 5の極めて珍しい付着特性が細胞表層に局在するナノファイバータンパク質AtaAに起因することを順遺伝学的手法により明らかにした (図1b)3)。AtaAは、配列類似性から三量体型オートトランスポーターアドヘシン (TAA)4)ファミリーに分類され、ひとつの遺伝子にコードされるポリペプチドがホモ三量体のファイバーを形成する (図1c)。TAAは自身のカルボキシル (C) 末端がグラム陰性菌外膜中にβバレル構造の膜貫通 (TM) 部位を形成し、バレルのポアを通ってアミノ (N) 末端側のナノファイバー形成部が細胞外に分泌される。その名の通り、TAAは自己分泌すると考えられていたが、この十数年間で見直され、いくつかのペリプラズムシャペロンやβバレルアッセンブリーマシナリー (BAM) 複合体の補助を受けて分泌することが明らかになった5,6)。AtaAは3630アミノ酸残基から構成され、報告されているTAAの中でも最大の部類に入る。C末のTM部位は他のTAAとの配列類似性は高いが、ファイバー形成部には複数ドメインの繰り返し構造があるなどユニークな点が多い。ataA遺伝子を欠損するとTol 5の付着性は大きく損なわれることが逆遺伝学的解析によって確かめられた。また、付着性の低い同属細菌であるA. baylyi ADP1にataA遺伝子を導入したところ、細胞表層におけるAtaAファイバーの形成と付着性の劇的な向上が認められた。これらの結果は、ataAはTol 5の付着表現型に最も重要な遺伝子であること、ataA遺伝子の単独導入によって非付着性細菌にもTol 5と同様の付着特性を付与できることを示している。

3.AtaAを利用した微生物触媒の固定化
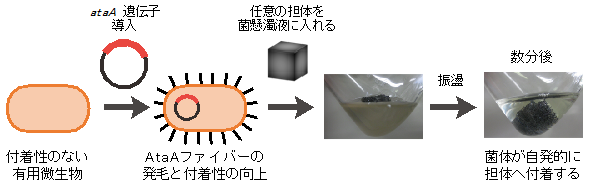
ataA遺伝子を導入すれば他の細菌の細胞表層にもAtaAファイバーを生やすことができ、元来付着性を持たない菌も固体表面に対して付着できるようになることから、AtaAを利用した新規の微生物固定化法を着想した。図2にその手順を示す。(1) 付着性の低い有用微生物にataA遺伝子を導入する。(2) 微生物はAtaAファイバーを細胞表層に生やすことでTol 5と同様の付着表現型となる。(3) 付着性の向上した菌の細胞懸濁液に任意の担体を入れ、数分間振盪すると菌体は自発的に固定される。本方法によって固定化された微生物触媒の有用性は、同属細菌のADP1とST-550、異属細菌のEnterobacter aerogenesによって実証している7-9)。固定化されたADP1とE. aerogenesはエステラーゼ反応と水素生産に繰り返し利用することができた。固定化ST-550をインドール/インディゴ変換反応に供したところ、興味深いことに、浮遊状態のST-550よりも生産性が向上するという結果が得られた。AtaAを介して固定化されたST-550は毒性基質であるインドールに対する耐性が向上したことで、浮遊状態のST-550よりも多くのインディゴを生産できたと考えている。バイオフィルム中の微生物は浮遊状態とは異なる生理状態となり、抗生物質や有機溶媒への耐性が向上することが知られている。これはAtaAによって固定化された状態と懸濁状態における遺伝子発現が異なることで、生理状態が変化したことを示唆しており、AtaAを介した固定化法は微生物にバイオフィルムと同様の安定化効果をもたらす可能性がある。
4.固定化人工細胞触媒
上ではAtaAによって微生物を固定化し触媒利用した例を紹介した。これらに加えて我々は、触媒利用可能な“人工細胞”の固定化にAtaAを適用することに成功した10)。ここで意味するところの人工細胞とは生体機能の一部を模倣した人工の膜小胞のことである。近年、酵素・核酸等の生体高分子・合成化合物・マイクロデバイスを組合せてボトムアップで人工細胞を創る研究が活発化している11)。このような取り組みはボトムアップ生物学と呼ばれ、複雑過ぎて解釈困難な生物機能を理解するための研究アプローチとしてだけでなく、新たなバイオテクノロジー開発の源泉としても関心が高い。人工細胞の作成に最も汎用されている材料はリポソームである。これまで様々な生物機能の一部を発揮するリポソームが作られているが、特に、複数の酵素をリポソームに内包することでカスケード反応を可能とする人工細胞12)は触媒としての利用価値が高いと考える。このような人工細胞をAtaAによって固体表面に固定化することができれば、固定化人工細胞触媒として効率的なバイオプロセスを設計できるようになるだろう。しかし、AtaAのようなナノファイバータンパク質をリポソーム表層に生やし、細菌細胞表層の構造と機能を模倣した人工細胞は報告されていなかった。
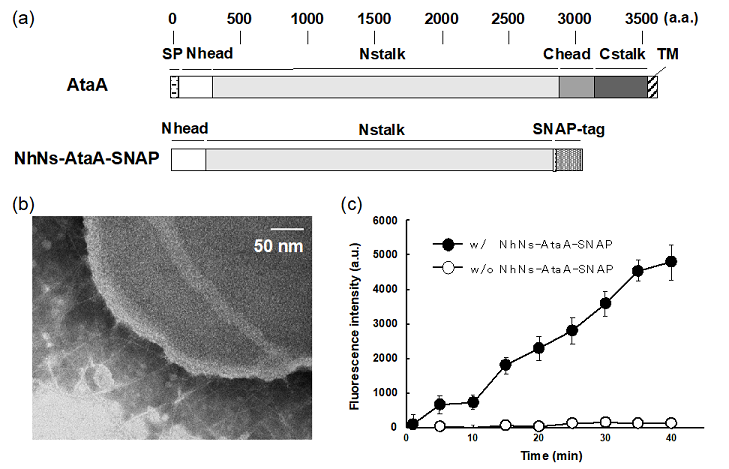
細菌の細胞表層に存在するタンパク質のほとんど全ては膜貫通部位もしくは膜結合部位を有している。一般に、これら膜タンパク質を大腸菌等で組換えタンパク質として調製することは容易でないため、細菌の細胞表層構造と機能を模倣した人工細胞が作られてこなかったと想定される。先に述べた通り、AtaAのC末端にはTM部位が存在する。ただし、この膜結合部位はAtaAファイバーの接着機能に影響しない13)。また、AtaAファイバーに柔軟性をもたらす部位であるCheadとCstalkドメインも接着機能には直接関与しないことが明らかとなっている14)。そこで我々は、AtaAの接着機能に関係しないTM、Chead、Cstalkドメインを除去し、細胞表層にファイバーとして露出するNheadおよびNstalk (NhNs) ドメインを組換えタンパク質として大腸菌の細胞質内で発現させることにした。本来はTM部位の存在する箇所にSNAPタグ15)を融合することで、ベンジルグアニン (BG) 基との共有結合が可能なように細工をした。得られる組換えタンパク質NhNs-AtaA-SNAPはBG基を有するリポソームであれば、特異的な共有結合形成によりその表層を覆うことができる。BG誘導体で修飾された脂質を用いて作成した細菌サイズリポソーム (約800 nm) とNhNs-AtaA-SNAPを反応させると、AtaAを生やした細菌細胞とそっくりのリポソームが出来上がる (図3b)。NhNs-AtaAファイバーで装飾されたリポソームは、これまで我々がAtaAファイバーを生やして固定化してきた細菌と同様に、疎水的なプラスチック表面、親水的なガラス表面、金属表面に付着することができた。この接着性人工細胞にβ-グルクロニダーゼ (GUS) をモデル酵素として内包し、固定化触媒としての実用可能性を検証した。ポリスチレン製の表面にGUS含有の接着性人工細胞を固定し、GUSの膜透過性蛍光基質を添加したところ、加水分解反応を示す蛍光強度の増加が認められた (図3c)。この結果は、接着性人工細胞が固体表面に付着したまま、内包した酵素によって化学反応を進行させられることを示している。リポソームに内包する酵素の種類や量を使用者によって調製できることが、人工細胞を固定化触媒として使用するメリットである。天然の細胞の場合、望みの生成物を最大収率で得るために遺伝子組換えを行うが、人工細胞では望まない副生成物が出ないように内包する酵素をデザインすることができる。また、人工細胞は自己複製しないため、遺伝子組換え生物の利用が制限されるような開放環境であっても利用できる点もメリットとして挙げられる。

5.気相微生物反応
気相微生物反応は、近年我々が力を入れて開発を進める革新的なバイオプロセスである。気相微生物反応では、微生物反応は水中で行うという固定概念から脱却し、懸濁媒体としての液相が存在しない反応系で微生物による物質生産・物質変換を行う。従来の液相反応系と比べて気相微生物反応には次のような利点がある。(1) 基質と酸素は気体として供給可能なため分子拡散速度を液相中の1万倍まで高めることができる、(2) 難溶解性の気体基質・酸素を水相に溶け込ませるための曝気・撹拌が不要となりプロセスの省エネルギー化ができる、(3) 水中よりも気体中の方が雑菌の繁殖リスクが低いためプロセスの長期安定化を図れる。一方で、懸濁媒体としての液相が存在しないため、気相微生物反応では微生物の固体物質への固定が必須となる。
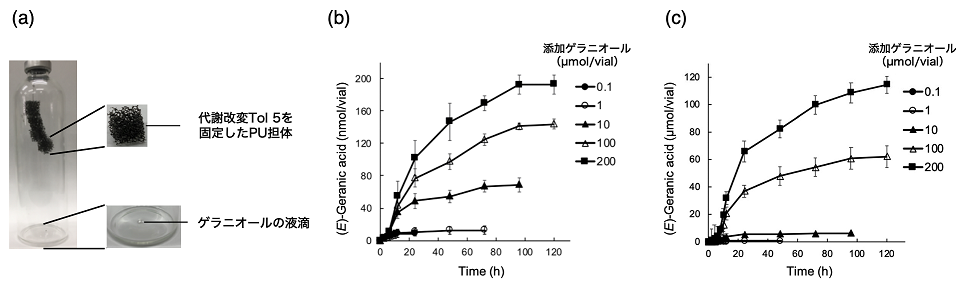
先に詳述した通り、AtaAの宿主細菌であるTol 5は非常に高い付着性を有しているため、任意の担体へ容易に固定化できる。これに加え、多様な炭化水素を代謝でき、遺伝子組換え系が確立されていることから、気相微生物反応プロセスの良いプラットフォーム微生物になると期待した。そこで我々は、市場価値は高いものの、揮発性が高く取り扱いの困難なモノテルペノイドであるトランスゲラン酸 ((E)-GA) ) をモデル化合物として、Tol 5を宿主微生物とした気相微生物反応に取り組んだ16)。(E)-GAの生産性を高めるように代謝改変したTol 5細胞をポリウレタン (PU) 担体に固定し、図4aに示すようにバイアル瓶の頭部から針金で吊るした。バイアル瓶の底部には基質となるゲラニオールの液滴を入れ、バイアルの口を密閉した。ゲラニオールの液滴とPU担体は物理的に接触しないよう十分に距離が離れている。反応器中のゲラニオールは徐々に揮発し、固定化されたTol 5に気体として受動供給される。従って、基質供給のための加熱、振盪や撹拌、加圧などの外的エネルギーをかける必要のない省エネルギーの反応系である。バイアル瓶のヘッドスペース中に気体として存在する(E)-GAを経時測定したところ、(E)-GA濃度は徐々に増加した (図4b)。(E)-GA濃度はバイアルに滴下したゲラニオール濃度に応じて増加したが、ゲラニオールからの(E)-GAへの変換率はかなり低かった (約8.3%)。反応後に系中のゲラニオールの濃度を測定すると完全に消費されていたことから、気相微生物反応で生成した(E)-GA分子のほとんどが直ちにPU担体に吸着したと考えた。AtaAを介して固定化された細胞は脱イオン水で剥離することができる17)。この方法でTol 5細胞をPU担体から剥がし、Tol 5細胞とPU担体をエタノールで処理し(E)-GAを定量したところ、PU担体からの抽出液にのみ(E)-GAが検出された。図4cは(E)-GAの吸着量の経時変化を示す。吸着(E)-GAの量は、バイアルに添加したゲラニオールの量に応じて増加し、バイアル当たり200 μmolのゲラニオールが添加されたときの変換率は約84%に達した。このように生産物(E)-GAの大部分はPU担体に吸着してしまうが、毒性の低い有機溶媒で簡便に回収できる。また、PU担体から剥がしたTol 5細胞は別の担体に再固定し、新しい反応に生産性を下げることなく、少なくとも6回は繰り返し使用することができた。そのため、省エネルギーかつ低環境負荷のバイオプロセスを構築できたといえよう。以上のように我々は、気体基質を受動的に供給し、有用モノテルペノイドを生産する気相微生物反応を世界で初めて示した。

6.おわりに
バイオプロセスの主役は反応の担い手である酵素・微生物等の生体触媒である。高い生産性を有する“スーパー生体触媒”は物質生産・物質変換の方式をゲームチェンジする可能性を秘めている。ただし、社会実装や脱炭素の実現に向けては、スーパー生体触媒の探索や開発だけでは不十分であり、それらをどのようにプロセスで利用するかについても両輪で検討していく必要がある。本稿では、接着タンパク質AtaAによって固定化した生体触媒 (微生物と人工細胞) を用いたバイオプロセス構築について紹介した。AtaAによって固定化した生体触媒を用いることで、プロセスの効率化、低コスト化、省エネルギー化が可能となる。固体表面と生体触媒を強固に繋ぐAtaAが、スーパー生体触媒と効率的なバイオプロセスを繋ぐキータンパク質になるよう今後も研究を進めていきたい。
文献
1) Hori, K., Yamashita, S., Ishii, S., Kitagawa, M., Tanji, Y., Unno, H.: J. Chem. Eng. Jpn., 34, 1120 (2001).
2) Ishikawa, M., Shigemori, K., Suzuki, A., Hori, K.: J. Biosci. Bioeng., 113, 719 (2012).
3) Ishikawa, M., Nakatani, H., Hori, K.: PLoS One, 7, e48830 (2012).
4) Cotter, S. E., Surana, N. K., St Geme, J. W., 3rd.: Trends Microbiol., 13, 199 (2005).
5) Wu, T., Malinverni, J., Ruiz, N., Kim, S., Silhavy, T. J., Kahne, D.: Cell, 121, (2005).
6) Sikdar, R., Peterson, J. H., Anderson, D. E., Bernstein, H. D.: Nat Commun, 8, 1309 (2017).
7) Ishikawa, M., Shigemori, K., Hori, K.: Biotechnol. Bioeng., 111, 16 (2014).
8) Hori, K., Ohara, Y., Ishikawa, M., Nakatani, H.: Appl. Microbiol. Biotechnol., 99, 5025 (2015).
9) Nakatani, H., Ding, N., Ohara, Y., Hori, K.: Catalysts, 8, 159 (2018).
10) Noba, K., Ishikawa, M., Uyeda, A., Watanabe, T., Hohsaka, T., Yoshimoto, S., Matsuura, T., Hori, K.: J. Am. Chem. Soc., 141, 19058 (2019).
11) Good, M., Trepat, X.: Nature, 563, 7730, 188 (2018).
12) Fujiwara, K., Adachi, T., Doi, N.: ACS Synth. Biol., 7, 363 (2018).
13) Koiwai, K., Hartmann, M. D., Linke, D., Lupas, A. N., Hori, K.: J. Biol. Chem., 291, 3705 (2016).
14) Yoshimoto, S., Nakatani, H., Iwasaki, K., Hori, K.: Sci. Rep., 6, 28020 (2016).
15) Keppler, A., Gendreizig, S., Gronemeyer, T., Pick, H., Vogel, H., Johnsson, K.: Nat. Biotechnol., 21, 86 (2003).
16) Usami, A., Ishikawa, M., Hori, K.: Green Chem., 22, 1258 (2020).
17) Yoshimoto, S., Ohara, Y., Nakatani, H., Hori, K.: Microb. Cell. Fact., 16, 123 (2017).