【トピックス】
1 分子計測により固体結晶基質表面での分解酵素の振る舞いを見る
中村彰彦
静岡大・農
1.はじめに
植物細胞壁のセルロースや節足動物外骨格及び真菌細胞壁のキチンは有用な生物由来資源であるが、その安定性から他の物質への変換が難しい。そこで自然界において、これらの物質を分解しているバクテリアや糸状菌由来の酵素の働きを調べることで、効率的な変換を行うための知見を得ることができると考えられる。本稿では1分子計測技術を用いたカビ及びバクテリア由来セルロース分解酵素のドメイン役割の比較結果1,2)とキチン加水分解酵素の運動機構及び結晶キチン分解機構3)について紹介させていただく。
2.不均一反応を行う酵素の解析
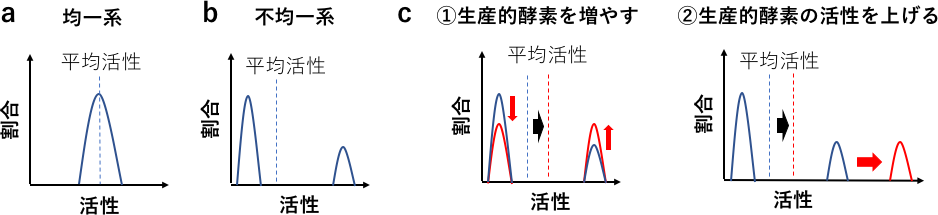
水溶液中での可溶性基質と酵素の反応では、すべての酵素が等確率で反応を行う均一系とみなすことができる。よって基質の結合、分解、生成物の解離などまとめてしまえば、全体の平均活性値は酵素分子の性質をそのまま反映していると考えられる (図1a)。対してセルロースやキチンなどの固体基質を分解する酵素の場合は、基質に吸着した酵素のうち、更に分解可能な分子鎖を活性中心に結合した分子のみが分解反応を起こすことができる。よって系の中に存在している酵素のうち、大半は反応物を生産しない非生産的状態であり、一部の酵素のみが生産的状態となる (図1b)。そのため単純にこの平均をとると、酵素分子の本来の性質とは全く異なる数値を得ることとなる。酵素の平均活性の改善を目指すのであれば、生産的吸着状態の酵素の割合を増やす又は生産的吸着状態の酵素分子の1つあたりの活性を上げることにより達成可能と考えられる (図1c)。しかしバルク計測だけでは、どちらの性質の改善を目指すべきか、また作成した酵素でどちらの性質が改善したのか知ることができない。そこで1分子計測により個々の分子の状態を解析し、場合分けすることで酵素分子の性質を明らかにする方法が有効である。
3. バクテリアとカビ由来セルラーゼの吸着におけるドメイン役割の違い
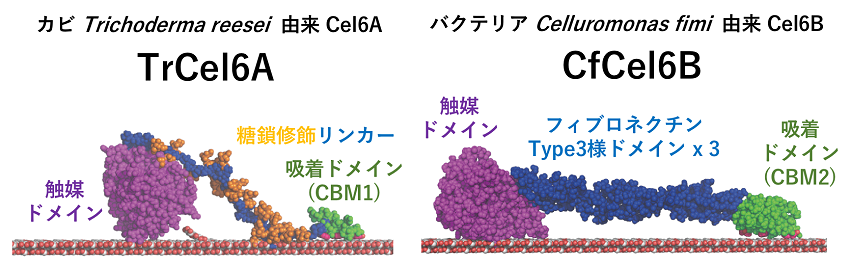
結晶性セルロースの分解には、分子鎖末端から連続的にセロビオースを切り出すセロビオヒドロラーゼ (Cellobiohydrolase: CBH) が重要である。糖質加水分解酵素ファミリー6 (Glycoside hydrolase family6: GH6) に分類されるCBHは、非還元末端側から分子鎖を分解する酵素として糸状菌とバクテリアの両方が有する酵素である4)。カビTrichoderma reesei由来GH6 CBH (TrCel6A) はもっとも古くから研究されている酵素の1つであり5)、またそのオルソログとして取得されたバクテリアCellulomonas fimi由来GH6 CBH (CfCel6B) は最初に遺伝子配列が報告されたバクテリア由来GH6 CBHである6)。これらの酵素の全体構造は図2の通りであり、GH6の触媒ドメインと糖質結合モジュールファミリー (Carbohydrate binding module family: CBM) 1又は2に分類されているセルロース結合ドメイン (Cellulose binding domain: CBD) がリンカー領域で繋がっている。TrCel6Aのリンカー領域はセリンやスレオニンを多く含みO-結合型糖鎖修飾されている。対してCfCel6BのリンカーはフィブロネクチンType3様 (Fibronectin type3 like: FN3-like) ドメインが3つ繋がった構造をしている。全体として同じ機能を発揮していると考えられている2つの酵素だが、ドメインの構成はかなり異なっている。そこで2つの酵素の吸着ドメイン及びリンカーと吸着ドメインの複合体について全反射蛍光顕微鏡を用いた吸脱着現象の1分子計測を行った。
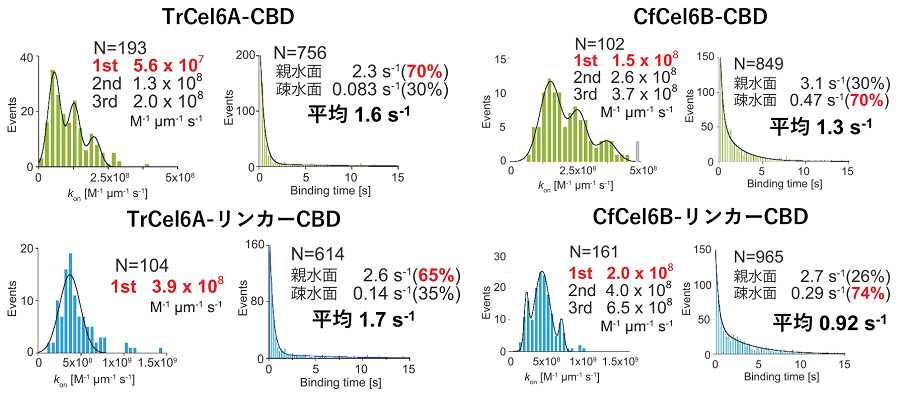
吸着速度定数の解析ではセルロース結晶の束に由来する量子化されたピークが観測される (図3)。そこで最小ピークを単結晶由来とみなして値を比較すると、吸着ドメインのみではCfCel6B-CBDの方がTrCel6A-CBDよりも吸着速度定数が2.7倍大きかった。また脱着速度定数解析ではセルロース結晶の親水面と疎水面に依存した異なる吸着状態が観測される。CBDが芳香族アミノ酸からなる疎水平面を持つことを考慮すると7)、安定な吸着を疎水面への結合と解釈することができる。まず両方の面においてTrCel6A-CBDの解離速度定数の方がCfCel6B-CBDよりも小さかった。しかしCfCel6B-CBDの方が疎水面への吸着割合が多く、2種類の吸着の平均をとるとTrCel6A-CBDの解離速度定数が1.6 s-1に対してCfCel6B-CBDの解離速度定数は1.3 s-1となり、CfCel6-CBDの吸着時間の方が長いことがわかった。つまりCfCel6B-CBDは、早い吸着速度と高い疎水面特異性によりTrCel6A-CBDよりもセルロースへの親和性が高いことが判明した。これは以前よりCBM2のCBDの方がCBM1のCBDよりもセルロースへの吸着親和性が高いと言われていたことと矛盾しない8)。次にリンカー領域と吸着ドメインの複合体で同様の計測を行ったところTrCel6AのリンカーCBDは約7倍大きい吸着速度定数を示した。対してCfCel6BのリンカーCBDの吸着速度定数はあまり変化が見られなかった。これはTrCel6Aでは糖鎖修飾されたリンカー領域を用いてセルロースとの初期相互作用を行っていることを意味している。多くの糸状菌由来セルラーゼのリンカー領域は糖鎖修飾が行われており、その目的としてプロテアーゼによる切断からの保護が考えられてきた。近年、分子動力学シミュレーションにより修飾糖鎖によるセルロース表面への結合が予測されていたが9)、今回の結果により実験的にセルロースへの吸着への関与が明らかとなり、分解に関してより能動的な機能があることが示された。CfCel6BのFN3-likeドメインでは、解離速度定数の低下は観測されるものの、その有無で吸着速度定数への大きな変化は見られないことから、吸着現象への関与は大きくないと考えられる。他のバクテリア由来GH6 CBHではリンカー領域に様々なバリエーションが見られる。しかしCBM2のCBDは保存されていることから、バクテリア由来セルラーゼにおいてはCBM2 CBDを用いてセルロースへの吸着を行っていると考えられる。
この様に糸状菌とバクテリアに共通しているGH6のCBHであるが、触媒ドメインに付随しているリンカー及び吸着ドメインの構造と役割は異なっている。糸状菌由来GH6 CBHでCBM2のCBDを持つ酵素は未だ発見されておらず、なぜ明確なドメインの棲み分けがあるのかは不明である。結晶性セルロースの分解は他のセルラーゼとの共同作用が重要であるため10)、全体のバランスでドメインの選択が行われている可能性も考えられ、他のセルラーゼを含めた更なる研究が必要とされる。
4. 結晶性キチン分解酵素の運動機構と結晶分解メカニズム
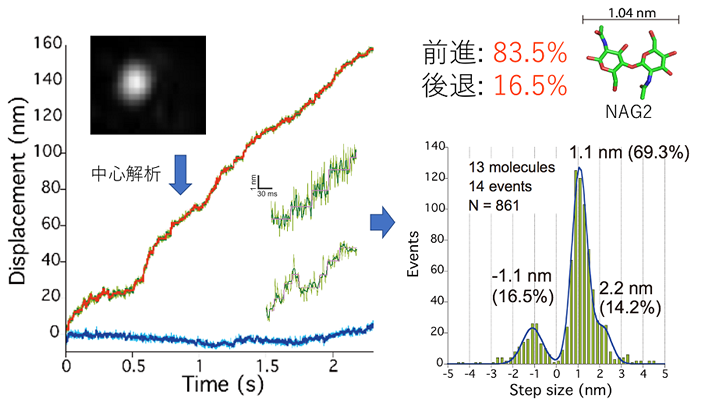
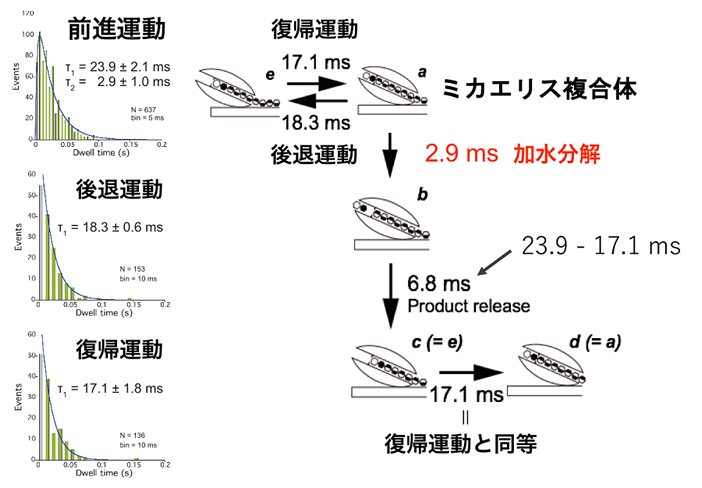
結晶性キチンも同様に固体基質であり、その結晶構造を水中で物理化学的に破壊するためには25 MPa下で380℃の条件が必要であると報告されており11)、これはセルロースの25 MPa下で320℃を上回る値である12)。しかし結晶性キチンも常温常圧下でキチナーゼにより分解されている。結晶性キチン分解活性が高い酵素として古くから研究されているバクテリアSerratia marcescens由来キチナーゼA (SmChiA) は、キチン分子鎖の還元末端側から連続的にN,N’-ジアセチルキトビオース (NAG2) を生産する酵素であり、そのキチン結晶表面での運動が高速原子間力顕微鏡を用いた計測で明らかにされていた13)。しかしその運動メカニズムや、熱力学的に安定なキチン結晶を分解できる理由は不明であった。そこで金ナノ粒子で標識したSmChiA分子が運動する様子を、高速カメラを搭載した全反射暗視野顕微鏡14)で計測することにより、SmChiAの停止と運動のサイクルを観測して、運動機構の解明を試みた (図4)。使用したシステムでは0.5 msに1枚の画像を取得する条件で0.3 nmの位置決定精度を示し、NAG2の理論サイズである約1 nmの変位も観測可能である。取得した移動する粒子の動画から、粒子の中心位置の時間変化を解析すると、全体として位置方向に進む様子を見ることができた。その軌跡をよく見ると連続的な前進運動の他に、後退してから元の位置に戻る運動も含まれていることがわかった。そこで前進運動、後退運動及び後退状態からの復帰運動に場合分けして解析を行うこととした。まず前進運動と後退運動の大きさを解析したところ、どちらにも1.1 nmにピークを持つ分布を示した。このことから前進方向にも後退方向にもNAG2単位を認識して運動していることが明らかとなった。2.2 nm間隔の前進運動も含めて前進と後退の運動比を計算すると前進確率が83.5%、後退確率が16.5%となり、運動は前進方向に偏っていることがわかった。更に各運動直前の停止時間の分布を解析し、反応時定数の解析を試みた (図5)。前進運動の分布は1つのピークを示した。そこで逐次反応モデルに基づく指数関数的減衰の差の式で回帰を行い、早い反応 (2.9 ms) と遅い反応 (23.9 ms) の2つの時定数を得ることができた。後退運動と復帰運動はどちらとも指数関数的減衰の式で回帰することができ、それぞれ18.3 msと17.1 msの時定数を示した。更に重水環境中での計測を行い、反応速度論的同位体効果の観測により、加水分解反応が前進運動の早い反応であることを明らかにした。また反応連続性を考慮すると、前進運動の遅い反応は生成物解離反応の後に、復帰運動と同じ現象が起こると考えられる。そこで23.9 msと17.1 msの差をとり、6.8 msが生成物解離反応の時定数であると決定できた。時定数のまとめを見ると、まず後退運動と復帰運動の時定数はほぼ同等であり、前進状態と後退状態で自由エネルギー状態に大きな差はないことがわかる。これはすなわち、熱揺らぎにより2つの状態を自由に行き来可能であることを示している。更に状態 (a) のミカエリス複合体から加水分解と後退運動が分岐しており、2つの反応は競合状態にあると考えられる。その反応割合は時定数の逆数に比例するため、加水分解の割合は86.3%、後退運動の割合は13.7%となる。これらの値は運動の大きさの分布から計算した前進運動と後退運動の割合と近く、加水分解反応が起こった際に前進運動が起こっていると解釈することができる。SmChiAは一本の分子鎖を掴んで分解しながら運動しているため、加水分解によりNAG2単位だけ分子鎖が短くなった場合、後退運動を行うと安定な後退状態よりもNAG2単位分だけ基質結合サイトが空になってしまう。そのため加水分解前の様な安定な後退状態を形成することができず、後退運動が抑制されると考えられる。また加水分解と生成物解離が起こった後の状態は、NAG2単位分だけ進んだ状態と新たな平衡状態を形成しているため、結果として前に進むこととなる。即ち熱運動により前進と後退を繰り返しながら、前進した際に加水分解により分子鎖を短くすることで後退運動を抑制し、結果として前進方向に平衡を移動させる機構であると考えられる。この運動方向を決定する機構は ‘burnt-bridge’ モデルと呼ばれており、運動自体は熱揺らぎに起因することを考慮するとSmChiAはburnt-bridgeブラウニアンラチェット酵素であると言える (図6)。
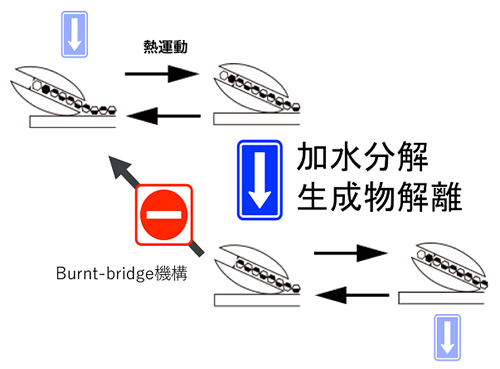
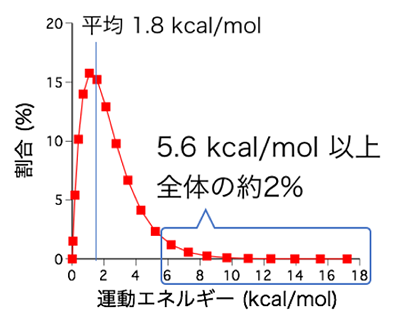
運動機構を基にSmChiAが安定なキチン結晶を室温で分解可能な理由について考察する。25MPa下380℃の条件は、全てのキチン分子鎖を同時に脱結晶化する為の温度条件である。対してSmChiAは1回の反応あたり1本の分子鎖の1 nm単位 (NAG2) を脱結晶化している。この脱結晶化に必要なエネルギーは理論計算により約5.6 kcal/molと推定されている15)。ここで25℃における水分子の並進運動と回転運動の総和である運動エネルギーを (分子間相互作用がないと仮定して) 計算すると、図7の様になる。全体の平均では約1.8 kcal/molしかないため脱結晶化のためのエネルギーが足りない様に見えるが、全体の2%程度はNAG2単位の脱結晶化に足るだけの運動エネルギーを有していると推定される。よってSmChiA分子が1つのNAG2を脱結晶化することは室温でも十分可能である。またエネルギーの分布を見ると11.2 kcal/mol以上のエネルギーを持っている分子は0.02%以下である。即ち2 nm単位での脱結晶化は不可能に近くなる。1 nmずつ脱結晶化と分解を繰り返す分解方法は、室温でのキチン結晶分解における最適解であるように感じられる。またもしかすると高温環境では2 nmずつ分解する酵素が存在する可能性も考えられる。ちなみに運動計測で観測された2.2 nmの前進運動は、キチン分子鎖のアセチル基が部分的に欠落していたことにより、結晶に欠陥が生じていたため1単位をスキップしたものと推察される。
SmChiAについては天然型酵素よりも活性の高い酵素の作成とその解明ができている。特に基質結合サイト入り口のフェニルアラニンをトリプトファンに変化させたF232W変異と生成物結合サイトのフェニルアラニンをトリプトファンに変化させたF396W変異を導入した酵素は、昆虫由来キチナーゼとの比較により創出された高活性変異体である16)。この変異体では酵素の平均分解活性が1.3倍、生産的吸着の親和性が1.7倍上昇したが、その理由は連続分解回数 (プロセッシビティ) の向上に由来することを1分子計測により明らかにした17)。プロセッシビティが高いと生産的吸着の割合が高くなるため、平均分解活性と生産的吸着の親和性が向上したと考えられる。また活性中心のトリプトファン残基の真裏にあるセリン残基をバリンに変化させたS538V変異をさらに導入すると、平均分解活性が1.6倍にまで向上することがわかっている18)。この変異によりどの様なパラメーターが改善したのかは今後の解析が必要であるが、S538V変異が活性中心近傍であること及び生産的吸着の親和性はF232WF396W変異体と変化していないことから、生産的分子自体の分解活性が向上している可能性も考えられる。
5.おわりに
1分子計測技術を用いることでセルロース分解酵素における吸脱着に寄与するドメインの違いやキチナーゼによるキチン結晶分解機構を明らかにすることができた。バルクの計測だけでは分離できていなかった吸着速度定数と脱着速度定数を個別に計測できること、及び分解運動している分子のみを抽出して解析することで生産的吸着状態の酵素を直接解析できるなど、不均一酵素反応の解析において1分子計測は重要な技術である。セルロースやキチンなどの天然高分子に限らず、プラスチックなどの人工高分子の酵素分解においても同様の解析が効果を発揮すると考えられるため、今後は固体基質分解酵素解析方法の拡張も行っていきたいと考えている。
謝辞
紹介させていただいた内容は分子科学研究所 飯野亮太教授、岡崎圭一准教授、東京工業大学 櫻井実教授、古田忠臣助教、東京大学 五十嵐圭日子准教授、琉球大学 金子哲教授、千葉大学 村田武士教授、横浜市立大学水谷健二助教、名古屋大学 内橋貴之教授との共同研究の内容です。この場を借りて御礼申し上げます。
文献
1) Nakamura, A., Tasaki, T., Ishiwata, D., Yamamoto, M., Okuni, Y., Visootsat, A., Miliaen, M., Noji, H., Uchiyama, T., Samejima, M., Igarashi, K., Iino, R.: J. Biol. Chem., 291, 22404 (2016).
2) Nakamura, A., Ishiwata, D., Visootsat, A., Uchiyama, T., Mizutani, K., Kaneko, S., Murata, T., Igarashi, K., Iino, R.: J. Biol. Chem., 295, 14606 (2020).
3) Nakamura, A., Okazaki, K., Furuta, T., Sakurai, M., Iino, R.: Nat. Commun., 9, 3814 (2018).
4) Lombard, V., Golaconda, R. H., Drula, E., Coutinho, P. M., Henrissat, B.: Nucleic. Acids. Res., 42, D490 (2014).
5) Rouvinen, J., Bergfors, T., Teeri, T., Knowles, J. K., Jones. T. A.: Science., 249, 380 (1990).
6) Meinke, A., Gilkes, N. R., Kwan, E., Kilburn, D. G., Warren, R. A., Miller, Jr. R. C.: Mol. Microbiol., 12, 413 (1994).
7) Boraston, A. B., Bolam, D. N., Gilbert, H. J., Davies, G. J.: Biochem. J., 382, 769 (2004).
8) Payne, C. M., Resch, M. G., Chen, L., Crowley, M. F., Himmel, M. E., Taylor, L. E. 2nd, Sandgren, M., Ståhlberg, J., Stals, I., Tan, Z., Beckham, G. T.: Proc. Natl. Acad. Sci. USA, 110, 14646 (2013).
9) Tomme, P., Driver, D. P., Amandoron, E. A., Miller, R. C., Jr., Antony, R., Warren, J., Kilburn, D. G.: J. Bacteriol., 177, 4356 (1995).
10) Uchiyama, T., Uchihashi, T., Nakamura, A., Watanabe, H., Kaneko, S., Samejima, M., Igarashi, K.: Proc. Natl. Acad. Sci. USA, 117, 19896 (2020).
11) Deguchi, S., Tsujii, K., Horikoshi, K.: Sci. Rep., 5, 11907 (2015).
12) Deguchi, S., Tsujii, K., Horikoshi, K.: Chem. Commun. (Camb.)., 21, 3293 (2006).
13) Igarashi, K., Uchihashi, T., Uchiyama, T., Sugimoto, H., Wada, M., Suzuki, K., Sakuda, S., Ando, T., Watanabe, T., Samejima, M.: Nat. Commun., 5, 3975 (2014).
14) Ueno, H., Nishikawa, S., Iino, R., Tabata, K. V., Sakakihara, S., Yanagida, T., Noji, H.: Biophys. J., 98, 2014 (2010).
15) Beckham, G. T., Crowley, M. F.: J. Phys Chem B., 115, 4516 (2011).
16) Liu, T., Chen, L., Zhou, Y., Jiang, X., Duan, Y., Yang, Q.: J. Biol. Chem., 292, 2080 (2017).
17) Visootsat, A., Nakamura, A., Vignon, P., Watanabe, H., Uchihashi, T., Iino, R.: J. Biol. Chem., 295, 1915 (2020).
18) Visootsat, A., Nakamura, A., Wang, T. W., Iino, R.: ACS Omega, 5, 26807 (2020).