【トピックス】
インテイン酵素による二重特異性抗体エンジニアリングの新展開
真壁幸樹
山形大院・理工
1.はじめに
抗体医薬品は、がんやリウマチ治療薬を筆頭とした様々な疾病治療薬へ応用され、医薬品売上高の上位を占めている。しかし、高い薬価や標的の枯渇などが問題となってきており、より少量で高い効果を持つ次世代の抗体医薬品の開発が進められてきている1)。その中で、一分子で二種類の抗原を同時に認識することができる二重特異性抗体は、医薬品としての機能を高めることができるため多くの研究が行われている2,3)。
このような背景のもと、二重特異性抗体を高収率で生産する技術として、インテインを用いた抗体エンジニアリングが近年にいくつか報告されてきており、本稿では著者らの例も含めてこの進展について概説する。
2.抗体エンジニアリングによる二重特異性抗体の開発
産業応用されている抗体は基本的にIgG型であり、二本の重鎖と二本の軽鎖がジスルフィド結合によって連結したY字の形を有している (図1a)。抗原を認識する2つのFab (Fragment of antigen binding) 領域と受容体結合部位であるFc領域からなり、Fabの先端には様々な抗原との結合のために多様なアミノ酸配列を持つ可変領域 (Fv) がある。抗体には抗原結合部位が二箇所あるため、それぞれが異なった二種類の抗原を認識するように作製したものが、二重特異性抗体である。例えば、片方の抗原認識部位で癌細胞に特異的な抗原を認識させ、他方で免疫細胞上の抗原を認識させるように設計すると、がん細胞と免疫細胞を架橋することが可能となる (図1b)。このような二重特異性抗体は効果的に免疫細胞をがん局所に集めることができるため、がん治療薬となる。
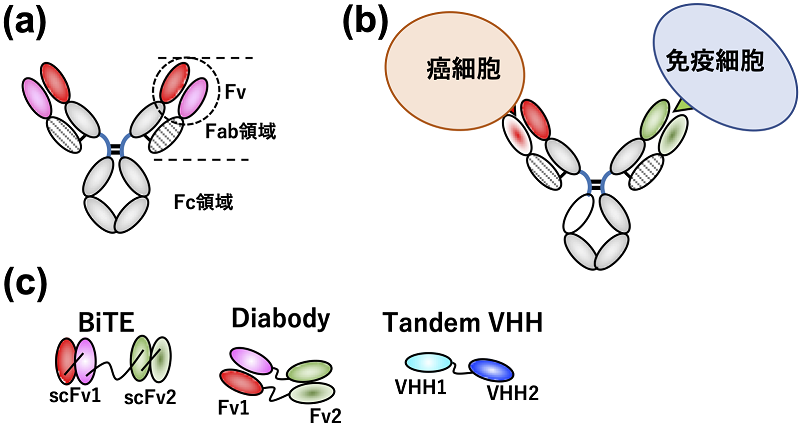
図1 抗体分子の模式図 (a)。二重特異性抗体による細胞架橋 (b)。様々な小型二重特異性抗体 (c)。
二重特異性抗体はIgG型の他にも、一本鎖Fv (scFv; single chain Fv) を二種類、縦列に連結させたTandem scFv (特にT細胞とがん細胞を架橋するものはBiTE (Bispecific T-cell engager) と呼ばれる) や短いリンカーを持つscFvが二量体化したdiabody、一つのドメインで抗原結合できるラクダ重鎖抗体可変部位VHHを連結させたtandem VHHなど、分子サイズの小さい小型二重特異性抗体も数多く提案されている (図1c)。小型二重特異性抗体は組織浸透性が高く、また微生物での生産が可能であるため、高い薬効と生産コストの削減が期待されている。
3.ペプチド連結酵素インテインによる蛋白質トランススプライシング (PTS) 反応
インテインはその両末端にある蛋白質配列を連結し、自身が切り出される酵素である (図2a; シススプライシング)4)。インテインにはN 末端側 (インテインN) とC末端側 (インテインC) が二つに分かれている、分離インテインがある。特に広く用いられているのがNostoc punctiforme由来DnaE分離インテイン (Npuインテイン) である。これを蛋白質工学に応用したものが蛋白質トランススプライシング (Protein Trans-splicing; PTS) 反応であり、別々の蛋白質鎖同士をペプチド結合で連結することができる (図2b)。例えば、NMRでの測定を目的に、片方の蛋白質領域のみを安定同位体標識し、連結することでポリペプチド鎖の一部だけラベルされた蛋白質を調製できる5)。
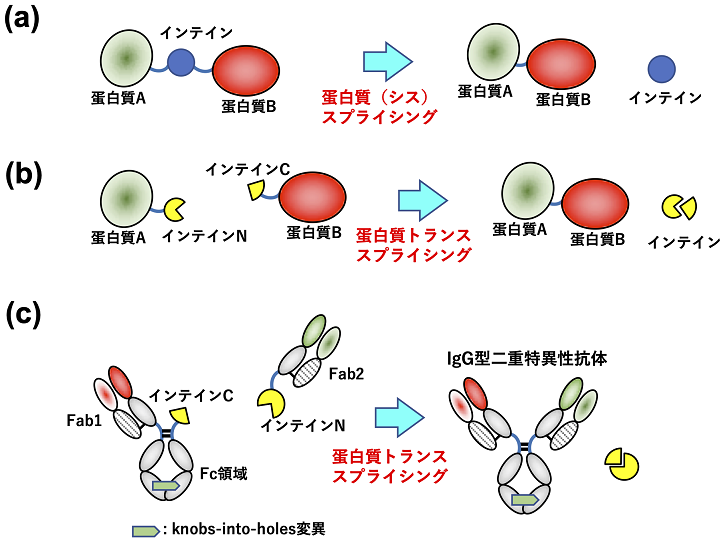

4.PTS反応による二重特異性抗体の構築
このPTS反応の抗体エンジニアリングへの応用は幅広く、例えば毒素や蛍光物質の連結などの報告がある6,7)。近年、二重特異性抗体の作製に適用した例がいくつか報告されており、以下ではこの分野に絞って述べる。PTS反応による蛋白質連結で、IgG型の二重特異性抗体の収率が低いという問題を克服できたり、また、任意の組み合わせの様々な二重特異性抗体の調製を任意で実現したり、通常の組換え体蛋白質では実現できない骨格構造を作り出したりすることが可能となる。IgG型の二重特異性抗体の報告 (例1)、著者が報告した小型抗体断片VHHの連結反応による二重特異性抗体の作製 (例2) とタンデムVHHを環状化した二重特異性抗体の構築 (例3) について以下に概説する。
4-1 例1:PTS反応によって作り出すIgG型二重特異性抗体
IgG型二重特異性抗体は二種類の重鎖と二種類の軽鎖を正しく組み合わせることで作り出せる (図1b)。しかし、重鎖間、軽鎖間は正しくない対合も起こるため、単純に4種類のポリペプチド (二種類の重鎖と二種類の軽鎖) を動物細胞で共発現させると目的の二重特異性抗体は理論上12.5%しか形成せず、その後の多段の精製が必要となる。この問題を克服するために様々な方法が提案されてきた8)。例えばKnobs-into-holesと呼ばれる方法は、重鎖の定常領域 (Fc) の二量体結合界面において片方の表面を凸に、もう片方の表面を相補的な凹となるように変異導入で設計されており、特異的なヘテロ二量体重鎖を形成する。さらに、Fab領域のドメイン入れ替えなどの方法を組み合わせると、100%の理論収率で二重特異性抗体が作り出せるが、非天然のアミノ酸配列やドメイン構造になり、抗原性が高まってしまう可能性があった。
2017年にHanらによって報告された論文9)では、Npu分離インテインを用いて、IgG全体をFabとそれ以外の2つにわけ、FabにインテインN、もう片方にインテインCを融合させて別々に動物細胞発現系によって調製し、PTS反応によってIgG型二重特異性抗体が作製された (図2c)。まず、knobs-into-holes変異によりFc同士の正しい会合を誘導させた。IgG型二重特異性抗体の片方はknobs型のH鎖と通常のL鎖であり、このknobs型H鎖と対合するholes型Fc鎖にインテインCを融合してある。これらの遺伝子が発現すると、片方のFabの代わりにインテインCがついた構成が出来上がる。もう片方のFabのC末端にインテインNを融合させ別に調製する。これらをPTS反応によって連結させるとIgG型二重特異性抗体が出来上がる (図2c)。完成した抗CD3-抗 HER2二重特異性抗体は高い抗腫瘍活性を示した。本方法ではFabを別々に調製するために軽鎖が正しくない対合をしてしまうという問題を回避できる点がすぐれている。ただ、Fc領域の正しい対合を行うために非天然のknobs-intoholes変異を導入する必要があるため、その部位は天然の抗体のアミノ酸配列と異なるという問題は残る。
4-2 例2:PTS反応によって作り出す小型二重特異性抗体
我々はPTS反応を用いて、小型抗体断片であるラクダ重鎖抗体可変領域VHHを連結して二重特異性抗体を作り出すことに成功し、報告した10)。例1でも用いられたNpu分離インテインそれぞれ (インテインNとインテインC) に二種類のVHHを融合させた発現ベクターを構築した。抗体は概念実証として検出しやすい、抗EGFR VHHと抗緑色蛍光蛋白質 (GFP) VHHの組み合わせを用いた。発現ベクターはIwaiらが構築した菌体内で二種類のインテイン発現を段階的に行う、pSKDuet?pSKBAD系を使用した(5)。これは異なった複製起点 (ColE1とRSF) と誘導プロモーター (IPTGとアラビノース誘導) を持つ二種類の発現ベクターを同時に形質転換して、段階的に誘導をかけることで任意のタイミングで菌体内にてPTS反応を行うことができる方法である。
最初にインテインCを融合した抗GFP VHHをアラビノースで発現誘導し、その後にインテインNを融合した抗EGFR VHHをIPTGで発現誘導すると、自発的にPTS反応が菌体内で進行し、二重特異性VHHが構築された (図3a)。Npu分離インテインではインテインNの安定性が低く、凝集しやすいことが知られており、発現する順番を逆にしてインテインN融合VHHを先に発現させると、反応収率が減少した。連結反応によって作製した二重特異性抗体は、同じ構成を持つ遺伝子工学的に連結させた二重特異性抗体と同じ活性を保持していた。
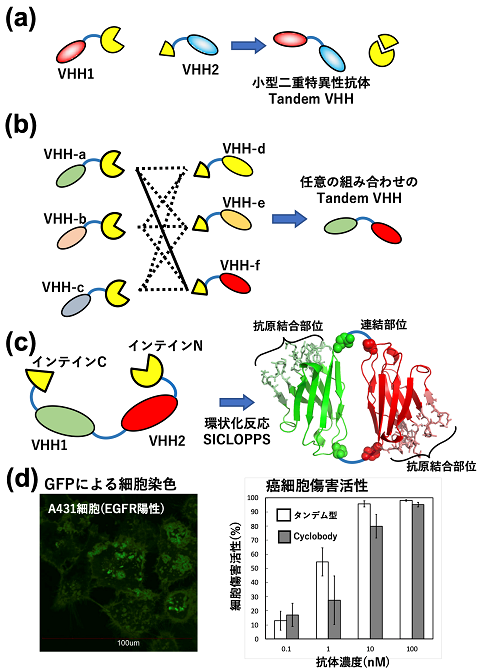

本方法の利点は、連結させる組み合わせを後で自由に選択できる点である (図3b)。そこでインテインCにGFPを融合させ、VHHに直接、蛍光ラベルした。反応では二重特異性抗体の作製に使ったインテインN-VHH (抗EGFR) ベクターをそのまま用いて、同様な誘導培養によってGFPが連結した抗EGFR VHHの構築に成功し、活性も確認できた。また、これら分離インテイン融合VHHは精製後に反応させて二重特異性抗体を作り出すこともできる (論文未発表データ)。今後、scFvやFabなどでも同様に連結させることが可能になれば、本法の汎用性がより広がっていくだろう。
4-3 例3:ペプチド環状化反応による新しいトポロジーを持つ小型二重特異性抗体
分離インテインを蛋白質の両末端に融合させると、自己環化PTS反応によって、主鎖が環状化したポリペプチド構造を作り出せる (SICLOPPS (Split Intein Circular Ligation Of Proteins and PeptideS)11))。我々は、この反応を用いて二種類のVHHを環状に連結することを着想し、その結果を報告した (図3c)12)。100種類にも及ぶ様々な構成の二重特異性抗体が報告されてきたが、環状の主鎖構造を持つものは前例がなくこれが初めての報告である。環状化により、抗原認識部位であるそれぞれのVHHのCDRループがちょうど反対に位置するようになるため異なった二種類の抗原を橋渡しするのに適した配置となる。
抗EGFRと抗GFPおよび抗EGFRと抗CD16の二種類のタンデムVHH二重特異性抗体について、環状化反応を行なった。インテインCとインテインNをタンデムVHHの両末端に融合させた発現ベクターを構築した。この遺伝子が発現すると自発的に環状化反応が進行し、目的の環状化VHH二重特異性抗体 (我々はこれをCyclobodyと命名した) が生成した。分析ゲル濾過の結果から、タンデムに二つのVHHを連結したものよりも後に溶出されたことから、Cyclobodyはモデル構造 (図3c) から予測されるコンパクトな構造で溶液中に存在していることがわかった。環状化によってペプチド鎖の末端がないためエキソペプチダーゼ消化に耐性を示した。変性剤による安定性評価から、Cyclobodyはタンデムに連結したVHHと同程度の安定性を有していた。
EGFR陽性細胞に抗EGFR VHHと抗GFP VHHからなるCyclobodyとGFPを加えると細胞表面がGFPで蛍光染色された (図3d)。このことからCyclobodyは同時に二つの抗原に結合できる二重特異性を保持していることがわかる。また、抗EGFR VHHと抗CD16 VHHからなるCyclobodyは同じ構成のタンデムVHHと同程度の細胞傷害活性を示した (図3d)。
今後、Cyclobodyに用いる抗体クローンやリンカーの最適化によってより高い安定性と細胞傷害活性を持つCyclobodyの構築を進めていきたい。
5.おわりに
分離インテインを用いると、組換え体蛋白質を調製後に連結させることができるため、通常の組換え体では実現できない様々な応用が可能となる。本稿では、インテインを抗体エンジニアリングに適用して、様々なタイプの二重特異性抗体を作り出す研究例を紹介した。
インテインを用いることで、構築したインテイン融合抗体の組み合わせを変えるだけで任意の二重特異性抗体を調製後に作り出すことができる。例えば新規の抗体クローンが得られた場合、一種類のインテイン融合蛋白質を作製すれば、任意の既存の発現ベクターと組み合わせて、二重特異性抗体を生み出すことができる (図3b)。
蛋白質の主鎖を連結する反応はインテイン酵素の他にもソルターゼを用いた方法も広く用いられている。ソルターゼを用いた二重特異性抗体構築の例として、二種類のIgG抗体のC末端にそれぞれアジド化合物とアルケンをソルターゼによってそれぞれ導入し、クリックケミストリーを用いてIgG連結型二重特異性抗体を構築した例13)が報告されている。インテインは融合蛋白質として作り出すのに対して、ソルターゼでは認識配列に酵素を添加して作用させる。ソルターゼには逆反応が進行するため、効率が低いという問題があるが、これが克服されれば、様々な抗体エンジニアリングへ応用されていくだろう。
謝辞
本稿に有益なコメントをしていただいた、東京農工大学 浅野竜太郎博士、大阪市立大学 中西猛博士に感謝いたします。
文献
1) 実験医学:次世代抗体医薬の衝撃, 36 (2018).
2) Sedykh, S. E., Prinz, V. V., Buneva, V. N., Nevinsky, G. A.: Drug Des. Devel. Ther., 12, 195 (2018).
3) Brinkmann, U., Kontermann, R. E.: MAbs., 9, 182 (2017).
4) Shah, N. H., Muir, T. W.: Chem Sci., 5, 446 (2014).
5) Muona, M., Aranko, A. S., Raulinaitis, V., Iwai, H., Iwai, H.: Nat Protoc., 5, 574 (2010).
6) Pirzer, T., Becher, K.-S., Rieker, M., Meckel, T., Mootz, H. D., Kolmar, H.: ACS Chem. Biol., 13, 2058 (2018).
7) Stevens, A. J., Brown, Z. Z., Shah, N. H., Sekar, G., Cowburn, D., Muir, T. W.: J. Am. Chem. Soc., 138, 2162 (2016).
8) Klein, C., Sustmann, C., Thomas, M., Stubenrauch, K., Croasdale, R., Schanzer, J., Brinkmann, U., Kettenberger, H., Regula, J. T., Schaefer, W.: MAbs., 4, 653 (2012).
9) Han, L., Chen, J., DIng, K., Zong, H., Xie, Y., Jiang, H., Zhang, B., Lu, H., Yin, W., Gilly, J., Zhu, J.: Sci. Rep., 7, 1 (2017).
10) Shibuya, Y., Haga, N., Asano, R., Nakazawa, H., Hattori, T., Takeda, D., Sugiyama, A., Kurotani, R., Kumagai, I., Umetsu, M., Makabe, K.: Protein Eng. Des. Sel., 30, 1 (2016).
11) Tavassoli, A.: Curr. Opin. Chem. Biol., 38, 30 (2017).
12) Hemmi, S., Asano, R., Kimura, K., Umetsu, M., Nakanishi, T., Kumagai, I., Makabe, K.: Biochem. Biophys. Res. Commun., in press (2019).
13) Wagner, K., Kwakkenbos, M. J., Claassen, Y. B., Maijoor, K., Bohne, M., van der Sluijs, K. F., Witte, M. D., van Zoelen, D. J., Cornelissen, L. A., Beaumont, T., Bakker, A. Q., Ploegh, H. L., Spits, H.: Proc. Natl. Acad. Sci. USA, 111, 16820 (2014).
![]()