【トピックス】
無機―生体ハイブリッド型光触媒反応:無機半導体とヒドロゲナーゼを組み合わせた光駆動型の水素生産
本田裕樹
奈良女子大・理
1.はじめに
水素は、次世代の「きれい」なエネルギーキャリアとして注目される。水素と酸素との化学反応からエネルギーを取り出す際に、二酸化炭素の排出がないことが「きれい」であり、低炭素社会の実現に向けて水素の形でエネルギーを貯蔵、運搬する水素社会が提唱されている1)。一方、水素の工業的な生産では、天然ガスの水蒸気改質や、製鉄所などの工場で発生するガスからの精製、あるいは電気を用いる水電解などが供給源に挙げられる。したがって、太陽、風力等の再生可能エネルギーや原子力エネルギーを利用して得た電力を用いる水電解を別にすれば、工業的な水素生産は大量の化石燃料の消費に依存しており、水素は製造時には「きたない」。燃料電池自動車の市販や家庭用燃料電池の普及により、今後も水素の需要がますます高まることが予想される中で、化石燃料に依存しない、自然エネルギーやバイオマスなどの再生可能エネルギーを利用する「きれい」な水素生産法への転換に期待が寄せられている。
光触媒による太陽光エネルギーを用いた水の分解反応は理想的な水素生産法である2)。酸化チタン (TiO2) をはじめとした無機半導体に助触媒として金属を担持した基本的な光触媒系を用いると、人類にとっては無尽蔵と捉えられる太陽光エネルギーと水のみから水素を得ることができる。1970年代の本多―藤嶋効果3)の報告に始まる無機半導体を用いた光触媒に関する研究は、TiO2やその他の金属酸化物、窒化物から成る半導体を用いて国内外で精力的に進められており2)、実用化に向けて活性向上やコスト (貴金属の使用) の面で改良され続けている。一方、近年では無機半導体による光触媒反応に、酵素や微生物といった生体触媒の反応を組み合わせた「無機―生体ハイブリッド型光触媒」の報告例が増えている4,5)。酵素や生体触媒の有する特長、すなわち常温常圧下で高効率かつ高選択的に反応を進行させる能力を巧みに取り込むことで、高活性な光触媒系の構築を目指すものである。本稿では、この無機―生体ハイブリッド型光触媒のなかで、主に水素生産に関する研究を取り上げ、筆者の取り組みも含めて紹介したい。
2.無機―生体ハイブリッド型光触媒
無機―生体ハイブリッド型光触媒についての説明に向け、TiO2に助触媒としてプラチナ (Pt) を担持した基本的な光触媒系 (Pt-TiO2) を用いた水の分解による水素生成について簡単に紹介する (図1a)。無機半導体にバンドギャップ以上のエネルギーをもった光が照射されると、伝導帯に励起電子 (e-)、価電子帯に正孔 (h+) が生じる。TiO2の場合には伝導帯と価電子帯のエネルギー準位が、プロトン還元と水の酸化の酸化還元電位を挟み込む位置に存在しており、励起電子はPt上でプロトン還元に利用されて水素を生じ、一方で正孔は水を酸化し酸素が生じる反応が可能となる。ここで、助触媒としてPtの代わりにヒドロゲナーゼのような酸化還元酵素を用いると、光と何らかの電子源 (理想的には水であるが、トリエタノールアミン (TEOA) 等の犠牲剤が添加される) によって駆動する無機―生体ハイブリッド型光触媒による水素生成が成立する (図1b)。組み合わせる酸化還元酵素が金属酵素の場合、無機半導体の伝導帯に生じる光励起電子は酵素へと直接移動可能である。直接の電子移動ができない場合には、例えばメチルビオローゲン (MV) といった電子メディエーター分子の添加が必要になる場合がある。また、TiO2はバンドギャップが大きく紫外光のみ吸収するため、太陽光に含まれる波長の一部しか利用できない。太陽光の有効利用には利用可能な波長を可視光に拡張する必要があるが、光増感剤となるルテニウム系色素分子を吸着させたTiO2 (色素増感) 6,7)や、バンドギャップが小さく可視光応答可能な硫化カドミウム (CdS) やテルル化カドミウム (CdTe) を採用した可視光駆動型のハイブリッド反応が構築されている8,9)。
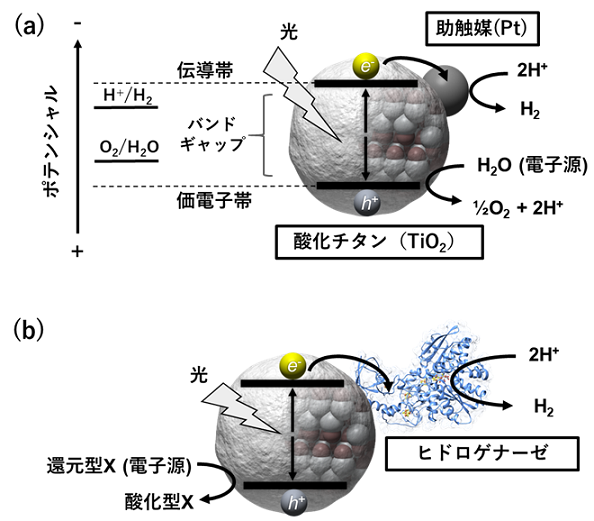

2-1 ヒドロゲナーゼを用いた無機―生体ハイブリッド系による水素生産
無機―生体ハイブリッド系は、ヒドロゲナーゼを用いた水素生産の報告例が多い5)。ヒドロゲナーゼは、プロトン還元による水素生成 (2H++2e-→H2)、その逆の水素分子の酸化 (H2→2H++2e-) の両方向の反応が触媒できる10)。活性中心の金属により3つの分類があるが、そのうち[NiFe]-ヒドロゲナーゼと[FeFe]-ヒドロゲナーゼが利用されている。ヒドロゲナーゼの水素生成効率は一般に高いと言ってよく10)、無機―生体ハイブリッド系では、Pt-TiO2系よりも反応系全体で高い光触媒的水素生成活性を示す。TiO2とヒドロゲナーゼから成る無機―生体ハイブリッド系は1980年代には既に報告が見られる11,12)。近年の注目される例には、Reisnerらによるルテニウム系色素を吸着したTiO2とDesulfomicrobium baculatum から精製された[NiFeSe]-ヒドロゲナーゼ ([NiFe]-ヒドロゲナーゼのバリエーションの1つ) との組み合わせ6,7)や、KingらによるCdS8)やCdTe9)とClostridium属由来の組換え[FeFe]-ヒドロゲナーゼの組み合わせの例がある。いずれの例でも基本的な実験系として、無機半導体と精製酵素を懸濁することで半導体と酵素間の吸着を促し、これに適切な電子源存在下 (TEOAやアスコルビン酸) で光照射することで、光照射依存的な水素生成を実現している。
2-2 [FeFe]-ヒドロゲナーゼと修飾酵素の遺伝子群を発現させた組換え大腸菌の菌体を用いる無機―生体ハイブリッド系
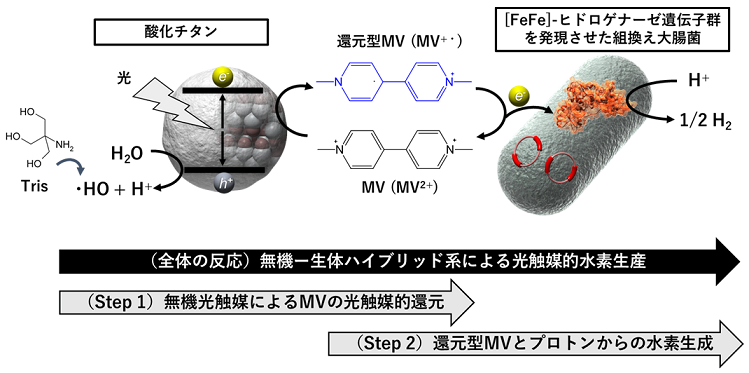
2-2節では、[FeFe]-ヒドロゲナーゼの無機―生体ハイブリッド系への応用を簡便に実現する例として、精製酵素の代わりに当該酵素遺伝子を発現させた組換え大腸菌の休止菌体を適用するという酵素工学的には単純な発想に基づく筆者の検討について記述する13,14)。図2には2-2節を通して構築した組換え大腸菌の菌体を用いる無機―生体ハイブリッド系の模式図を示す。この反応は2段階に分けられる。Step 1は無機半導体による電子メディエーター (MV) の光触媒的な還元、Step 2は還元型MVを用いた生体触媒による水素生成である。この2つの反応の共役によって光触媒的水素生成が成立する。

2-2-1 [FeFe]-ヒドロゲナーゼと修飾酵素の遺伝子群を発現させた組換え大腸菌の水素生成活性
活性中心金属によって分類されるヒドロゲナーゼの中でも、[FeFe]-ヒドロゲナーゼは水素生成の方向に活性が強く、水素生成反応に適用する酵素としてふさわしい。一方で、酸素には極めて感受性が高く、[FeFe]-ヒドロゲナーゼの精製酵素の取り扱いには通常の酵素精製に加えてさらに煩雑な操作が要求される。ここではC. acetobutylicum由来の[FeFe]-ヒドロゲナーゼ (HydA) を用いるが、大量の酵素を得る際にも、酵素源のC. acetobutylicumよりも生育速度の大きい大腸菌を用いることは都合がよい。活性のあるヒドロゲナーゼを得るためには、活性中心錯体を形成するための修飾酵素が必要になる。[FeFe]-ヒドロゲナーゼの場合は、活性中心錯体を含む酵素本体であるHydAのほか、修飾酵素群HydE、HydF、HydGを必要とし、大腸菌へは4種類の遺伝子導入が必要である15,16)。4種類というのはヒドロゲナーゼとしては数が少なく ([NiFe]-ヒドロゲナーゼでは8種類必要) 10)、[FeFe]-ヒドロゲナーゼ遺伝子群の大腸菌での異種発現は容易としてよい。また、[FeFe]-ヒドロゲナーゼは鉄―硫黄クラスターの導入も必要であるが、これは大腸菌にもともと備わっているシステムが担う。
C. acetobutylicum NBRC 13948由来hydA、hydE、hydF、hydGの4種の遺伝子を、プラスミドpETDuet-1とpCDFDuet-1の計4つのマルチクローニングサイトのT7プロモーター下流に連結したpEHydEAとpCHydFGを構築し、大菌BL21(DE3)に形質転換した。当該大腸菌を0.1 wt%のグルコースと0.25 mg/mlのクエン酸アンモニウム鉄を含むLB培地で好気的に培養後、システインとフマル酸ナトリウムを添加して嫌気グローブボックス内に移し、イソプロピル-β-チオガラクトピラノシドを添加して遺伝子発現を誘導し20時間撹拌後、遠心分離で菌体ペレットを回収、その後、緩衝液に再懸濁することでHydAを生産した組換え大腸菌菌体の懸濁液を得た。続いて菌体破砕とカラム精製を経て得られた精製HydA、あるいは当該大腸菌菌体をそのまま用いて水素生成活性を測定した。活性測定は、100 mM Tris-HCl (pH 7) 中で実施し、25 mM亜ジチオン酸ナトリウムで化学的に還元された5 mM還元型メチルビオローゲン (還元型MV、MV+・) を電子源として水素発生量から比活性を測定した。精製HydAからはおよそ0.4 mmol-H2/min/mg-HydA、また菌体からは0.7 µmol-H2/min/mg-wet cellという比活性が算出され、ネガティブコントロールとして用いた空ベクターを導入して同様に取得した大腸菌からは水素生成活性は検出されなかった。以上より、所定の方法で得られた組換え大腸菌の菌体は、酵素精製などの煩雑な操作を経ずに還元型MVを用いる水素生成生体触媒として利用可能であることを確認できた13)。
2-2-2 TiO2と組換え大腸菌の懸濁液を用いた光触媒的水素生産
TiO2と精製HydAあるいは組換え大腸菌との懸濁液を調製し、光照射による水素生産を試みた。図3aには、TiO2と精製HydA、図3bにはTiO2と組換え大腸菌菌体を用いた光触媒的水素生産を示す13)。反応溶液 (20 ml) 組成は、100 mM Tris-HCl (pH 7)、150 mM NaCl、5(v/v)%グリセロール、100 mM アスコルビン酸、5 mM メチルビオローゲン (MV) とし、無機半導体として50 mgのTiO2アナターゼ粉末、生体触媒として0.77 nmolの 精製HydAあるいは0.1 g-wet cellの組換え大腸菌菌体を添加した。光源には300 Wのキセノンランプを用いた。この反応溶液の中で、NaClとグリセロールは酵素の安定性向上を狙い、アスコルビン酸はこの反応における犠牲剤として添加している。


まず、TiO2と精製HydAを組み合わせた実験について述べる。図3aに示すように、TiO2アナターゼと精製HydAの反応から、光照射依存的な水素生成が確認できた。この条件下では、TiO2アナターゼのみからは水素生成は見られなかった。また、MV添加による水素生成量への影響は見られず、精製HydAではTiO2から電子が酵素に直接伝達されている。続いて、TiO2と組換え大腸菌菌体を組み合わせた実験について述べる。図3bに示すように、TiO2とHydAを生産した組換え大腸菌菌体を組み合わせた際には、光照射依存的な水素生成が確認できた。一方、暗条件や、空ベクターを導入した大腸菌菌体を用いた場合には水素生産は見られなかった。また、MVを添加した場合のほうが4倍ほど水素生成量は大きくなり、TiO2で生じた光励起電子が細胞内HydAへと伝達される過程がMVによって促進される効果が確認された。以上のことから、無機―生体ハイブリッド系に対して、精製酵素よりも簡便な操作で取得できる[FeFe]-ヒドロゲナーゼ遺伝子群を発現させた大腸菌の菌体を、そのまま適用することが可能であることを実証した13)。光触媒活性の効率を表現する際に、単色光を照射した際の見かけの量子収率 (AQY) を用いることがある。AQYは、AQY(%)=100×[2×H2生成量(mol)]÷[反応系に照射されたフォトン数(mol)]で表現される。本反応系に対して、300 nmの単色光を用いた際の見かけの量子収率はAQY300=0.3%であった13)。AQYは低い値となったが、無機―生体ハイブリッド系を構築する際に、簡便な手法で生体触媒を供給できることを提案した点に意義があった。
続く報告において、TiO2と組換え大腸菌菌体を用いた無機―生体ハイブリッド系における水素生成効率の向上を目指した14)。図2に反応系の模式図を示したが、本系は2段階の反応で光水素生産を実現している。全体の活性向上に向け、各反応段階の効率を個別に検討するこ とからはじめた。光触媒的水素生産反応においてStep 2の反応は、反応系に加えている生体触媒の比活性から判断すると能力の1%も発揮されておらず、全体の活性向上にはStep 1の改善が必要であった。そこでStep 1の反応条件 (無機半導体の種類、犠牲試薬) を検討したところ、ある条件 (TiO2アナターゼからTiO2 P-25に変更、反応溶液からアスコルビン酸を抜き、100 mM Tris-HCl (pH 7) に変更) において従来の300倍以上の速度で光触媒的なMV還元が進行することを見出した。この反応系において、Trisは効率的なOHラジカルスカベンジャーであり、光触媒反応時のTiO2の価電子帯での水の酸化 (H2O+h+→HO・+H+) で生じるOHラジカルと反応していると考えられる (図2)。強化型Step 1とStep 2反応を組み合わせた光触媒的水素生産では、光触媒的水素生成の効率はAQY300=26%、AQY350=31%と大きく向上 (もとはAQY300=0.3%) した14)。
2-2-3 無機半導体からヒドロゲナーゼへの電子伝達について
TiO2と組換え大腸菌の菌体を組み合わせた無機―生体ハイブリッド型光触媒反応について、「TiO2から細胞内のHydAへ、どのように電子が伝達されるのか?」というご指摘をよくいただく。正直なところ、よくわからない。筆者は本反応系について図2を用いて、TiO2の作用で生成した還元型MVからHydAに電子が伝達される、と自身でも少々疑問を抱きながら紹介している。極性分子の膜透過は一般に容易ではなく、MVは大腸菌の細胞膜を透過しないと報告する論文もある17)。では、光触媒反応中では膜は破壊されてHydAが漏出し、それがTiO2から電子を受け取っているのだろうか。溶菌の指標になるβ-ガラクトシダーゼ活性18)や顕微鏡観察を試みたが、それらの結果は光触媒反応前後で膜が維持されることを示唆していた13)。図3aにはTiO2と精製HydAを用いた反応系を示しているが、TiO2と精製HydAは直接電子伝達が可能であり、もし菌体からHydAが漏出している場合には図3bのようにMVの添加効果は観察されないのではないか、とも考えている。また、図3bに示すように水素生成速度は小さいが、TiO2と組換え大腸菌を用いる系ではMVを添加しなくとも光照射依存的な水素生産が観察される (MVは毒物であり、不要であれば添加したくない)。これもどのようにTiOz2から電子が伝達されるのか、大変興味深く思っている。以上のように、無機半導体と生体触媒間の電子伝達には疑問が多くあるが、この電子伝達経路を解明できれば菌体を用いる無機―生体ハイブリッド系のさらなる活性の向上につながると思われる。読者に詳しい方がおられれば、ぜひご助言をいた
だきたい。
3.今後の展望
本稿では、無機半導体による光触媒反応と酸化還元酵素の反応を組み合わせた無機―生体ハイブリッド型光触媒について、特にヒドロゲナーゼを用いた水素生産に関して取り上げた。無機半導体と助触媒として金属 (Pt) を担持した基本的な光触媒系に対して、助触媒を金属ら高効率な生体触媒に置き換えることで、全体として高活性な光触媒系が構築できるという考えに基づいている。
その後の展開について少し述べる。2-2-2項で述べたように無機―生体ハイブリッド系の反応を2つの反応の共役と捉えれば、それぞれの段階を別の反応に置き換えることで新たな無機―生体ハイブリッド系の構築が可能である。筆者は現在、光触媒側の反応 (図2のStep ) を有機光増感剤による反応19)や、可視光応答型の無機半導体へ変更する20)ことで、可視光駆動型の水素生成反応を構築している。生体触媒側 (図2のStep ) もヒドロゲナーゼから他の酸化還元酵素に変更し、水素以外の有用化合物を光エネルギーによって生産する新規な反応系を構築するべく検討を重ねているところである。
また、無機―生体ハイブリッド系について生体触媒を中心に捉えると、反応の進行にエネルギー (NAD(P)Hからの還元力など) の投入が必要な酸化還元酵素の反応を、光によって駆動する反応系とも捉えられる。例えば、ギ酸デヒドロゲナーゼ (FDH) によるCO2とNADHからギ酸とNAD+を生成する反応について考える。この反応を続けるにはNADHを反応系に添加し続けるか、補酵素再生系を組み合わせる必要がある。ある種のFDHはNADHの代わりに還元型MVを人工的な補酵素として利用できる21)ため、本稿で紹介したような無機半導体によるMVの光触媒的還元反応を組み合わせることで、光駆動型のCO2からのギ酸生成が可能になる22)。酵素応用においてしばしば課題となるエネルギー (補酵素からの還元力) の供給問題を、無機―生体ハイブリッド系をうまく応用することで解決できることもあるだろう。実際、CO2からのギ酸生産22,23)や、アンモニア合成24)などの報告があり、適用例は今後も拡大するものと考えられる。
以上、生体触媒の特長をうまく活用することで、光エネルギーと電子源 (水であるのが望ましいが実際には難しい) から有用物質を生産する無機―生体ハイブリッド 型光触媒反応について紹介してきた。各報告をよく読めば、生成物より電子源が高価である場合もあり、すぐに実用化といった段階にある領域ではないが、コンセプトとして大変面白い反応系であると感じている。無機固体化学と酵素工学の両分野の融合領域にある研究と言えるが、2-2節で紹介したように、精製酵素から組換え腸菌の休止菌体反応に置き換えるといった酵素工学的には単純な実験系の適用であっても意義が見出される研究領域であり、今後、酵素工学や応用生物化学の知見をより深く幅広く導入することで、無機―生体ハイブリッド系のさらなる発展が期待できると考えている。
謝辞
本稿で紹介した研究は、九州大学カーボンニュートラル・エネルギー国際研究所、石原達己先生の研究部門に所属した際に開始し、石原先生をはじめ伊田進太郎先生 (現熊本大学)、萩原英久先生 (現富山大学)、渡邊源規先生に多くの助言をいただきました。また、微生物や酵素の嫌気条件での取り扱いに関しては大島敏久先生や岡島俊英先生にご助言いただきました。この場を借りて御礼申し上げます。
文献
1) 経済産業省資源エネルギー庁「ようこそ!水素社会へ〜 水素・燃料電池政策について」
https://www.enecho.meti.go.jp/category/saving_and_new/advanced_systems/hydrogen/ (2020年2月5日)
2) Chen, X., Shen, S., Guo, L., Mao, S. S.: Chem. Rev., 110, 6503 (2010).
3) Fujishima, A., Honda, K.: Nature, 238, 37 (1972).
4) Watanabe, M., Honda, Y., Hagiwara, H., Ishihara, T.: J. Photochem. Photobiol. C. Photochem. Rev., 33, 1 (2017).
5) Lee, C.-Y., Zou, J., Bullock, J., Wallace, G. G.: J. Photochem. Photobiol. C. Photochem. Rev., 39, 142 (2019).
6) Reisner, E., Fontecilla-Camps, J. C., Armstrong, F. A.: Chem. Commun., 550 (2009).
7) Reisner, E., Powell, D. J., Cavazza, C., Fontecilla-Camps, J. C., Armstrong, F. A.: J. Am. Chem. Soc., 131, 18457 (2009).
8) Brown, K. A., Wilker, M. B., Boehm, M., Dukovic, G., King, P. W.: J. Am. Chem. Soc., 134, 5627 (2012).
9) Brown, K. A., Dayal, S., Ai, X., Rumbles, G., King, P. W.: J. Am. Chem. Soc., 132, 9672 (2010).
10) Lubitz, W., Ogata, H., Rudiger, O., Reijerse, E.: Chem. Rev., 114, 4081 (2014).
11) Cuendet, P., Rao, K. K., Gratzel, M., Hall, D. O.: Biochimie, 68, 217 (1986).
12) Nikandrov, V. V., Shlyk, M. A., Zorin, N. A., Gogotov, I. N., Krasnovsky, A. A.: FEBS Lett., 234, 111 (1988).
13) Honda, Y., Hagiwara, H., Ida, S., Ishihara, T.: Angew. Chem. Int. Ed., 55, 8045 (2016).
14) Honda, Y., Watanabe, M., Hagiwara, H., Ida, S., Ishihara, T.: Appl. Catal. B Environ., 210, 400 (2017).
15) Kuchenreuther, J. M., Grady-Smith, C. S., Bingham, A. S., George, S. J., Cramer, S. P., Swartz, J. R.: PloS one, 5, e15491 (2010).
16) King, P. W., Posewitz, M. C., Ghirardi, M. L., Seibert, M.: J. Bacteriol., 188, 2163 (2006).
17) Jones, R. W., Garland, P. B.: Biochem. J., 164, 199 (1977).
18) Slein, M. W., Logan, G. F.: J. Bacteriol., 94, 934 (1967).
19) 本田裕樹、篠原優佳、藤井浩: 日本農芸化学会2020年度大会講演要旨集, 4A16a11 (2020).
20) 篠原優佳、本田裕樹、渡邊源規、石原達己、藤井浩: 日本農芸化学会2020年度大会講演要旨集, 4A16a12 (2020).
21) Amao, Y., Ikeyama, S.: Chem. Lett., 44, 1182 (2015).
22) Ishibashi, T., Ikeyama, S., Ito, M., Ikeda, S., Amao, Y.: Chem. Lett., 47, 1505 (2018).
23) Miller, M., Robinson, W. E., Oliveira, A. R., Heidary, N., Kornienko, N., Warnan, J., Pereira, I. A. C., Reisner, E.: Angew. Chem. Int. Ed., 58, 4601 (2019).
24) Brown, K. A., Harris, D. F., Wilker, M. B., Rasmussen, A., Khadka, N., Hamby, H., Keable, S., Dukovic, G., Peters, J. W., Seefeldt, L. C., King, P. W.: Science, 352, 448 (2016).