【トピックス】
ルシフェラーゼ
大場裕一
中部大学・応用生物、JST・CREST
1.はじめに
「光を授ける者」を意味する「ルシファー」にちなんで19世紀の仏生理学者ラファエル・デュボアによって命名された「ルシフェラーゼ」は、発光反応を触媒する酵素として数多ある酵素の中でも異彩を放つ存在である。では、発光生物たちは、この特殊な酵素をそれぞれどのように獲得したのだろう。本編では、我々が最近解明した発光キノコと発光ゴカイとキンメモドキのルシフェラーゼに関する話題を中心に、いろいろなルシフェラーゼの進化と由来について概観する。なお、フォトプロテイン (発光タンパク質) は、ルシフェリンとルシフェラーゼの安定複合体とみなすことができるので、ここでは便宜的にフォトプロテインをルシフェラーゼと同列に扱う。
2.ホタルのルシフェラーゼ:由来のはっきりしている唯一のルシフェラーゼ
発光生物は、進化の過程でそれぞれ独立に発光メカニズムを獲得しているので、ルシフェリン (発光基質) の化学構造とルシフェラーゼ (発光酵素) のアミノ酸配列は、基本的に生物分類群ごとにそれぞれ異なっている。例えば、ホタル (図1A) とウミホタル (図5C) はどちらも節足動物であるが、各々のルシフェリン分子の化学構造には (窒素と酸素を含み、長い共役系があることを除けば) 似たところがない (図1B, 図5D)。また、両者のルシフェラーゼは、たまたま500アミノ酸くらいとサイズは似ているが、配列相同性は全く見られない。
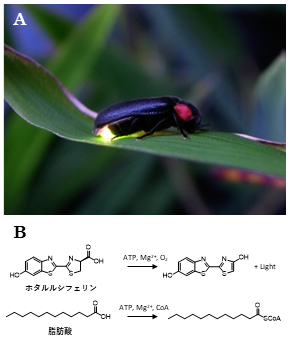

一方、ホタルのルシフェラーゼは、β酸化に関わる酵素のひとつである「脂肪酸CoA合成酵素」と明らかな相同性があり、このことからホタルのルシフェラーゼは脂肪酸CoA合成酵素から進化したと考えられている。実際、ホタルのルシフェラーゼ自体には、脂肪酸CoA合成酵素活性がある (図1B)1)。また、ホタルの全ゲノムを解読してみると、ルシフェラーゼ遺伝子の前後にタンデムに脂肪酸CoA合成酵素がずらりと並んでいる2)。まさに、新しい機能を持った遺伝子が進化する際のセオリー〈遺伝子重複による進化〉3)のとおりである。
最近、ヒカリキノコバエArachnocampaのルシフェラーゼも脂肪酸CoA合成酵素と似た酵素かもしれないという報告が出された4)。さらに、ホタルイカWataseniascintillansのルシフェラーゼも脂肪酸CoA合成酵素に似た酵素である可能性を示唆する論文が報告された5)。これらの報告の真偽については、私は未だ懐疑的な見方をしているが、もしこれが事実ならば酵素の進化における顕著な収斂現象として極めて興味深い。ちなみに、ヒカリキノコバエのルシフェリン分子の構造は未知であり、ホタルイカのルシフェリンはホタルのルシフェリンとは全く異なる構造の物質 (硫酸化セレンテラジン) であることがわかっている。そもそも脂肪酸CoA合成酵素は一般に基質選択性が緩く、もともとルシフェラーゼに進化しやすいポテンシャルを持っているといえるのかもしれない6)。
3.由来の手がかりがあるルシフェラーゼ
ホタル以外の発光生物のルシフェラーゼは、由来がよく分からない。ただし、刺胞動物ウミシイタケRenillareniformisのルシフェラーゼは、細菌のハロアルカンデハロゲナーゼと約40%という高い相同性を持っている。また、オワンクラゲAequorea victoriaのフォトプロテインであるイクオリンは、カルシウム結合モチーフを持っている。トビイカSthenoteuthis oualaniensisのフォトプロテインであるシンプレクチンには、ビオチニダーゼと30%の相同性が見られる。ウミホタルのルシフェラーゼは、ショウジョウバエに知られるcrossveinless-2という翅脈形成に関わる分泌性タンパク質の遺伝子と20%程度の弱い相同性が見られる。これらの例は、それぞれの由来を示唆するものであるが、ホタルの場合のような進化的な詳しい研究は行われていない。ちなみに、発光反応は基質の酸化反応であるが、ホタルも含めて、オキシダーゼに由来したルシフェラーゼの例がひとつもない点は特筆に値する7)。
なお、ウミシイタケとオワンクラゲにおける発光基質には、セレンテラジン (図2C) という共通の物質が使われており、トビイカのシンプレクチンにもセレンテラジンのデヒドロ体が結合していると考えられている。このように生物分類群を超えて共通の発光基質が使われているのは、海洋における食物連鎖のためだと考えられ8)、発光生物の進化という観点から興味深いが (図2A, B)、本編の主旨からやや外れるので詳しい説明は割愛する。ただし、注目すべき点は、発光基質が同じでも各ルシフェラーゼのアミノ酸配列には共通性が見られないことである。すなわち、それぞれの発光生物は、発光基質は同じでも、ルシフェラーゼはそれぞれ独自に進化させたものを使っているのだ。


4.発光キノコ:由来が不明なルシフェラーゼ
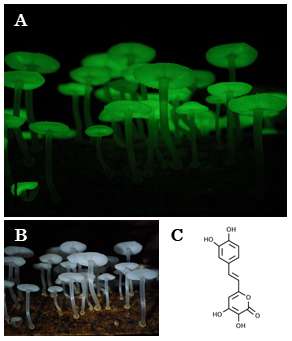
発光キノコ (図3A, B) の発光メカニズムが、ロシア科学アカデミーと我々のグループによって最近ようやく解明された9,10)。ルシフェリンは、これまでにも非発光性のキノコ (主に漢方キノコ) に生理活性物質として知られていたヒスピジンという物質にヒドロキシル基が1つ付加した「3-ヒドロキシヒスピジン」であった (図3C)。キノコ全般におけるヒスピジンの役割は不明であるが、発光キノコのルシフェリンがヒスピジンから誘導されていることは明らかである (ヒスピジンから3-ヒドロキシヒスピジンに変換する酵素も発光キノコから単離されている)。一方のルシフェラーゼ遺伝子は、これまでに知られている他の生物のルシフェラーゼとの相同性が見られない。ただし、非発光性のキノコやカビのゲノム中にも低いながら相同性の見られる機能未知の遺伝子が見つかるので、この場合はまったく由来の手がかりがないというわけではない。

5.発光ゴカイ:ルシフェリンもルシフェラーゼも由来がわからない
バクテリア、渦鞭毛藻、ヒカリニオガイPholas、ヒオドシエビOplophorus、カイアシ類 (図2A) など、ルシフェラーゼのアミノ酸一次配列が明らかになっている発光生物は他にもあるが、その中に他の既知のタンパク質と有意な相同性が認められるものはない。その顕著な例のひとつとして、最近我々が明らかにしたクロエリシリスOdontosyllis undecimdonta (図4A, B) という発光ゴカイのルシフェラーゼについて紹介したい。なお、「我々が明らかにした」と書いたが、厳密にいうとまず近江谷らによって特許が出願され11)、次に我々が論文を発表12)、続いて三谷らがクロエリシリスとプエルトリコ産の同属未知種のルシフェラーゼ遺伝子を発表した13,14)。長いあいだ謎に包まれていた発光ゴカイのルシフェラーゼ遺伝子がこれだけ短期間に次々と報告されたというのも興味深い。
明らかになった発光ゴカイのルシフェラーゼ遺伝子は、既知の遺伝子と全く相同性が見当たらず、GenBankの全遺伝子データベースを検索しても有意にヒットするものは何もなかった。このことは、クロエリシリスのルシフェラーゼには進化的な由来の痕跡が見つからないことを意味する。クロエリシリスの発光は、補因子を必要としない単純なルシフェリンとルシフェラーゼによる反応であり、ルシフェリンの化学構造は2019年にロシア科学アカデミーと我々の共同研究により決定された15)。その構造は硫黄を含んだ3環性の化合物で、化学構造がわかっている他のどのルシフェリンにも似ていないばかりでなく、天然有機化合物の中でも新規な骨格を持っていた (図4C)。すなわち、クロエリシリスの発光反応は、ルシフェリンもルシフェラーゼも由来がまるでわからないのである。
6. キンメモドキ:他者のルシフェラーゼをそのまま使う「盗タンパク質」
浅海性の発光魚キンメモドキ (図5A, B) は、食べたウミホタル類 (図5C) からルシフェリン (図5D) を得ていることで知られている。しかし、ルシフェラーゼの正体は長い間不明であった。そもそも、発光する魚類は世界に1500種以上が知られており、その半数くらいは発光バクテリアを発光器に住まわせて発光する「共生発光」魚であるが、自分自身で発光している残りの「自力発光」魚のルシフェラーゼはこれまでひとつもその実体が明らかになっていなかった。
そこでキンメモドキのルシフェラーゼの解明を試みたところ、我々自身も驚く意外な結果が得られたのである。なんと、そのルシフェラーゼはウミホタルのルシフェラーゼそのものだった。キンメモドキは、ルシフェリンのみならず、ルシフェラーゼもウミホタルから手に入れていたのだ16)。
「食べ物から摂取したタンパク質は、胃酸で変性され消化酵素によって個々のアミノ酸レベルにまで消化されたのちに腸壁から吸収される」というのがこれまでの一般常識である。ところが、キンメモドキはこの常識をひっくり返し、食べたウミホタルが持っていたルシフェラーゼをそのまま酵素として発光器に輸送して発光反応に使っていたのである。我々は、この全く新しい生命現象を「盗タンパク質」Kleptoproteinと名付けた。もしかするとKleptoproteinでルシフェラーゼを手に入れている発光魚はまだ他にもいるのかもしれない。いや、酵素を盗んできて使うというストラテジーは、発光生物を超えて広く存在している可能性さえある。
7.おわりに
クロエリシリスのルシフェラーゼは、まるで突如現れたかのように他のタンパク質との類似性を欠いていた。発光キノコのルシフェラーゼは、非発光性のキノコのゲノムの中にも似た配列を持つ遺伝子が見つかるが、機能のわかっているタンパク質との類似性は見当たらない。一方、ホタルのルシフェラーゼの場合は、それが酸化反応とは関係のない脂肪酸CoA合成酵素に由来することが分かった。これらのことから読み取れるのは、発光形質の進化において重要なのはむしろルシフェリンの側だということである。たとえば、セレンテラジンはBSAに加えても弱く発光するし、ウミホタルのルシフェリンはなんとマヨネーズに混ぜるだけでも発光してしまう8)。つまり、発光に適した基質さえ手に入れば、ルシフェラーゼはその反応に適した内部環境 (例えば疎水的環境) を与えうるものであれば「なんでもよい」かのように見える。さらには、キンメモドキの研究から明らかになったように、ルシフェリンといっしょにルシフェラーゼも他者から盗んでくる発光生物までいる。まさに、ルシフェラーゼの進化は「ブリコラージュ」 (解決方法は手近な材料でいかようにもできる鋳掛屋仕事) 17)そのものなのである。
ルシフェラーゼという特殊な酵素の成り立ちを読み解くことで、酵素一般を理解する手がかりが得られれば幸いである。
謝辞
本研究の一部は、科学技術振興機構CREST (JPMJCR16N1) の支援を受けたものである。天然有機化合物の構造と新規性については、星薬科大学の叶直樹教授にご意見をいただいた。
文献
1) 大場裕一: 酵素工学ニュース, 51, 17 (2004).
2) Fallon, T. R., Lower, S. E., Chang, C. -H., Bessho-Uehara, M., Martin, G. J., Bewick, A. J., Behringer, M., Debat, H. J., Wong, I., Day, J. C., Suvorov, A., Silva, C. J., Stanger-Hall, K. F., Hall, D. W., Schmitz, R. J., Nelson, D. R., Lewis, S., Shigenobu, S., Bybee, S. M., Larracuente, A. M., Oba, Y., Weng, J. -K.: eLife, 7, e36495 (2018).
3) S. オオノ: 遺伝子重複による進化, 岩波書店 (1977).
4) Watkins, O. C., Sharpe, M. L., Perry, N. B., Krause, K. L.: Sci. Rep., 8, 3278 (2018).
5) Gimenez, G., Metcalf, P., Paterson, N. G., Sharpe, M. L.: Sci. Rep., 6, 27638 (2016).
6) Adams, S. T. Jr., Miller, S. C.: FEBS J., (in press) doi:10.1111/febs.15176.
7) 大場裕一, 井上 敏: 化学と生物, 45, 681 (2007).
8) 大場裕一: 恐竜はホタルを見たか, 岩波書店 (2016).
9) Purtov, K. V., Petushkov, V. N., Baranov, M. S., Mineev, K. S., Rodionova, N. S., Kaskova, Z. M., Tsarkova, A. S., Petunin, A. I., Bondar, V. S., Rodicheva, E. K., Medvedeva, S. E., Oba, Y., Oba, Y., Arseniev, A. S., Lukyanov, S., Gitelson, J. I., Yampolsky, I. V.: Angew. Chem. Int. Ed., 54, 8124 (2015).
10) Kotlobay, A. A., Sarkisyan, K. S., Mokrushina, Y. A., Marcet-Houben, M., Serebrovskaya, E. O., Markina, N. M., Somermyer, L. G., Gorokhovatsky, A. Y., Vvedensky, A., Purtov, K. V., Petushkov, V. N., Rodionova, N. S., Chepurnyh, T. V., Fakhranurova, L. I., Guglya, E. B., Ziganshin, R., Tsarkova, A. S., Kaskova, Z. M., Shender, V., Abakumov, M., Abakumova, T. O., Povolotskaya, I. S., Eroshkin, F. M., Zaraisky, A. G., Mishin, A. S., Dolgov, S. V., Mitiouchkina, T. Y., Kopantzev, E. P., Waldenmaier, H. E., Oliveira, A. G., Oba, Y., Barsova, E., Bogdanova, E. A., Gabaldon, T., Stevani, C. V., Lukyanov, S., Smirnov, I. V., Gitelson, J. I., Kondrashov, F. A., Yampolsky, I. V.: Proc. Natl. Acad. Sci. USA, 115, 12728 (2018).
11) Ohmiya, Y., Mitani, Y., Yasuno, R.: WO2017/155036A1(2017).
12) Schultz, D. T., Kotlobay, A. A., Zingashin, R., Bannikov, A., Markina, N. M., Chepurnyh, T. V., Shakhova, E. S., Palkina, K., Haddock, S. H. D., Yampolsky, I. V., Oba, Y.: Biochem. Biophys Res. Commun., 502, 318 (2018).
13) Mitani, Y., Yasuno, R., Isaka, M., Mitsuda, N., Futahashi, R., Kamagata, K., Ohmiya, Y.: Sci. Rep., 8, 12789 (2018).
14) Mitani, Y., Yasuno, R., Futahashi, R., Oakley, T. H., Ohmiya, Y.: Sci. Rep., 130, 13015 (2019).
15) Kotlobay, A. A., Dubinnyi, M. A., Purtov, K. V., Guglya, E. B., Rodionova, N. S., Petushkov, V. N., Bolt, Y. V., Kublitski, V. S., Kaskova, Z. M., Ziganshin, R. H., Nelyubina, Y. V., Dorovatovskii, P. V., Eliseev, I. E., Branchini, B. R., Bourenkov, G., Ivanov, I. A., Oba, Y., Yampolsky, I. V., Tsarkova, A. S.: Proc. Natl. Acad. Sci. USA, 116, 18911 (2019).
16) Bessho-Uehara, M., Yamamoto, N., Shigenobu, S., Mori, H., Kuwata, K., Oba, Y.: Sci. Adv., 6, eaax4942 (2020).
17) フランソワ・ジャコブ: 可能世界と現実世界 進化論をめぐって, みすず書房 (1994).