【トピックス】
電子メディエータの光レドックスを介した酵素触媒による二酸化炭素の還元
天尾 豊
阪市大・複合先端研、阪市大・人工光合成研究セ
1.はじめに
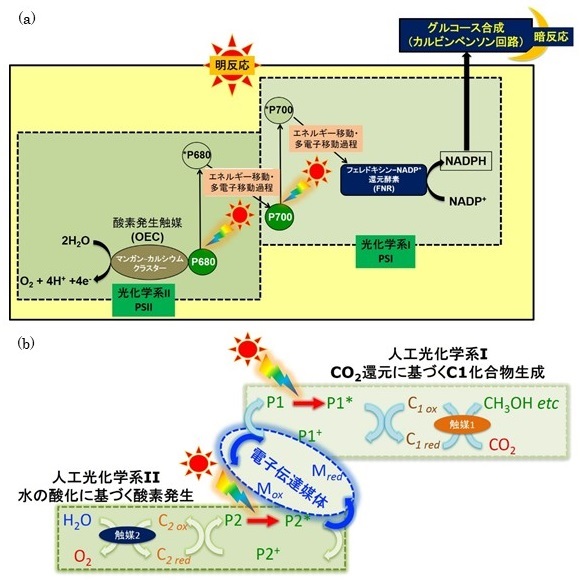
二酸化炭素排出を抑制し、化石燃料非依存型の低 (あるいは脱) 炭素社会を構築するためには、太陽光エネルギー、水素、メタノール、エタノール、燃料電池など再生可能エネルギーや低炭素エネルギーを活用し、二酸化炭素排出抑制型低炭素燃料の効率的生産・利用技術を確立することが重要である。太陽光エネルギーを利用した水分解に基づく水素製造は、1970年代前半の本多ー藤嶋効果1)以来酸化チタンに代表される半導体光触媒を用いた系 (光触媒系) を皮切りに、有機色素分子ー触媒系 (分子触媒系)、生体材料を直接利用した系 (生体触媒系)、これらの系を複合したハイブリッド型触媒系など多種多様である。中でも近年では太陽光エネルギーによる二酸化炭素の燃料化・資源化のための多様な研究も進められている。二酸化炭素は様々な有機化合物の最終酸化物であるため、二酸化炭素を有機分子に還元・変換するためには外部エネルギーが必要である。太陽光を外部エネルギーとして利用できれば、再生可能エネルギーを用いた二酸化炭素を還元・変換することが可能となる。太陽光エネルギーを駆動力、二酸化炭素を原料として炭素数の少ないメタノールやエタノール等低炭素燃料に変換する反応系は、太陽エネルギーを利用して水と二酸化炭素から酸素発生と同時にグルコースを合成する天然光合成を手本にした「人工光合成」という位置付けになる2)。太陽光エネルギーを利用し、水と二酸化炭素から酸素とグルコースを生成する酸素発生型光合成反応は、二酸化炭素を原料とした有機化合物合成を目的とする人工光合成技術の良い手本となる。酸素発生型光合成は図1aに示すように太陽光で駆動する明反応と明反応で生成した還元力NADPHを利用して二酸化炭素を多段階反応でグルコースに変換する暗反応がある。明反応ではP700と呼ばれる反応中心を持つNADP+の光還元系 (光化学系I・PSI) とP680と呼ばれる反応中心を持つ水を光酸化して酸素を生成する系 (光化学系II・PSII) が連結したZスキーム型反応過程である。酸素発生型光合成反応は明反応だけでおよそ30段階のエネルギー移動・電子移動過程があり、各段階の効率が100%で進む驚異的なシステムを達成している。次いで明反応で生成したNADPHを利用し、カルビンベンソンサイクルと呼ばれる暗反応中でおおよそ10段階の過程を経て二酸化炭素がグルコース・デンプンに変換される。このような多段階かつ非常に複雑な光合成過程を人工的にしかも高効率な過程を実現しつつ模倣することは現実的には不可能である。しかしながら、太陽エネルギーを利用して二酸化炭素を有機分子に還元・変換する反応を人工光合成技術として実用的技術に展開する場合、光合成反応の必要不可欠な段階を単純化することが重要課題である。必要不可欠な要素は、電子供与分子、太陽光捕集・増感分子、電子伝達分子及び二酸化炭素利用のための触媒であり、これらをできる限り効率的に連携したシステムを構築すればよい。図1bに可視光増感剤 (P)、電子メディエータ (C) 及び触媒からなる酸素発生型光合成を模倣した水を電子源とした二酸化炭素の光還元のための人工光合成系の概要を示している。これまでに人工光化学系IとIIを分け、犠牲的還元あるいは酸化剤存在下でそれぞれの系について様々な研究が進められている。人工光合成系の中でも、低炭素エネルギーの代表格であるメタノールを二酸化炭素から太陽光エネルギーを用い還元して作り出せれば、石炭火力発電所や製鐵所で排出される回収二酸化炭素を積極的に利用した低炭素社会への展開も可能となる。しかしながら、太陽光エネルギーを用い二酸化炭素からメタノールを生成する人工光合成系の達成はハードルが高く、現状では太陽光エネルギーを用いて二酸化炭素を還元し一酸化炭素やギ酸に変換する人工光合成系が主流であり、金属微粒子担持半導体光触媒系や金属錯体を基盤とした分子触媒系等が報告されている3-8)。これらの系では、効率向上も含めて研究が進められているが、生成物がギ酸に加えて一酸化炭素や水素が同時に生成するため、一酸化炭素やギ酸以外で二酸化炭素還元由来でない副生成物をいかに抑制するかが問題である。これに対して、酵素を用いた反応系では、高い反応選択性の特徴を生かし、二酸化炭素還元に基づく生成物のみにすることができる。
本稿では、酵素と天然補酵素に替わる簡単な化学構造を持つ電子メディエータの光還元を連動させた可視光エネルギーによる二酸化炭素のメタノールへの光還元系について紹介する。
![]()
2.二酸化炭素をメタノールへ光還元するためには酵素をどのように使えばよいか
2-1 酵素を用いた二酸化炭素のメタノールへの還元
水素ガスのような強い還元剤を使わずに二酸化炭素をギ酸やメタノールのようなC1化合物に還元するためには、水素イオンを協奏させ多電子還元することが必要である。二酸化炭素をギ酸あるいは一酸化炭素に還元するためには、2個の水素イオンと2個の電子がそれぞれ必要である。二酸化炭素を4個の水素イオンとともに4電子還元するとホルムアルデヒドに、6個の水素イオンとともに6電子還元するとメタノールに、8個の水素イオンとともに8電子還元するとメタンにまで還元されることになる (図2)9)。 現状では単一あるいは複合型の固体触媒や分子触媒を用いた反応では、例えば二酸化炭素をギ酸、ホルムアルデヒドへ逐次的に還元し、最終的にメタノールを生成させるためには、1つの触媒に複数の活性部位を設計する必要があるため非常にハードルの高い技術となっており、水素イオンと協奏させた多電子還元反応系は達成できておらず、一酸化炭素やギ酸が生成する2電子還元が限界である。これに対して、二酸化炭素からメタノールまでの6つの水素イオン協奏型6電子還元反応が逐次的に進行するとした場合、逐次過程を素反応に分け、それぞれの反応を触媒する酵素を用いれば技術的なハードルを下げることができる。補酵素NADH存在下で、FDHは二酸化炭素をギ酸に、FldDHはギ酸をホルムアルデヒドに、ADHはホルムアルデヒドをメタノールにそれぞれ還元する反応を触媒する。つまり共通の補酵素NADHを共存させることによってFDHを用いて二酸化炭素が還元され生成したギ酸を、FldDHとADHによりホルムアルデヒドを経由してメタノールに還元できる (図3)。 Candida boidinii由来FDH、Pseudomonas sp.由来FldDH及びYeast由来ADHは市販で手に入りやすく、二酸化炭素のメタノールへの還元触媒として魅力的な生体触媒である。例えばNADHを還元的犠牲剤としたこのシステムを用いると、二酸化炭素を出発原料とし、NADHからメタノールへの変換効率は21 %であると報告されている10)。この3つの複合酵素を用いた二酸化炭素のメタノールへの還元は、補酵素かつ酸化還元メディエータであるNADHが存在することにより進行することから、光エネルギーを利用したメディエータの酸化還元と酵素とを連動させることによって、二酸化炭素がメタノールに還元されるいわゆる人工光合成系を組み立てることができる。
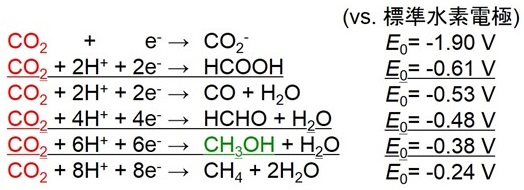
図2 水素イオン協奏型多電子還元に基づく二酸化炭素のC1化合物への変換
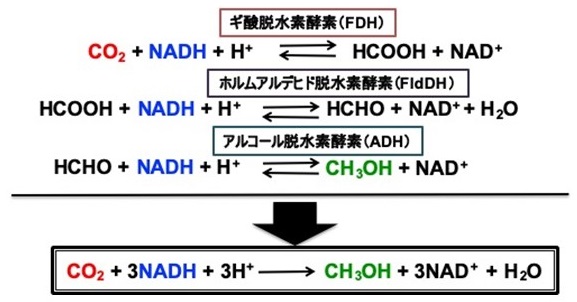
図3 RDH、FldDH及びADHを触媒、NADHを還元剤とする二酸化炭素のメタノールへの還元
2-2 酵素を触媒として用いた二酸化炭素のメタノールへの光還元
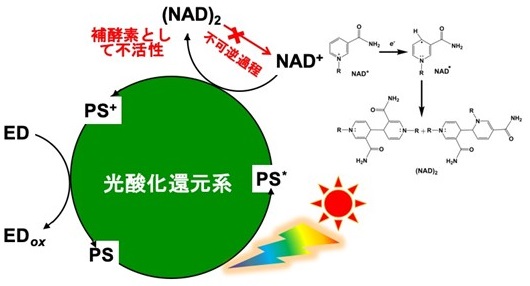
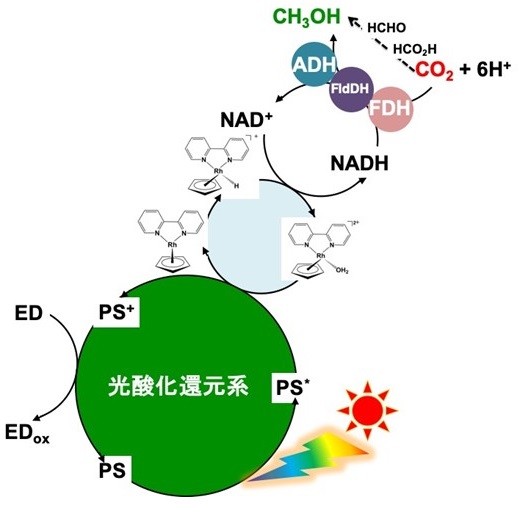
FDH、FldDH及びADHを触媒として二酸化炭素をメタノールへ還元するためにはNADHが共通の補酵素であることから、単純なアイディアとして水溶性亜鉛ポルフィリンやルテニウム錯体のような可視光増感剤を利用して、NAD+をNADHに光還元できれば、3つの脱水素酵素の触媒機能により、二酸化炭素がギ酸、ホルムアルデヒドを経てメタノールに逐次的に還元できる。しかしながら、光酸化還元系で広く用いられている可視光増感剤では直接NAD+をNADHに2電子還元することはできず、さらに図4に示すように一電子還元されたNAD+同士が二量化し、補酵素として不活性化してしまう。そこで、可視光増感剤で確実にNAD+をNADHに還元するために、ロジウム錯体をヒドリド媒体として加えたシステムが考案されている (図5)。この系ではポルフィリン等の可視光増感剤でロジウム錯体を還元・ヒドリド化し、得られたヒドリドを用いて、NAD+をNADHに還元するものである。この系では一電子還元されたNAD+同士での二量化が抑制でき、FDH、FldDH及びADHを触媒とし、NADHを補酵素とする二酸化炭素のメタノールへの還元系が達成できる。例えば、グラフェンを化学的にポルフィリンに結合した光触媒材料を可視光増感剤として用い、ロジウム錯体 (0.62 µmol)、NAD+ (1.24 µmol)、FDH、FldDH、ADH (各 9.0 units) 及びトリエタノールアミン (1.24 mmol) を含む二酸化炭素を飽和したリン酸塩緩衝液に1時間可視光照射すると、34.7 nmolのメタノールが生成する11)。しかしながら、NAD+/NADHの酸化還元系を用いた場合では、脱水素酵素の還元触媒機能を向上させることは不可能である。なぜならば、NAD+あるいはNADHとそれぞれの脱水素酵素との親和性はpHや温度変化等で多少の変化はあるものの大きく変えることはできず、脱水素酵素の触媒活性中心構造を遺伝工学的手法によって変化させない限り、天然補酵素を用いた場合での酵素触媒機能向上には限界がある。また仮に触媒活性中心の構造を変えたところで飛躍的な活性向上は期待できない (一般的にも数倍向上する程度である)。さらにはNAD+やNADH等の高価な補酵素を利用する点も現実的ではない。また、せっかく光酸化還元系でNAD+からNADHを生成させても、NADHはトリエタノールアミンと同じく犠牲還元剤として光酸化還元系に作用してしまう欠点がある。
![]()
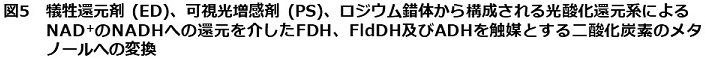
一方、筆者らは古くから光レドックス系において電子メディエータとして用いられてきたメチルビオローゲンに代表される1,1'-ジアルキル-4,4'-ビピリジニウム塩 (4,4'-BP) をNAD+の代替え補酵素として注目している。4,4'-BPはポルフィリン等の可視光増感反応や電気化学的反応により容易に一電子還元される。一電子還元された4,4'-BPはFDHの補酵素として作用し、二酸化炭素がギ酸に還元されることが見出されている。Willnerらは可視光増感剤としてルテニウムトリスビピリジン (Ru(bpy)32+)、電子メディエータとしてメチルビオローゲン、犠牲的還元剤としてメルカプトエタノールおよびFDHを含む二酸化炭素を飽和した緩衝溶液に可視光を照射すると、二酸化炭素が還元されギ酸が生成することを始めて報告している12,13)。筆者らも、可視光増感剤として水溶性亜鉛ポルフィリンやクロロフィル-αを用いたメチルビオローゲンの光還元を介したFDHによる二酸化炭素のギ酸への還元系を構築している14-16)。上述のNADHと同じくメチルビオローゲンの一電子還元体 (MV・) がFDHに加えてFldDHとADHの補酵素として機能すれば、図6に示すような可視光で駆動する二酸化炭素のメタノールへの還元系が構築できる。この系では、可視光増感剤によるメチルビオローゲンの光還元系と3つの酵素が直接連結するため、上述のNAD+/NADHの光酸化還元系を用いたものよりも単純化できる。またメチルビオローゲンを電子メディエータとして用いるメリットとして、3つの酵素にはMV・のみが作用するため、それぞれの酵素が触媒する還元反応のみを取り出すことができる。筆者らは、可視光増感剤として亜鉛テトラフェニルポルフィリンテトラスルフォナート (ZnTPPS) を用いたメチルビオローゲンの光還元系に3つの酵素 (FDH、FldDH及びADH) を添加し可視光で駆動する二酸化炭素のメタノールへの還元系を構築している17-19)。具体的な反応例として、犠牲還元剤トリエタノールアミン (0.9 mmol)、ZnTPPS (0.3 nmol)、メチルビオローゲン (0.3 mmol) を含む二酸化炭素を飽和したpH7.0のリン酸緩衝溶液にFDH、FldDH及びADHをそれぞれ12.5 units加え、可視光照射すると反応時間とともにメタノールが生成し、光照射4時間後のメタノール生成量は1.5 nmolである。さらに反応溶液を分析すると約50倍のギ酸が生成している。この時のFDH、FldDH及びADHの酵素活性量はそれぞれの酵素が触媒する酸化反応時の値であることから、溶液中に含まれる各酵素濃度は統一化されていない。市販されているCandida boidinii由来FDH、Pseudomonas sp.由来FldDH及びYeast由来ADHの分子量から筆者らの反応系での各酵素の物質量を見積もると、それぞれ25.4、0.26及び6.34 μmolとなり、かなり差が見られる。そこで、3つの酵素の物質量を 6.0 nmolに統一し、トリエタノールアミン (0.9 mmol)、ZnTPPS (0.3 nmol)、メチルビオローゲン (0.3 mmol) を含む二酸化炭素を飽和したpH7.0のリン酸緩衝溶液に1時間光照射すると、メタノール生成量は12.0 nmolにまで向上する19)。
![]()
以上のように一般的な触媒反応では困難であった6個の水素イオンを協奏させた6電子還元に基づく二酸化炭素からメタノールへの光還元系を複数の生体触媒と可視光増感剤による電子メディエータの光還元と複合させることによって達成できている。
さらに可視光増感剤による電子メディエータの光還元と複数の生体触媒との連動による二酸化炭素からメタノールへの光還元系の効率を上げるためには、電子メディエータとそれぞれの生体触媒との直接的な相互作用の解明が鍵となる。ここでの直接的な相互作用の一つの目安として、酵素反応速度論から得られる速度パラメータが有用な要素となる。次章では、NADHやMV・とFDH、FldDHあるいはADHとの相互作用について酵素反応速度論に基づく考察を紹介する。
3.酵素反応速度論解析に基づく電子メディエータと酵素との相互作用
最初にMV・によるFDHの二酸化炭素還元触媒活性について、酵素反応速度論に基づく解析について述べる20-22)。具体的な実験方法として、還元剤であるジチオン酸ナトリウムを用いてメチルビオローゲンを一電子還元してMV・を調製し、二酸化炭素を飽和させたピロリン酸ナトリウム緩衝液 (pH 7.4) 中、FDH存在下で反応させ、ギ酸生成初速度とMV・濃度との関係を調べている。同様にNADHを含む二酸化炭素を飽和させたピロリン酸ナトリウム緩衝液 (pH 7.4) 中、FDH存在下で反応させ、ギ酸生成初速度を測定している。得られたギ酸生成速度から酵素基質複合体に対して定常状態近似を適用した酵素反応速度論的に解析し、速度パラメータをミカエリス‐メンテン式により見積もっている。FDHと基質との親和性の尺度であるミカエリス定数 (Km)を比較してみるとMV・よりもNADHの方が約10倍大きいことがわかる。これはNADHを用いてFDHの二酸化炭素還元触媒機能を利用するためには、MV・ (Km=213 µM) よりも約10倍のNADH (Km=2087 µM) が必要となることを示している。また、見かけの触媒定数 (kcat) を比較しても、MV・の1.02 min-1に対してNADHは0.39 min-1であり、触媒反応効率kcat/Kmを比較してもMV・の方がNADHよりも約25倍も大きいことがわかる。MV・を用いることでFDHの二酸化炭素還元触媒機能を有効利用ができることが明らかにされている。
次にMV・によるFldDHのギ酸還元触媒活性についても酵素反応速度論に基づいて解析されている。具体的な実験方法としてジチオン酸ナトリウムを用いてメチルビオローゲンを一電子還元してMV・を調製し、過剰量のギ酸を含むピロリン酸ナトリウム緩衝液 (pH 7.4) 中、FldDH存在下で反応させ、ホルムアルデヒド生成初速度とMV・濃度との関係を調べている。FDHの時と同様にMV・の代わりにNADHを用い、FldDH存在下でホルムアルデヒド生成初速度とNADH濃度との関係を調べている。得られたホルムアルデヒド生成初速度から酵素反応速度論的に解析し、速度パラメータを見積もっている。これまで筆者が調べた限りでは、なぜかNADHを用いたFldDHのギ酸還元触媒活性に関する酵素反応速度論に基づく速度パラメータが報告されていない。そこで筆者らはまず、NADHを用いたFldDHのギ酸還元触媒活性に関する酵素反応速度論に基づく速度パラメータを見積もると、事実、ギ酸のホルムアルデヒドへの還元は進行しない。これに対してMV・によるFldDHのギ酸還元触媒活性について調べると、FldDHの触媒機能によりギ酸のホルムアルデヒドへの還元が進行し、速度パラメータが求められている (Km=87.5 µM, kcat=25.7 min-1, kcat/Km=0.39 µM-1 min-1)23)。
最後に、MV・によるADHのホルムアルデヒド還元触媒活性についても酵素反応速度論に基づいて解析されている。具体的な実験方法としてジチオン酸ナトリウムを用いてメチルビオローゲンを一電子還元してMV・を調製し、過剰量のホルムアルデヒド (市販のホルムアルデヒドはメタノールが安定剤として含まれているため、実験ではメタノールを含まないホルムアルデヒドを窒素雰囲気下で調製する必要がある) を含むピロリン酸ナトリウム緩衝液 (pH 7.4) 中、ADH存在下で反応させ、メタノール生成初速度とMV・濃度との関係を調べている。NADHを用いたADH存在下でメタノール生成初速度とNADH濃度との関係から得られた速度パラメータは報告されている (Km=37 mM)。NADHを補酵素とした場合ではADHによるホルムアルデヒドのメタノールへの還元はほとんど進行しない。これに対してMV・によるADHのホルムアルデヒド還元に基づくメタノール生成の初速度から酵素反応速度論的に解析し、速度パラメータを見積もるとKm=311 µM, kcat=3.57 min-1, kcat/Km=0.01 µM-1 min-1がそれぞれ得られている19)。MV・を用いたFDHが触媒する二酸化炭素のギ酸への還元反応パラメータと比較すると、ADHが関与するホルムアルデヒドのメタノールへの還元効率が低いことがわかる。つまり二酸化炭素からメタノールへの還元の際にMV・を用いた3酵素のカスケード系では、ADHが関与する反応効率を上げる方法を見いだせば、効率的な二酸化炭素のメタノールへの還元系が達成できると予測される。
一方で、これらの結果からNAD+/NADHの酸化還元系を用いた場合において、本当に3つの酵素がカスケード的に作用し二酸化炭素のメタノールへの還元につながっているのか疑問が残る。特にFldDHが関与する過程ではNADHを用いてもギ酸はホルムアルデヒドに還元されないことを考慮すると例えば上述のロジウム錯体を反応系に組み込んだ系では、反応過程において大量のヒドリドが生じることから、本当に酵素の触媒機能なのか、生成したヒドリドによる還元なのか不明確である。これに対して、筆者らがこれまで進めてきたメチルビオローゲンの光還元系と3酵素との複合系では、MV・がそれぞれの酵素に確実に作用していることが示されており、またNADHよりもはるかに優れていることも実験的に証明されている。4,4'-BPは色々な置換基を導入することができ、簡単な化学構造をもつ小分子を補酵素とすることで酵素活性を向上させることも可能である。
4.おわりに
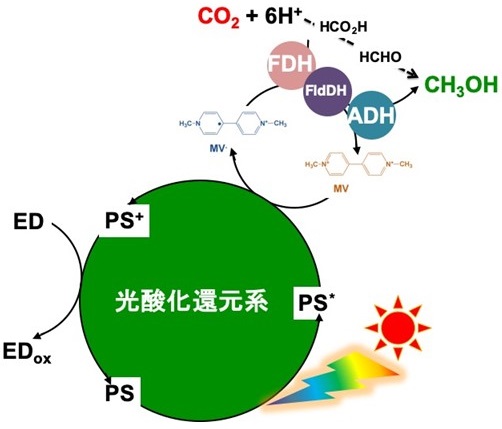
本項では有機・錯体分子を基盤とした可視光増感剤による電子メディエータの光還元と3つの脱水素酵素 (FDH、FldDH及びADH) とを連動させ二酸化炭素を還元し、燃料やエネルギーキャリアとして注目されるメタノールを生成するための反応系を紹介した。また、酵素と補酵素になりうる電子メディエータとの相互作用を酵素反応速度論的見地から考察した結果についても紹介した。酵素活性を向上させるためには一般的には遺伝子操作によって酵素自体の構造を変化させ、天然の補酵素を利用する試みが主流であるが、必ず機能発現の限界があるのではないかと考える。これに対して本稿では、市販の酵素自体に手を加えず、簡単な化学構造をもつ電子メディエータで酵素活性を向上させることに成功した例を示した。二酸化炭素還元や資源化反応を触媒する酵素に限らず、一般的に酵素は反応生成物選択性が高い利点があるが、これは別の見方をすると融通の利かない触媒であるともいえる。これらを改善する方策として酵素構造ばかりにフォーカスを当てるのではなく、その酵素の持つ天然の活性以上の力が発揮できるような補酵素を簡単な電子メディエータを基盤とした分子設計により創製する技術も注目すべきであろう。図7には筆者らが明らかにした様々な一電子還元型4,4'-BPを補酵素としたFDHが触媒する二酸化炭素のギ酸への還元に対する速度パラメータの一覧を示している。4,4'-BPにアミノ基やカルボキシ基等簡単な置換基を導入するだけでFDHの触媒活性は劇的に変化する24)-26)。さらに光酸化還元系においてもFDHの触媒活性を制御し、二酸化炭素のギ酸への光還元速度も変えることができる27)-30)。メチルビオローゲンは農薬・劇薬であることを指摘されるが、今後これらの知見は酵素を活性化する新たな電子メディエータの設計・創製に活かされるだろう。「天然酵素×天然補酵素=1」となるが、「天然酵素×人工補酵素は無限の可能性」があり、複数の酵素を共通の天然補酵素だけで機能させることこだわらず、化学的に設計合成した電子メディエータの利用によって融通の利かない酵素を柔軟な酵素にする、これも酵素工学の一つの楽しみではないであろうか?
![]()
謝辞
本稿で紹介した筆者らの研究成果は科学研究費助成事業 挑戦的萌芽研究 (15K14239)、新学術領域研究「人工光合成 (24107005)」及び「革新的光物質変換 (18H05174)」の助成を受けて進められたものである。
文献
1) Fujishima, A., Honda, K.: Nature, 238, 37 (1972).
2) 天尾 豊: 「第7章 自然の光合成を用いた人工光合成による有機物の合成・利用技術 第1説ソーラー燃料・物質生産のためのハイブリッド型人工光合成技術」,情報機構, 261 (2013).
3) Kumagai, H., Sahara, G., Maeda, K., Higashi, M., Abe, R., Ishitani, O.: Chem. Sci., 8, 4242 (2017).
4) Tamaki, Y., Ishitani, O.: ACS Catal., 7, 3394 (2017).
5) Takeda, H., Cometto, C., Ishitani, O., Robert, M.: ACS Catal., 7, 70 (2017).
6) Rohacova, J., Ishitani, O.: Chem. Sci., 7, 6728 (2016).
7) Goy, R., Bertini, L., Rudolph, T., Lin, S., Schulz, M., Zampella, G., Dietzek, B., Schacher, F. H., De Gioia, L., Sakai, K., Weigand, W.: Chem. Eur. J., 23, 334 (2016).
8) Brudvig, G. W., Reek, J. N. H., Sakai, K., Spiccia, L., Sun, L.: ChemPlusChem, 81, 1017 (2016).
9) Amao, Y.: J. CO2 Utilization, 26, 623 (2018).
10) Obert, R., Dave, B. C.: J. Am. Chem. Soc., 121, 12192 (1999).
11) Yadav, R. K., Oh, G. H., Park, N.-J., Kumar, A., Kong, K.-J., Baeg, J.-O.: J. Am. Chem. Soc., 136, 16728 (2014).
12) Mandler, D., Willner, I.: J. Chem. Soc., Perkin Trans., 2, 997 (1988).
13) Willner, I., D. Mandler, D.: J. Am. Chem. Soc., 111, 1330 (1989).
14) Miyatani, R., Amao, Y.: Biotechnol. Lett., 24, 1931 (2002).
15) Miyatani, R., Amao, Y.: J. Mol. Catal. B. Enzym., 27, 121 (2004).
16) Tsujisho, I., Toyoda, M., Amao, Y.: Catal. Commun., 7, 173 (2006).
17) Amao, Y., Watanabe, T.: Chem. Lett., 33, 1544 (2004).
18) Amao, Y., Watanabe, T.: Appl. Catal. B: Environ., 86,109 (2009).
19) Amao, Y., Kataoka, R.: Catal. Today, 307, 243 (2018).
20) Amao, Y., Ikeyama, S.: Chem. Lett., 44, 1182 (2015).
21) Ikeyama, S., Amao, Y.: ChemCatChem, 9, 833 (2017).
22) Amao, Y.: Sustainable Energy & Fuels, 2, 1928 (2018).
23) Ishibashi, T., Ikeyama, S., Amao, Y.: New J. Chem., 42, 18508 (2018).
24) Ikeyama, S., Amao, Y.: Chem. Lett., 45, 1259 (2016).
25) Amao, Y.: Chem. Lett., 46, 780 (2017).
26) Ikeyama, S., Amao, Y.: New J. Chem., 42, 15556 (2018).
27) Ikeyama, S., Amao, Y.: Sustainable Energy Fuels, 1, 1730 (2017).
28) Ikeyama, S., Amao, Y.: Photochem. Photobiol. Sci., 17, 60 (2018).
29) Ikeyama, S., Katagiri, T., Amao, Y.: J. Photochem. Photobiol. A. Chem., 358, 362 (2018).
30) Amao, Y., Abe, R., Shiotani, S.: J. Photochem. Photobiol. A. Chem., 313, 149 (2015).