【トピックス】
小胞体における新たな脂肪酸α酸化経路
木原章雄
北大院・薬/AMED-CREST
1.はじめに
脂質の主要な構成成分である脂肪酸のほとんどは非水酸化/非分岐型であり、分解過程ではアシルCoAへと変換後、β酸化、つまりβ位 (3位) の酸化を伴う分解を受け、二炭素短くなる。一方、α位 (2位)に水酸基、あるいは3位にメチル基を持つ脂肪酸はβ酸化を受けることができず、α酸化と呼ばれる特殊な酸化過程を経て、一炭素短い脂肪酸へと変換される。これまで、真核生物においてはペリオキシソームでの脂肪酸α酸化経路のみが知られていたが、筆者らは最近、小胞体における新たな脂肪酸α酸化経路を見出し、その経路に関わる酵素 (酵母Mpo1、哺乳類HACL2) を同定した。この小胞体における脂肪酸α酸化経路は2-ヒドロキシ (2-OH) 脂肪酸代謝において主要な経路であることが明らかとなった。筆者らの脂肪酸α酸化経路の解明は脂肪酸代謝に新たな知見を生み出した。
2.分岐脂肪酸のα酸化
3位にメチル基を持つ脂肪酸の代謝としては、フィタン酸の代謝が最もよく解析されている1,2)。植物のクロロフィル中に含まれるフィトール基は、反芻動物による消化の際に腸内細菌によってフィタン酸へと変換される (図1)。ヒトは反芻動物を食事から摂取することでフィタン酸を吸収し、α酸化によって代謝する。この代謝に関わる酵素遺伝子 (フィタノイルCoAヒドロキシラーゼ遺伝子PHYH) の変異はレフサム病を発症する3)。この疾患は運動失調、皮膚魚鱗癬、難聴、網膜色素変性症、白内障、夜盲症などの症状を伴う。
脂肪酸のβ酸化では2位にメチル基を持つ脂肪酸を基質とすることはできるが、フィタン酸などの3位にメチル基を持つ脂肪酸を基質にすることができない。そこで、フィタン酸はα酸化によって一炭素除去され、β酸化の基質となり得る2-メチル体であるプリスタン酸へと変換される必要がある。哺乳類におけるフィタン酸の代謝過程では、フィタン酸は4つの反応によって、プリスタン酸へ代謝される4) (図1)。これらの反応は、1. フィタン酸からフィタノイルCoAへ変換 (アシルCoA合成酵素による触媒)、2. フィタノイルCoAの2位水酸化による2-OHフィタノイルCoAの産生 (フィタノイルCoAヒドロキシラーゼによる触媒)、3. 炭素骨格1位と2位の間の開裂によるプリスタナールの産生 (2-OHアシルCoAリアーゼによる触媒)、4. プリスタナールの酸化によるプリスタン酸の産生 (脂肪族アルデヒドデヒドロゲナーゼによる触媒) である。上記の2以降の反応はペルオキシソームで行われる。生じたプリスタン酸はプリスタノイルCoAへ変換後、ペルオキシソームにおけるβ酸化によって鎖長が短くなり、途中からミトコンドリアに移行してさらなるβ酸化をうける1,2)。最終的に1分子のプリスタノイルCoAからβ酸化によって3分子のプロピオニルCoA、2分子のアセチルCoA、1分子のイソブチリルCoAが産生される。イソブチリルCoAはバリンの代謝経路によってプロピオニルCoAへ変換される。プロピオニルCoAは、メチルマロニルCoAを経てスクシニルCoAへと代謝され、クエン酸回路のスクシニルCoAシンテターゼの基質となる。
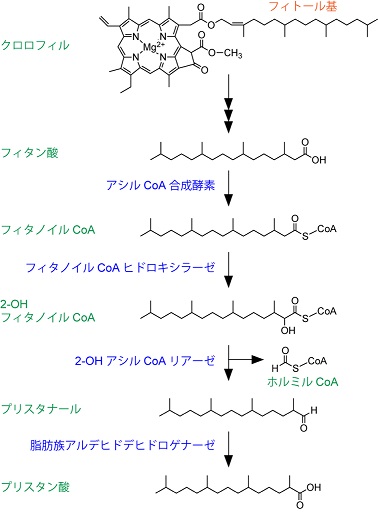

上記のα酸化経路の中で、3段階目の反応を触媒する2-OHアシルCoAリアーゼはHACL1遺伝子にコードされる4)。この反応によって2-OHフィタノイルCoAは開裂されて一炭素短くなり、アルデヒドであるプリスタナールとホルミルCoAが産生される。ホルミルCoAはギ酸に変換後、CO2となって細胞から排出される。HACL1はチアミンピロリン酸を補酵素として持ち、チアミンピロリン酸中に生じた負電荷が求核剤として、2-OHフィタノイルCoAのチオエステル結合中のカルボニル炭素を攻撃する4,5)。Hacl1遺伝子のノックアウトマウスは、通常の生育条件下では明らかな表現型を示さないが、フィトールを食餌から摂取させると、フィタン酸のレベルが肝臓および血清において上昇し、有意な体重減少、腹部白色脂肪組織の欠如、肝臓の肥大、肝臓中のグリコーゲンおよびトリグリセリドの減少が引き起こされる6)。
3.2-OH脂肪酸のα酸化
3-1 2-OH脂肪酸とスフィンゴ脂質
2-OH脂肪酸は細菌・真菌・植物・動物に広く存在する7-11)。真核生物の生体膜はグリセロリン脂質、スフィンゴ脂質、ステロールから構成される。2-OH脂肪酸はこれらの脂質のうち、スフィンゴ脂質中にのみ存在する。スフィンゴ脂質は脂肪酸と長鎖塩基からなる疎水骨格セラミドおよび極性基から構成され、それらの組み合わせによる多様な分子種が存在する11) (図2A)。2-OH脂肪酸を含むスフィンゴ脂質は哺乳類においては脳、腸管、腎臓、生殖組織などの組織に限定的に存在する9)。特に脳においては、2-OH脂肪酸はミエリンのスフィンゴ脂質 (ガラクトシルセラミドなど) 中に多く存在し、ミエリンの維持に重要である12-14)。酵母のスフィンゴ脂質の脂肪酸部分のほとんどは、炭素数26の2-OH脂肪酸である7,15,16)。
長鎖塩基は共通して1位と3位に水酸基を、2位にアミノ基を持つ。最も単純な長鎖塩基はジヒドロスフィンゴシンである。哺乳類で最も主要な長鎖塩基はスフィンゴシンであり、炭素鎖の4位と5位間にトランス二重結合をもつ。一方、フィトスフィンゴシンは4位に水酸基を持つ。フィトスフィンゴシンは哺乳類では表皮・小腸・腎臓に存在し17-19)、酵母では主要な長鎖塩基である15,20)。
3-2 酵母におけるα酸化酵素Mpo1
筆者らは酵母におけるフィトスフィンゴシンの代謝経路の解明の過程で新規α酸化酵素Mpo1を同定した21)。フィトスフィンゴシンは他の長鎖塩基と同様に、1位のリン酸化、2位と3位間の開裂、酸化という3反応によって二炭素短くなった2-OH脂肪酸へと変換される。酵母において最も主要なフィトスフィンゴシンの炭素数は18であり、この代謝によって2-OHパルミチン酸 (2-OH C16:0-COOH) が生じる。2-OH C16:0-COOHは非水酸化C15:0-COOHに変換された後に、主にグリセロリン脂質に取り込まれる。このことは、酵母には2-OH C16:0-COOHからC15:0-COOHへ変換するα酸化酵素が存在することを示していた。酵母の脂肪酸α酸化酵素をコードする遺伝子は知られていなかったため、筆者らはその同定を試みた。酵母では網羅的な細胞内局在解析によって、全てのタンパク質の局在が明らかになっている22)。長鎖塩基の代謝は小胞体で行われるため、筆者らは機能未知かつ、小胞体局在タンパク質をコードする遺伝子を脂肪酸α酸化酵素遺伝子の候補とした。これら候補遺伝子の欠損株のそれぞれに対して放射標識フィトスフィンゴシンラベルを行なったところ、フィトスフィンゴシンをグリセロリン脂質へ代謝できない欠損株を1つ見出し、この株中で欠損していた遺伝子をMPO1 (Metabolism of Phytoshingosine to Odd-numbered fatty acid) と名付けた21)。MPO1遺伝子の欠損株 (mpo1Δ) では、炭素数15の脂肪酸を持つホスファチジルコリン (最も量が多いグリセロリン脂質) の量が野生株の約4割程度にまで減少していた。
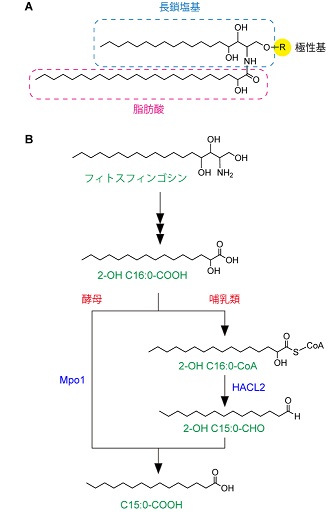

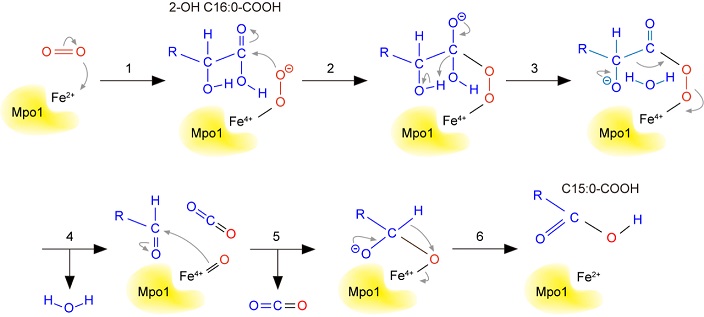
Mpo1は細菌、真菌、原虫、植物に保存されたDUF962タンパク質ファミリーに属す。DUF (domain of unknown function) という名が示すとおり、このタンパク質ファミリーの機能はMpo1同定以前は全くわかっていなかった。Mpo1は推定分子量が20.2 kDaの小さなタンパク質であり、膜貫通領域と予測される部位を2箇所持つのみで、既知のドメインを持たない。筆者らは精製したMpo1を用いた生化学的な解析から、Mpo1がFe2+イオン存在下で、2-OH C16:0-COOHをC15:0-COOHへ直接変換する活性を持つことを明らかにした23) (図2B)。この反応は酸素依存的であり、Fe2+イオンに結合した酸素が酸化剤として働くことを示していた。つまり、Mpo1は2-OH脂肪酸と酸素から一炭素短くなった非水酸化脂肪酸、水、二酸化炭素へ変換する新しいタイプのジオキシゲナーゼであった。Mpo1が触媒する反応のメカニズムのモデルを図3に示した。その後の解析から、筆者らはMpo1がフィトスフィンゴシン代謝過程で生じる2-OH C16:0-COOHだけでなく、スフィンゴ脂質の脂肪酸部分に存在する2-OH C26:0-COOHの代謝にも関わっていることを明らかにしている (unpublished data)。

3-3 哺乳類におけるα酸化酵素HACL2
哺乳類においてもフィトスフィンゴシンは酵母と同様にα
酸化によってC15:0-COOHへ変換される21)。また、哺乳類のスフィンゴ脂質の脂肪酸部分にも2-OH脂肪酸は存在し、特にミエリンのスフィンゴ脂質には2-OH C24:0-COOHが多く含まれる9,12)。ミエリンには2-OH C24:0-COOHのα酸化産物と思われるC23:0-COOHおよびそれが伸長したC25:0-COOHを含むスフィンゴ脂質が多く存在する24)。このことはミエリンにおいて2-OH脂肪酸のα酸化反応が活発に行われていることを示している。しかし、これまで哺乳類おける2-OH脂肪酸のα酸化酵素は不明であった。
Mpo1と同じDUF962ファミリーに属するタンパク質は哺乳類には存在しない。上述の分岐脂肪酸に対して活性を示す2-OHアシルCoAリアーゼHACL1はin vitroのアッセイにおいて2-OHアシルCoAに対して活性を示したものの、HACL1を欠損させた細胞あるいはノックアウトマウスでは2-OH脂肪酸の代謝に影響が見られなかった4,5,25)。筆者らはHACL1と高い相同性を示すHACL2が哺乳類における2-OH脂肪酸のα酸化に主に関わっていることを明らかにした25)。HACL1とHACL2間の高い相同性と一致して、HACL1とHACL2が触媒する反応および、両者が関わるα酸化経路は類似している。すなわち、2-OH脂肪酸のα酸化は分岐脂肪酸のα酸化と同様に、2-OH脂肪酸のCoA付加、開裂、アルデヒドの脂肪酸への酸化の順に行われる (図2B)。このうち、2段階目の開裂反応をHACL2が触媒し、2-OHアシルCoAの1位と2位炭素間を開裂して一炭素短くなった長鎖アルデヒドとホルミルCoAを生じる。この反応にはHACL1による反応と同様にチアミンピロリン酸が必要である。HACL1はペルオキシソームに局在するのに対し、HACL2は小胞体に局在する25)。このように、酵母と哺乳類では2-OH脂肪酸のα酸化反応が異なる酵素、異なる反応によって行われるにも関わらず、共に小胞体で行われる。
4.おわりに
哺乳類における脂肪酸の殆どは偶数鎖である。ほとんどの組織では奇数鎖脂肪酸の量は少なく、以前はそれらの殆どが生合成段階で三炭素単位のプロピオニルCoAを出発材料として産生されると考えられてきた26)。しかし、2-OH脂肪酸を多く含む組織、例えば脳や皮膚には奇数鎖脂肪酸が比較的多く存在し、それらの多くは2-OH脂肪酸のα酸化によって産生されると予測される24,27,28)。2-OH脂肪酸のα酸化の生理的意義は、奇数鎖脂肪酸を生み出すことではなく、用途の限られる2-OH脂肪酸を幅広い代謝に利用可能な非水酸化脂肪酸へ変換することにあると考えられる。2-OH脂肪酸はβ酸化に利用できず、脂質合成の前駆体としてはスフィンゴ脂質にのみ使用される。一方、非水酸化脂肪酸はβ酸化や脂質合成において、偶数鎖と奇数鎖は区別されずに利用される。筆者らが同定したMpo1のホモログは細菌、真菌、原虫、植物に広く存在する。Mpo1の触媒するジオキシゲナーゼ反応はこれまで知られていない新しい反応であり、今後他のホモログについても同様の機能が明らかにされるであろう。哺乳類のHACL2に関しては、今後Hacl2ノックアウトマウスが作成・解析されることで、2-OH脂肪酸の蓄積が引き起こす病態が明らかになると期待される。
謝辞
本研究の一部は日本医療研究開発機構 (AMED) によるAMED-CRESTプログラム (JP19gm0910002)、日本学術振興会 (JSPS) による科研費基盤研究A (18H03976) および新学術領域研究 (18H04664) による支援を受けて行った。また、研究を行なった研究室学生らに感謝する。
文献
1) Jansen, G. A., Wanders, R. J.: Biochim. Biophys. Acta, 1763, 1403 (2006).
2) Roca-Saavedra, P., Marino-Lorenzo, P., Miranda, J. M., Porto-Arias, J. J., Lamas, A., Vazquez, B. I., Franco, C. M., Cepeda, A.: Food Chem., 221, 237 (2017).
3) Jansen, G. A., Waterham, H. R., Wanders, R. J.: Hum. Mutat., 23, 209 (2004).
4) Foulon, V., Sniekers, M., Huysmans, E., Asselberghs, S., Mahieu, V., Mannaerts, G. P., Van Veldhoven, P. P., Casteels, M.: J. Biol. Chem., 280, 9802 (2005).
5) Casteels, M., Sniekers, M., Fraccascia, P., Mannaerts, G. P., Van Veldhoven, P. P.: Biochem. Soc. Trans., 35, 876 (2007).
6) Mezzar, S., De Schryver, E., Asselberghs, S., Meyhi, E., Morvay, P. L., Baes, M., Van Veldhoven, P. P.: Biochim. Biophys. Acta, 1862, 972 (2017).
7) Haak, D., Gable, K., Beeler, T., Dunn, T.: J. Biol. Chem., 272, 29704 (1997).
8) Ring, M. W., Schwar, G., Bode, H. B.: ChemBioChem, 10, 2003 (2009).
9) Hama, H.: Biochim. Biophys. Acta, 1801, 405 (2010).
10) Markham, J. E., Lynch, D. V., Napier, J. A., Dunn, T. M., Cahoon, E. B.: Curr. Opin. Plant Biol., 16, 350 (2013).
11) Kihara, A.: Prog. Lipid Res., 63, 50 (2016).
12) Zoller, I., Meixner, M., Hartmann, D., Bussow, H., Meyer, R., Gieselmann, V., Eckhardt, M.: J. Neurosci., 28, 9741 (2008).
13) Dick, K. J., Eckhardt, M., Paisan-Ruiz, C., Alshehhi, A. A., Proukakis, C., Sibtain, N. A., Maier, H., Sharifi, R., Patton, M. A., Bashir, W., Koul, R., Raeburn, S., Gieselmann, V., Houlden, H., Crosby, A. H.: Hum. Mutat., 31, E1251 (2010).
14) Potter, K. A., Kern, M. J., Fullbright, G., Bielawski, J., Scherer, S. S., Yum, S. W., Li, J. J., Cheng, H., Han, X., Venkata, J. K., Khan, P. A., Rohrer, B., Hama, H.: Glia, 59, 1009 (2011).
15) Dickson, R. C.: J. Lipid Res., 49, 909 (2008).
16) Ejsing, C. S., Sampaio, J. L., Surendranath, V., Duchoslav, E., Ekroos, K., Klemm, R. W., Simons, K., Shevchenko, A.: Proc. Natl. Acad. Sci. U.S.A., 106, 2136 (2009).
17) Okabe, K., Keenan, R. W., Schmidt, G.: Biochem. Biophys. Res. Commun., 31, 137 (1968).
18) Iwamori, M., Costello, C., Moser, H. W.: J. Lipid Res., 20, 86 (1979).
19) Nishimura, K.: Comp. Biochem. Physiol. B, 86, 149 (1987).
20) Kihara, A., Sakuraba, H., Ikeda, M., Denpoh, A., Igarashi, Y.: J. Biol. Chem., 283, 11199 (2008).
21) Kondo, N., Ohno, Y., Yamagata, M., Obara, T., Seki, N., Kitamura, T., Naganuma, T., Kihara, A.: Nat. Commun., 5, 5338 (2014).
22) Huh, W. K., Falvo, J. V., Gerke, L. C., Carroll, A. S., Howson, R. W., Weissman, J. S., O'Shea, E. K.: Nature, 425, 686 (2003).
23) Seki, N., Mori, K., Kitamura, T., Miyamoto, M., Kihara, A.: Mol. Cell. Biol., 39, e00428 (2019).
24) Svennerholm, L., Stallberg-Stenhagen, S.: J. Lipid Res., 9, 215 (1968).
25) Kitamura, T., Seki, N., Kihara, A.: Proc. Natl. Acad. Sci. U.S.A., 114, E2616 (2017).
26) Tove, S. B.: Nature, 184(Suppl 21), 1647 (1959).
27) Hajra, A. K., Radin, N. S.: J. Lipid Res., 4, 270 (1963).
28) Farwanah, H., Wohlrab, J., Neubert, R. H., Raith, K.: Anal. Bioanal. Chem., 383, 632 (2005).