【トピックス】
メタノールバイオエコノミー:C1微生物代謝生理の分子基盤を活用した資源循環型社会の構築
由里本博也、阪井康能
京大院・農、京大院・農
1.はじめに
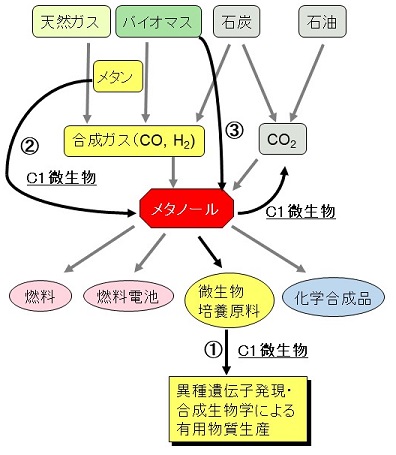
近年の米国でのシェールガス革命と相前後して、天然ガス利用への関心が世界的に高まっている。天然ガスはメタンハイドレートなどの非在来型も含めた埋蔵量の豊富さ、利便性、経済性、優れた環境特性から、今世紀の炭素・エネルギー資源の中心になると予測される。天然ガスの主成分であるメタンと、メタンから工業生産されるメタノールは、未利用バイオマスからの循環的生産も可能であり、石油・石炭に代わるエネルギー資源、炭素資源として、さらには低環境負荷型・循環型物質生産体系の基幹物質として注目されている。特にメタノールは、様々な化成品の原料にもなることから、天然ガス、石炭、CO2、バイオマスなど、多様な炭素資源を化学的方法でメタノールに導き、これを中心とする資源循環型工業体系「メタノールエコノミー」を構築することが提唱されている (図1)1,2)。
![]()
一方、自然界には、メタンやメタノールなどのC-C結合を持たない還元型C1化合物を炭素源・エネルギー源として利用する微生物 (C1微生物 ; methylotroph) が棲息している。そのユニークな代謝系やメタノールへの旺盛な増殖能を基盤として、様々な有用物質生産や有用酵素・タンパク質生産に利用されており、C1微生物の代謝生理機能は、メタノールエコノミーにおけるバイオプロセス「メタノールバイオエコノミー」において高度に活用することが期待される。中でもメタノール資化性酵母 (メタノール酵母) では、メタノールにより強力に誘導される遺伝子プロモーターを用いた異種遺伝子発現系が確立され、メタノールを炭素源とした様々な有用タンパク質の高生産に広く利用されている。またこのような強力な異種遺伝子発現系は、他の生物の代謝経路を導入して新規な有用物質を生産する代謝工学・合成生物学の基盤でもある。
今後、メタノールバイオエコノミーとして、メタノール酵母における異種遺伝子発現系をバイオプロセスの基幹技術として積極的に活用していくためには、本酵母の代謝生理機能の分子基盤を解明し、異種遺伝子発現系のさらなる強化に応用展開しなければならない。本稿では、メタノールバイオエコノミーにおいて活用できるC1微生物による有用物質生産、特にメタノール酵母の異種遺伝子発現系に焦点をあて、資源循環型社会の構築に資する本酵母の代謝生理機能の分子基盤と応用機能開発について紹介する。
2.資源循環型社会の基幹物質としてのメタノールとC1微生物の活用
2-1 未来型資源としてのメタン、メタノール
様々な炭素資源をメタノールに転換し、これを基幹化成品や高分子材料の原料として利用しようとする「メタノールエコノミー」は、ノーベル化学賞 (1994年) 受賞者のOlah博士らが2005年に提唱したものである (図1)1,2)。メタノールは、天然ガスやバイオマスから得られる合成ガス (CO, H2) 経由のメタノール生産に加え、CO2の水素化還元による生産技術も実用化されつつあり、産業から排出されるCO2を循環利用して生産することもできるため、化石資源に依存しない工業体系の確立において将来有望な化合物である。メタノールが工業原料として優れている点は、常温で液体であるため貯蔵や運搬が容易であること、比較的安価に高純度で得られること、食糧と競合しないこと、燃料や燃料電池に利用できること、様々な炭化水素を経て多くの化成品へと変換できること等が挙げられる。Olah博士らは、メタノールエコノミー実現への課題の一つとして、大気中のCO2からのメタノール製造技術の確立を挙げており、これが達成できれば、化石資源が枯渇した後も人類の資源・エネルギー供給を賄うことができる。しかし、その実現にはエネルギー問題を始めとしてまだまだ克服すべき課題があるのが現状であり、メタノール生産をまだまだ天然資源に頼らざるを得ない状況である。そこで、シェールガスやメタンハイドレートなどの非在来型メタン (採掘するのは困難だが資源として存在するもの) が注目されていたが、シェールガスについては採掘技術が確立され、米国では2008年頃からその生産が本格化して天然ガスの価格低下など世界のエネルギー事情に大きなインパクトを与えることとなった。このシェールガス革命以降は、従来から研究が進められてきたメタン・メタノールからの有用物質生産技術に加え、メタンからメタノールへの直接変換反応に関する技術開発が進められるようになった。現在の天然ガス使用量の数百年分とも推定される埋蔵量の豊富さや、単位発熱量当たりのCO2排出量が石油に比べて低いことなどからも、天然ガスは今後エネルギー源・炭素資源の中心になっていくことも予想され、天然ガスの主成分であるメタンや、メタンを原料に合成されるメタノールは、将来のエネルギー・化学工業を支える未来型資源である。
一方、メタノールのバイオマスからの合成に関しては、バイオマスをガス化することで、天然ガス (メタン) からの工業生産とほぼ同様の工程により合成することができる。これに加え、植物細胞壁構成成分であるペクチンにはメチルエステル体として膨大な量が自然界に存在している。このようにメタノールは未利用バイオマスからの生産が可能であり、これらの技術開発が進めば、天然ガスのみならずバイオマスの再資源化も可能となることから、メタノールは循環型物質生産体系の基幹物質としてますます注目されている。
2-2 C1微生物による有用物質生産
メタノールエコノミーにおけるバイオプロセス「メタノールバイオエコノミー」においては、メタンやメタノールなどの還元型C1化合物を唯一の炭素源・エネルギー源として利用するC1微生物の代謝生理機能が活用できる (図1)。このようなバイオプロセスを高機能化・高度利用するためには、C1微生物による有用物質生産 (図1中の①) の技術革新に加え、C1微生物によるC1化合物の代謝生理機能と、それを支える分子基盤を解明してこれを高度活用し、温室効果ガスであるメタンの酸化・生物資源化 (図1中の②) や、バイオマスからメタノールへの変換 (図1中の③) などの新技術開発を進める必要がある。ケミカルプロセスによるメタノールへの変換技術や、メタノールを燃料や化成品原料として利用する技術に関しては、「C1ケミストリー」として主に化学系研究機関・企業で研究開発が進められてきた。一方、バイオプロセスには、C1微生物による有用物質・タンパク質生産があり、1970年代のメタノールからのシングルセルプロテイン (SCP) 生産に端を発し、化学・医薬・食品分野での研究開発が行われてきた。
C1微生物は一般的な微生物にとって代謝が困難なC1化合物を利用するユニークな代謝系を持ち、メタンやメタノールを様々な化合物へと変換する能力をもつ。メタンを利用するメタン資化性細菌 (メタン酸化細菌 ; methanotroph) では、メタンはメタンモノオキシゲナーゼ (MMO) によってメタノールへと酸化される。このMMOは、基質特異性が極めて広く、アルカンの酸化、アルケンのエポキシドへの酸化、脱ハロゲン化など様々な酸化反応を触媒するため、生体触媒としての利用についての技術開発が進められてきた3)。また、メタン資化性細菌では、メタンを培養原料とするpoly-β-hydroxybutyrate(PHB)、細胞外多糖 (EPS)、アミノ酸などの生産が報告されているが、ガス基質を用いた特殊な培養系であることや、可燃性ガスのメタンや酸素の取扱いなどの問題を克服する必要がある。
一方、メタノール資化性菌には、細菌と酵母が存在し、C1化合物以外の化合物も炭素源として利用する通性methylotrophがほとんどである。メタノール代謝は、メタノールからホルムアルデヒドへの酸化により始まり、ホルムアルデヒドはエネルギーを得るための酸化経路と細胞構成成分を得るための資化経路の両経路で代謝される。メタノール酸化は、細菌ではピロロキノリンキノン (PQQ) を補酵素とするメタノール脱水素酵素が主流であるのに対し、酵母では分子状酸素を要求し、過酸化水素を生成するアルコールオキシダーゼ (AOX) によって触媒される。メタノールは水溶性であるので培地に添加しやすく、またメタノールを炭素源とする培地は単純であり、他の微生物によるコンタミも少なく、生産プロセスの後処理に負荷がかからない。グルコースのような発酵性炭素源ではエタノールによる生育阻害が起こるが、メタノールではそのような阻害が起こらず、メタノール資化性細菌では乾燥菌体重量で200 g/L、メタノール酵母では100 g/Lを超える高密度培養が可能である4)。このようにメタノールは優れた微生物培養原料であり、実際にメタノール資化性細菌や酵母を利用したメタノールからの有用物質生産 (有用タンパク質・酵素、アミノ酸、PHBなど) が可能となっている5,6)。
3.メタノール酵母の代謝生理機能の分子基盤と応用機能開発
3-1 メタノール代謝と異種遺伝子発現系
産業用酵素や医薬品タンパク質などの有用タンパク質の多くが、遺伝子組換え技術を用いた異種遺伝子発現系によって生産されている。これまでに様々な生物種を宿主とする異種遺伝子発現系が開発され、大腸菌や枯草菌などの原核微生物から、酵母やカビなどの真核微生物、昆虫細胞や動物細胞などの高等真核細胞まで多様な宿主を利用することができる。このうち、最も強力な異種遺伝子発現系の宿主として広く利用されるようになってきたのがメタノール酵母である。メタノール酵母の最初の報告は、1969年の緒方らにより京都市の土壌から分離されたCandida boidinii (当時はKloeckera sp.) であり、今年 (2019年) でちょうど50年となる7)。1970年代には、安価なメタノールを原料として飼料添加物としてのSCPを生産する研究開発が行われ、メタノール代謝経路の解明や高密度培養技術の開発など、その後のメタノール酵母の利用価値を高める基盤が築かれた。
メタノール酵母におけるメタノール代謝は、上述のようにAOXによるメタノールからホルムアルデヒドへの酸化により開始される。続く資化経路では、ジヒドロキシアセトンシンターゼ (DAS) により、ホルムアルデヒドとキシルロース5-リン酸からジヒドロキシアセトンとグリセルアルデヒド3-リン酸が生じる。一方、酸化経路では、ホルムアルデヒドデヒドロゲナーゼやギ酸デヒドロゲナーゼにより、CO2まで酸化される。メタノール酵母の最大の特徴は、これらのメタノール代謝に関わる一連の酵素群がメタノール培養時に顕著に誘導され、AOXやDASを含むペルオキシソームが発達することである。AOXやDASのタンパク質量は、それぞれ細胞内可溶性タンパク質の数十 %にも達する。これらのメタノール誘導性遺伝子の発現は転写レベルで制御され、強力なメタノール誘導性遺伝子プロモーターが、メタノールで培養時、異種遺伝子発現のためのプロモーターとして用いられている。また、上述の通り、培養炭素源としてのメタノールは非発酵性炭素源であるため、グルコースなどの発酵性炭素源培養時に生じるエタノールによる生育阻害が起こらず、比較的容易に高密度培養が可能で、工業レベルでの物質生産において、経済性や生産性に優れている。さらに、真核生物としての基本的な細胞構造と機能をもつことから、糖鎖付加などの翻訳後修飾や分泌生産が可能で、特に原核微生物を宿主とした場合に活性型タンパク質を得ることが困難な真核細胞由来の異種遺伝子発現に有利である。このように、メタノール酵母は、異種遺伝子発現に有利な特徴を備えており、これまでに、Pichia pastoris (分類学上の正式名称はKomagataella phaffii) の他、 Hansenula polymorpha (Ogataea polymorpha)、C. boidiniiなどのメタノール酵母で異種遺伝子発現系が開発され、学術研究を目的とするものだけでなく、工業レベルで生産されているものも含めて数多くのタンパク質が生産されている8-10)。
3-2 メタノール濃度に応答する遺伝子発現制御とメタノール感知機構
筆者らはこれまでに、メタノール酵母異種遺伝子発現系の基盤となるメタノール誘導性遺伝子の発現制御機構について、C. boidiniiを用いて複数の転写制御因子を同定し、その役割を明らかにした10-12)。メタノール誘導性遺伝子の発現を完全に抑制するグルコース培養条件からメタノール培養条件への代謝変換時には、転写因子Trm2が関与しメタノールの存在に依存しない転写活性化 (脱抑制) と、Trm1やHap複合体 (Hap2/3/5) が関与しメタノール濃度に依存した転写活性化 (メタノール誘導) の2段階でメタノール誘導性遺伝子の転写活性化が起こる制御モデルを筆者らは提唱している12)。
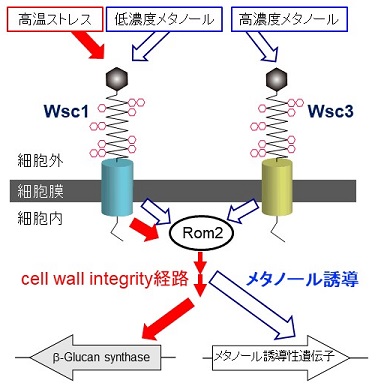
一方、メタノール酵母が細胞外のメタノールをどのように感知し、転写制御因子にシグナル伝達しているかについては全くわかっていなかった。メタノール酵母は、メタノール濃度が約0.01〜0.1%の間で日周変動する植物葉面で増殖することができることを筆者らは明らかにしており13)、メタノール酵母はこのような環境に適応するために、メタノール濃度の変動を厳密に感知しなければならない。実際、K. phaffiiのAOX遺伝子の転写レベルは、メタノール濃度が0.1%までは濃度依存的に増加するが、0.1%以上の濃度では逆に減少する14)。これは、メタノール酸化で生じるホルムアルデヒドの異常な蓄積を防ぐための機構と考えられるが、0.1%以上のメタノール濃度におけるメタノール誘導性遺伝子の転写レベルの低下は、異種遺伝子発現においては効率の良い発現の妨げとなる。筆者らは、K. phaffiiにおいてメタノール感知機構に働く細胞表層センサーとして、Wscファミリータンパク質を初めて同定し、メタノール濃度に依存したメタノール誘導性遺伝子の転写活性化レベルの制御にWsc1/Wsc3が関与することを明らかにした (図2)14)。Wscファミリータンパク質は、S. cerevisiaeでは細胞表層ストレスセンサーとして知られており、細胞表層ストレスを感知するとGEF (guanine-nucleotide exchange factor) として働くRom2を介してcell wall integrity (CWI) 経路を活性化し、下流の遺伝子発現を制御する。メタノール酵母では、Wscタンパク質はメタノールと細胞表層ストレスの両者に応答し、メタノール誘導性遺伝子の転写活性化は、CWI経路から分岐する未知の経路を経て転写因子に伝達されると考えられる。遺伝子破壊株やアミノ酸置換変異体を用いた解析の結果、Wsc1は低濃度メタノールと細胞表層ストレスの両方の刺激に応答して機能する一方、細胞表層ストレスセンサーとしての機能をもたないWsc3は、より高濃度でのメタノール感知に重要であり、この濃度応答性の違いによって幅広いメタノール濃度を感知し、メタノール誘導性遺伝子の転写レベルを調節していると考えられる。
![]()
3-3 メタノールセンサー酵母細胞の開発
筆者らは、微生物が炭素源として利用できるメタノールが葉面にどの程度存在するのかを調べるために、メタノール酵母がもつメタノール濃度に応答する遺伝子発現制御機構を利用した「メタノールセンサー細胞」を構築した13)。C. boidiniiのメタノール誘導性遺伝子のプロモーター支配下にペルオキシソーム移行シグナルを付加した蛍光タンパク質 (Venus) を発現させ、これを様々なメタノール濃度の寒天培地に置き、蛍光顕微鏡を用いて細胞の蛍光強度を測定した。このときのメタノール誘導性プロモーターには、脱抑制レベルの発現量が低いDAS遺伝子のプロモーターを用いた。これは、メタノールに依存しない脱抑制による遺伝子発現レベルは遺伝子によって異なり、DAS遺伝子の発現レベルはAOX遺伝子よりも低いためである。このメタノールセンサー酵母細胞の懸濁液を寒天培地にスポットしてから4時間後の蛍光強度を測定したときに、メタノール濃度と蛍光強度が強い相関性を示すことを見出し、250µM〜250 mMの範囲のメタノールを検出、定量することに成功した。このメタノールセンサー細胞を用いてシロイヌナズナの葉面メタノール濃度を定量したところ、上述のようにメタノール濃度が日周変動することを見出すことができた。
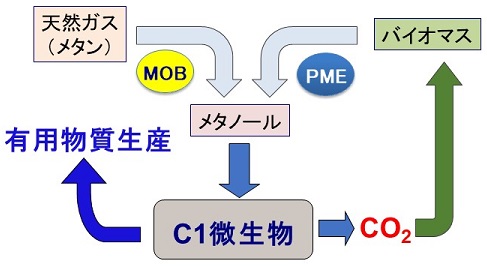
次に筆者らは、メタノールセンサー細胞を、メタノールを生成する酵素の活性評価、酵素工学スクリーニングに利用しようと考えた。メタンやバイオマスを始めとする様々な炭素資源をメタノールへと変換するバイオプロセスの開発は、メタノールエコノミーにおいて重要な技術開発であり、そのためにはメタノール生成酵素の高機能化や異種発現が必要である。メタノール生成酵素により変換されたメタノールを炭素源として、C1微生物による有用物質生産を行うことができるだけでなく、メタノール生成酵素をC1微生物で異種発現することにより、メタンやバイオマスを有用物質生産の原料として直接利用することもできる。またその過程で排出されるCO2は、植物バイオマスとして再資源化できる。このように、メタノール生成酵素とC1微生物を利用した循環型物質生産系を構築することができる (図3)。
![]()
メタノールセンサー酵母細胞を用いたメタノール生成酵素活性評価のためには、検出感度を数µMオーダーまで向上させる必要があったため、蛍光強度測定にはハイスループット一細胞解析が可能なFACS (fluorescence-activated cell sorting) を用い、FACSでの解析に適した球形の細胞形状のK. phaffiiを宿主とするメタノールセンサー細胞を開発した15)。AOX遺伝子とDAS遺伝子のプロモーターを比較したところ、K. phaffiiにおいてもDAS遺伝子 (DAS2) プロモーターを用いた場合に低メタノール濃度の検出が可能であった。また、メタノールが消費されずに残存することで検出感度が向上することを期待して、AOX遺伝子破壊株を宿主としたところ、逆に検出感度が低下した。筆者らは、C. boidiniiにおいて、メタノール誘導性遺伝子の発現にはメタノールだけでなくその代謝産物も重要であることを見出しており、K. phaffiiにおいても同様に、メタノール誘導性遺伝子発現にはメタノールが代謝されることが重要であると考えられる。さらに、培養条件や測定条件を最適化することにより、最終的に2.5µMまで検出感度を向上させることに成功した。
3-4 メタノールセンサー酵母一細胞解析の酵素工学技術への利用
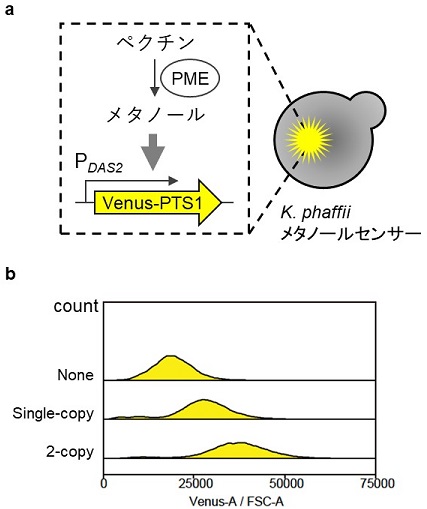
メタンからメタノールへの変換には、MMOに代表されるメタン酸化生体触媒 (MOB ; methane-oxidizing biocatalyst) が、バイオマスからメタノールへの変換には、植物バイオマス由来のペクチンに含まれるメチルエステルを加水分解してメタノールを生成するペクチンメチルエステラーゼ (PME) を利用することができる (図3)。筆者らは、K. phaffiiメタノールセンサー酵母を宿主とし、メタノール生成酵素を異種発現した際に、その活性評価や高活性酵素発現株の選抜が可能かどうかを、C. boidiniiでの異種生産実績15)があったPMEをモデル酵素として用いて検討した (図4a)。Aspergillus niger由来のPMEを分泌発現するように設計した発現カセットを、K. phaffiiメタノールセンサー細胞にシングルコピー導入した株と2コピー導入した株を構築し、2コピー導入株がシングルコピー導入株の約2倍のPME活性をもつことを確認した。PME遺伝子非発現株とともに、これらの株をペクチンを含む培地で4時間インキュベートし、FACS解析に供したところ、PME活性に相関して高い蛍光強度を示す細胞数が増加し (図4b)、メタノール生成酵素活性の強弱を評価することに成功した15)。このように、メタノールセンサー酵母を宿主とすることで、高い活性を示すメタノール生成酵素のハイスループット酵素工学スクリーニングが可能であることがわかった。
![]()
また筆者らは現在、メタノールセンサー酵母を宿主として、新規MOBの開発に取り組んでいる。常温・常圧下でのメタノール生成が可能な生体触媒としてメタン資化性細菌がもつMMOがあるが、メタン資化性細菌の大量培養や酵素調製法、酵素の安定性などに問題があり、大腸菌などでの異宿主発現も困難なことから、高度利用に向けた酵素機能開発は進んでいない。そこで筆者らは、大腸菌を宿主として凝集体からのリフォールディングにより活性型となることが報告されている膜結合型MMO (pMMO) βサブユニットの可溶性触媒ドメイン (spmoB)17)について、K. phaffiiメタノールセンサー酵母での発現を試みた。spmoBではFACSによる活性評価で有意なメタノール生成活性 (メタン酸化活性) は認められなかったが、他のサブユニット由来の配列を付加し、アミノ酸置換変異を導入することにより、有意なメタン酸化活性をもつ新規MOBの創製に成功した18)。現在、FACSによるハイスループット酵素工学スクリーニングを行うことにより、さらなる高機能化を目指している。
4.おわりに
本稿では、メタンやメタノールを利用するC1微生物をメタノールバイオエコノミーにおいて活用するために、有用タンパク質生産だけでなく、有用物質生産のための代謝系導入においても必要な異種遺伝子発現宿主として利用されるメタノール酵母を例に、メタノール濃度に応答する遺伝子発現制御に関わるメタノール感知機構、メタノールセンサー酵母細胞の開発とその利用について紹介した。メタノール酵母では、代謝中間体として生じるホルムアルデヒドが有毒なため、生育および誘導基質としてのメタノールを高濃度で使用できず、低濃度メタノール培養では宿主の生育や異種タンパク質生産量が減少するという課題があり、メタノール濃度に応答する遺伝子発現やその感知機構の解明は、低濃度から高濃度までのメタノール濃度に応じた効率的な生育と異種タンパク質生産の両立を実現し、本酵母が持つポテンシャルを最大限に引き出した新規宿主の開発に繋がる。また、メタノール資化性細菌やその代謝系を導入した微生物によるメタノールからの有用物質生産についても、酵素工学、代謝工学、合成生物学的アプローチによる研究開発が進められており、メタノール資化性細菌そのものを利用するだけでなく、有用物質生産菌として利用されている大腸菌やCorynebacterium glutamicumに、メタノール酸化やホルムアルデヒド資化に関わる遺伝子を導入し、メタノール資化能 (synthetic methylotrophy) を合成生物学的に附与することも可能となっている19,20)。
一方、シェールガスやメタンハイドレートを含め将来的にも重要な資源となるメタンや、再生可能資源としてのバイオマス (特に非可食バイオマス) 等、様々な炭素資源からのメタノールへの変換については、バイオプロセスによる変換システムは工業レベルでは確立されておらず、現状では高温・高圧下で多大なエネルギーを投入するガス化・触媒反応による環境負荷の大きいプロセスとなっている。筆者らが開発したメタノールセンサー酵母を用いたメタノール生成活性評価・酵素工学スクリーニング系を用いたMOBやPMEの高機能化を達成し、さらに有用物質生産のための代謝系と合成生物学的に組みあわせることができれば、メタンやバイオマスの生物資源化が可能となる。
以上のように、C1微生物の代謝生理機能は、メタノールから様々な有用物質への変換だけでなく、メタンやバイオマスからメタノールへの変換にも活用することができ、未来型資源として有望なメタンやメタノールの有用物質生産バイオプロセスへの積極的導入に繋がり、資源循環型物質生産系としてのメタノールバイオエコノミーの構築に大いに貢献することができる。
文献
1) Olah, G. A.: Angew. Chem. Int. Ed., 44, 2636-2639 (2005).
2) Olah, G. A., Goeppert, A., Prakash, P. K. S.: メタノールエコノミー −CO2をエネルギーに変える逆点の発想−, 化学同人 (2010).
3) Kalyuzhnaya, M. G., Puri, A. W., Lidstrom, M. E.: Metab. Eng., 29, 142-145 (2015).
4) Riesenberg, D., Guthke, R.: Appl. Microbiol. Biotechnol., 51, 422-430 (1999).
5) Ochsner, A. M., Sonntag, F., Buchhaupt, M., Schrader, J., Vorholt, J. A.: Appl. Microbiol. Biotechnol., 99, 517-534 (2015).
6) Trotsenko, Y. A., Torgonskaya, M. L.: Adv. Biotech. Micro., 9, 555763 (2018).
7) Ogata, K., Nishikawa, H., Ohsugi, M.: Agric. Biol. Chem., 33, 1519-1520 (1969).
8) Cregg, J. M., Barringer, K. J., Hessler, A. Y., Madden, K. R.: Mol. Cell. Biol., 5, 3376-3385 (1985).
9) Gellissen, G.: Appl. Microbiol. Biotechnol., 54, 741-750 (2000).
10) Yurimoto, H., Sakai, Y.: Biotechnol. Appl. Biochem., 53, 85-92 (2009).
11) Yurimoto, H., Oku, M., Sakai, Y.: Int. J. Microbiol., 2011, 101298 (2011).
12) Yurimoto, H., Sakai, Y.: Curr. Issues Mol. Biol., 33, 197-210 (2019).
13) Kawaguchi, K., Yurimoto, H., Oku, M., Sakai, Y.: PLoS One, 6, e25257 (2011).
14) Ohsawa, S., Yurimoto, H., Sakai, Y.: Mol. Microbiol., 104, 349-363 (2017).
15) Takeya, T., Yurimoto, H., Sakai, Y.: Appl. Microbiol. Biotechnol., 102, 7017-7027 (2018).
16) Kawaguchi, K., Yurimoto, H., Sakai, Y.: Biosci. Biotechnol. Biochem.,78, 718-721 (2014).
17) Balasubramanian, R., Smith, S. M., Rawat, S., Yatsunyk, L. A., Stemmler, T. L., Rosenzweig, A. C.: Nature, 465, 115-119 (2010).
18) 矢野龍一, 竹谷友之, 由里本博也, 寳関 淳, 緒方英明, 嶋 盛吾, 阪井康能: 日本農芸化学会2019年度大会講演要旨集, 3D7p15 (2019).
19) Chistoserdova, L.: Curr. Opin. Biotechnol., 50, 189-194 (2018).
20) Antoniewicz, M. R.: Curr. Opin. Biotechnol., 59, 165-174 (2019).