【トピックス】
佐藤喬章
京大院・工
1.はじめに
アーキアは、真核生物やバクテリアとは異なる第三のドメインを構成する微生物群であり、高温・高塩濃度・酸性/アルカリ性など、極限的な環境に生育するものが多い1)。また、アーキアの代謝は真核生物やバクテリアのものとは異なることが多いのも特徴の一つである。例えば、核酸は全ての生物において重要な物質であるがその核酸の生合成経路ですら、アーキアでは他の2つのドメインの生物とは異なっている。真核生物およびバクテリアは核酸の前駆体リブロース-5-リン酸をペントースリン酸経路により生合成しているが、アーキアの多くはリブロースモノリン酸経路により生合成している2,3)。筆者らは、これまでには知られていなかった新しい酵素や代謝経路を同定することを目指し、アーキアの代謝研究を進めている。このトピックでは、本研究で同定したアーキアにおける新規システイン生合成経路とそこで機能する新規酵素について紹介したい4)。
2.各生物のシステイン生合成経路
システインは含硫アミノ酸の一つで、反応性の高いチオール基を有することからタンパク質の活性残基になることや、架橋構造を形成してタンパク質の3次構造の形成に寄与することなどが知られている。システインに関しては各生物において様々な生合成経路が存在する。一般的によく知られている主要な経路は図1Aに示した経路1と経路2である。哺乳類や酵母は経路1を用いており、メチオニンからシスタチオニンを介してシステインを生合成する5)。一方、バクテリアや植物は、セリンからO-アセチルセリンを合成し、cysteine synthase (CysK) によってアセチル基をチオール基に置換してシステインを生合成する経路2を利用している6,7)。
また、超好熱性アーキアAeropyrum pernixのCysKはO-アセチルセリンだけでなくO-ホスホセリンも基質とし、システインを合成できることが報告されている8)。A. pernixのゲノム中にはO-アセチルセリンを合成するserine acetyltransferase (SAT) のホモログがないことから、3-ホスホグリセリン酸からO-ホスホセリンを経てシステインを生合成する経路3の存在が示唆される。本経路はアーキアのみに存在するのではなく、寄生原虫の1種Trichomonas vaginalisは経路1と共に経路3も利用するとされている9)。また図1には示さなかったが、O-アセチルセリンからO-スルホセリンを経てシステインを生合成する経路の存在も示唆されている10,11)。
また、メタン生成菌の一部やArchaeoglobusは上記3種とは全く異なるシステイン生合成機構を有しており、これはアーキア特有の代謝の代表例の一つとも言える12)。本経路においてシステイン (正確にはcysteinyl tRNACys) はtransfer RNA (tRNA) 上で合成される (図1B)。まずO-phosphoseryl-tRNA synthetase (SepRS)によるアミノアシル化反応によりO-ホスホセリンがシステイン用のtRNA (tRNACys) に結合してO-phosphoseryl tRNACysが合成される。次に、O-ホスホセリン由来のリン酸基がSep-tRNA:Cys-tRNA synthase (SepCysS)によりチオール基に置換され、cysteinyl tRNACysが形成し、タンパク質の合成に利用される。
一方、超好熱性アーキアThermococcus kodakarensisを含む多くのアーキアでは、既知の経路を構成する各遺伝子群が保存されていると明確に判別できるケースは少なく、どのようにシステインを生合成しているのかは不明であった。
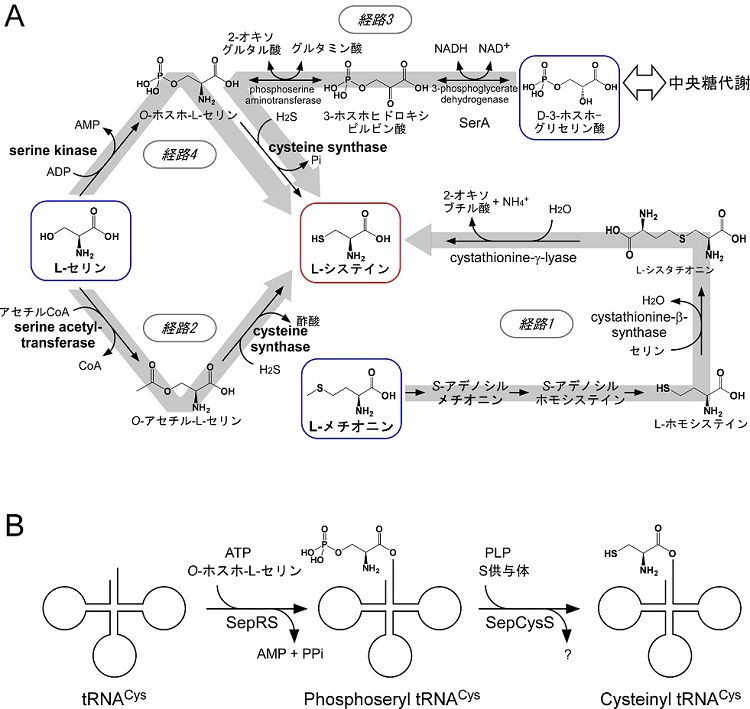
図1 様々なシステイン生合成経路
3.T. kodakarensisにおけるシステイン生合成経路の同定
3-1 既知システイン生合成経路の検討
T. kodakarensisはシステインを含まないアミノ酸合成培地で増殖できることから、他の19種類のアミノ酸からシステインを生合成できることが分かっていた。しかし、上述のようにゲノム解析の情報だけからではシステイン生合成経路を同定できず、新規な生合成経路や酵素が存在する可能性も考えられた。そこで筆者らは超好熱性アーキアT. kodakarensisにおけるシステイン生合成経路の解明を目指して研究を進めた。
まず既知経路の鍵酵素をコードする可能性のある遺伝子の破壊株を作製し、システイン要求性を示すかを検討した。メチオニンからシステインを生合成する経路1について、本菌はメチオニンからホモシステインを生合成する遺伝子は有していると考えられたが、cystathionine-β-synthase (CBS) およびcystathionine-γ-lyase (CGL) については明確なホモログは見つかっていなかった。しかし、TK1449タンパク質はSaccharomyces cerevisiae S288c由来のCGLと38%の相同性 (identity) を示し、TK1687タンパク質は少し全長が短いもののS. cerevisiae S288cのCBS (N末領域) と34%の相同性を示した。そこでTK1449遺伝子を破壊し、システイン要求性を調べた。しかし、システインを含まない培地において破壊株は宿主と同程度の増殖を示し、メチオニンからの生合成経路1は少なくとも主要な経路ではないことが示された。
次に3-ホスホグリセリン酸からの経路3について調べた。大腸菌の3-phosphoglycerate dehydrogenase (SerA) と42%の相同性を示すTK1966の遺伝子を破壊した。さらに、低いながらもSerAと相同性を示すTK0551 (29% identity) およびTK0683 (31% identity) の遺伝子も破壊した三重破壊株を作製したがシステイン要求性は示さなかった。よって経路3も主要な経路ではないことが示された。経路1と経路3が両方機能し、互いが相補できる可能性も考えて、3-ホスホグリセリン酸からの経路を遮断した三重破壊株を宿主としてさらにTK1449遺伝子を破壊しメチオニンからの経路も遮断した四重破壊株を作製したが、やはりシステイン要求性は示さなかった。
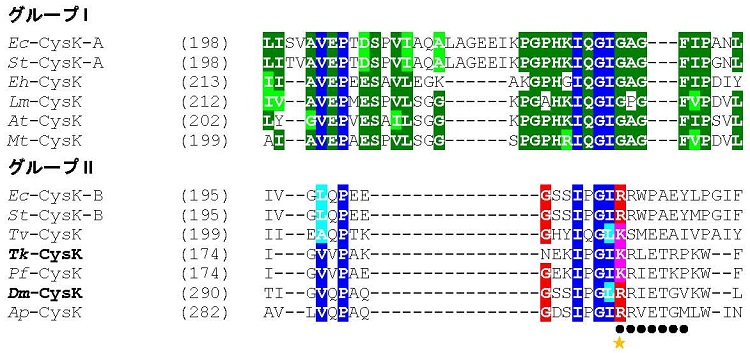
最後に経路2の可能性を検討することにした。まずSATの明確なホモログはT. kodakarensisのゲノム中には見つからなかった。一方、先述のCBSと相同性を示すTK1687タンパク質は、アーキア由来CysKとも相同性を示す (例えばA. pernix 由来CysKと36%のidentityを示す)。そこで、TK1687遺伝子破壊株を作製したところ、ついにシステイン要求性を示す株が得られた (図2AB)。3-ホスホグリセリン酸からの経路ではないことが上述のように分かっていたので、既知のSATとはアミノ酸配列上相同性を示さない新規なSATが存在する可能性も考えられたが、TK1687の配列を詳細に解析することで別の可能性が浮かび上がった。A. pernix由来のCysKにはO-ホスホセリンが基質として受け入れられるように、基質ポケットを広げると考えられる特徴的な挿入配列があり、またその配列中には負電荷の基質を認識できる正に荷電するアルギニン残基が存在する9,13)。T. kodakarensis由来のCysK (Tk-CysK) にもこの特徴的な挿入配列があり、またアルギニン残基の位置には正に荷電するリジン残基が存在した (図3)。よって、Tk-CysKもO-ホスホセリンを基質にする可能性が高いと考えられた。これらの結果を基に考えたのが、セリンを直接リン酸化してO-ホスホセリンに変換する酵素があるのではないか?という可能性であった。
3-2 Serine kinaseの探索
ATPをリン酸基供与体、L-セリンをリン酸基受容体とし、産生するADPを検出する方法でT. kodakarensisの無細胞抽出液中のserine kinase活性を測定した。しかし、残念ながらそのような活性は検出されなかった。ただこの際、意外なことにセリンを含まないコントロール (ADP濃度:0.45±0.01 mM) と比較して、セリンを含むサンプルにおいてむしろADPの減少 (ADP濃度:0.25±0.01 mM) が検出された。ADPは購入したATPにもともと夾雑物として含まれており、さらに高温での活性測定中にATPの熱分解により生じるのだが、このADPの減少に注目したことが新しい酵素の発見に繋がることとなった。話は少し変わるが、真核生物やバクテリアの解糖系酵素glucokinaseやphosphofructokinaseは他の多くのkinaseと同様にATPをリン酸基供与体とするのに対し、T. kodakarensisを含む一部のアーキアにおけるglucokinaseやphosphofructokinaseはATPではなくADPをリン酸基供与体とする特徴がある14)。そこでT. kodakarensisの“まだ見ぬ”serine kinaseもADPをリン酸基供与体とするのではないかという可能性を考えた。そこで、改めてADPをリン酸基供与体とし、産生するAMPをHPLCにより定量して活性を測定したところ、確かに無細胞抽出液中にADP-dependent serine kinase (ADP-SerK) 活性が検出された。


3-3 ADP-dependent serine kinase (ADP-SerK) の同定
ADP-dependent serine kinaseを同定するため、無細胞抽出液中からこの活性を示すタンパク質の精製を進めた。各精製画分に対して活性測定を行うと同時にSDS-PAGEにより含まれるタンパク質を解析した。その結果、活性の大きさとSDS-PAGEにおけるバンドの濃さが相関しているタンパク質を3つ選抜できた。これらについてLC-MS解析を行ったところ、TK0378 (chromosomal partitioning protein ParB) , TK1110 (ADP-dependent glucokinase) , TK1998 (hypothetical protein) であることが分かった。この段階では筆者らはTK1110がグルコースだけでなくセリンもリン酸化するkinaseなのではないかと予測した。
これら3タンパク質の組換え型タンパク質を、大腸菌を用いて調製し、ADP-SerK活性を示すかを調べた。その結果、意外なことにTK1110およびTK1998タンパク質は有意な活性を示さなかったのに対し、TK0378タンパク質が活性を示した。各種カラムクロマトグラフィーによって精製を進めたところ、精製TK0378組換え型タンパク質は高い活性を示した (286±36 µmol min-1 mg-1)。このことからTK0378がADP-SerK活性を有することが明らかとなった。さらに生化学的解析を進めた結果、本タンパク質はserine protein kinaseの一つhuman RAC-αserine/threonine-protein kinase (Akt1) の基質であるペプチド断片 (Crosstide: Gly-Arg-Pro-Arg-Thr-Ser-Ser-Phe-Ala-Glu-Gly) 中のSer残基や、セリンと構造が似ているスレオニンやホモセリンには活性を示さず、比較的高い基質特異性を示すことが分かった。逆にAkt1も遊離のセリンに対しては活性を示さなかった。タンパク質中のセリン残基をリン酸化するserine protein kinaseはよく知られていたが、筆者が知る限り遊離のセリンをリン酸化する酵素としては実はTK0378が初の同定例である。
3-4 ADP-SerKの生理的役割の解析
3-4-1 システイン生合成への寄与
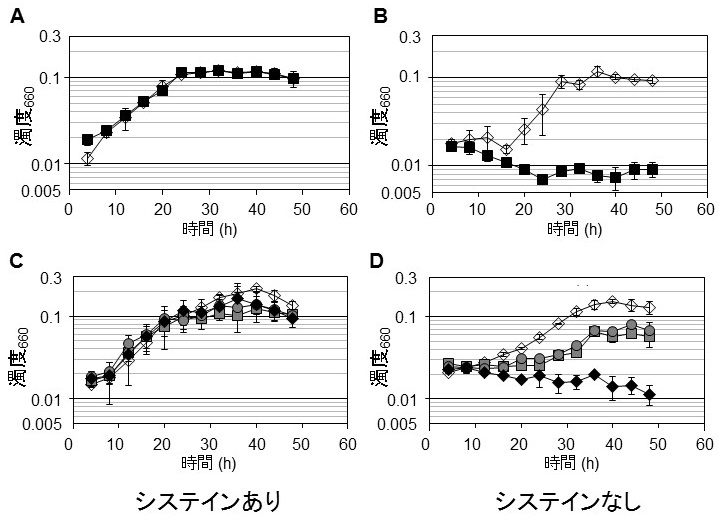
生理的役割を解析するため、TK0378遺伝子の破壊株を作製し、システイン要求性を調べた。その結果、システインを含まない培地で確かに増殖が悪化し、TK0378がシステイン生合成に関与していることが明らかとなった (図2CD)。つまり、ADP-SerKとCysKが構成する、セリン→O-ホスホセリン→システインという新規なシステイン生合成経路を同定することができた (図1A経路4)。しかし完全なシステイン要求性は示さなかったことから、本経路を相補できる経路の存在が示された。そこでTK1449破壊株 (メチオニンからの経路を遮断) およびTK1966-TK0551-TK0683破壊株 (3-ホスホグリセリン酸からの経路を遮断) のTK0378遺伝子破壊を行い、それぞれ経路1+4と経路3+4を遮断した2つの株を作製した。これらの株の増殖特性を解析した結果、ΔTK1449-ΔTK0378の二重破壊株はTK0378単独破壊株と同程度のシステイン要求性しか示さなかったのに対し、ΔTK1966-ΔTK0551-ΔTK0683-ΔTK0378の四重破壊株は完全なシステイン要求性を示した (図2CD)。これらのことから、少なくとも今回実験に用いたアミノ酸合成培地においては、TK0378が構成する経路 (図1A経路4) が主要なシステイン生合成経路であり、経路3は経路4を相補できることが明らかとなった4)。
3-4-2 Serine代謝への寄与の可能性
実験的にはまだ証明できてはいないものの、serine kinaseはセリン代謝にも寄与している可能性が考えられる。Phosphoserine aminotransferase (Pat) とSerAの反応は両方向に進むと考えられることから、これらの3酵素がセリン→O-ホスホセリン→3-ホスホヒドロキシピルビン酸→3-ホスホグリセリン酸 (図1A) という代謝経路を構成している可能性が考えられる。Desulfurococcales目に属するアーキアの一部ではTK0378と比較的高い相同性を示すホモログとPatやSerAをコードする遺伝子がオペロンを形成している場合がある4)。さらに、その中には上述のO-ホスホセリンを基質とするCysKに特徴的な配列がないCysKしか持たない株も存在し、その生物のserine kinaseはシステイン生合成よりむしろセリン代謝経路を構成している可能性もある。
4.おわりに
本稿ではT. kodakarensisにおける新規酵素ADP-SerKの同定とその酵素が形成する新規システイン生合成経路の同定について紹介した。本酵素と高い相同性を示すタンパク質はアーキアの一部のみに存在するが、低いながらも相同性を示すタンパク質はアーキアだけでなくバクテリアにも分布している。これらの多くはchromosome partitioning proteinとannotateされているが、真の機能はTK0378と同様にserine kinaseである可能性や、また別の新規反応を触媒する酵素である可能性もある。今後の研究でこれらの酵素の特性や上述のセリン代謝への寄与などを明らかにしていきたい。
謝辞
本稿で紹介したトピックは、京都大学・跡見晴幸教授、立命館大学・今中忠行教授、京都大学の牧野勇樹氏、川村弘樹氏、蜂須賀真一氏、竹野領氏らと共に行った研究による成果であり、この場をお借りして深く御礼申し上げます。また、本研究はJST, CREST(藻類・水圏微生物の機能解明と制御によるバイオエネルギー創成のための基盤技術の創出)からの助成金による支援のもとで遂行されました。
文献
1) 石野良純, 跡見晴幸 (編著): アーキア生物学 (2017).
2) Orita, I., Sato, T., Yurimoto, H., Kato, N., Atomi, H., Imanaka, T., Sakai, Y.: J. Bacteriol., 188, 4698 (2006).
3) Soderberg, T.: Archaea, 1, 347 (2005).
4) Makino, Y., Sato, T., Kawamura, H., Hachisuka, S. I., Takeno, R., Imanaka, T., Atomi, H.: Nat. Commun., 7, 13446 (2016).
5) Griffith, O. W.: Methods Enzymol., 143, 366 (1987).
6) Hell, R.: Planta, 202, 138 (1997).
7) Kredich, N. M., Tomkins, G. M.: J. Biol. Chem., 241, 4955 (1966).
8) Mino, K., Ishikawa, K.: FEBS Lett., 551, 133 (2003).
9) Westrop, G. D., Goodall, G., Mottram, J. C., Coombs, G. H.: J. Biol. Chem., 281, 25062 (2006).
10) Nakatani, T., Ohtsu, I., Nonaka, G., Wiriyathanawudhiwong, N., Morigasaki, S., Takagi, H.: Microb. Cell Fact., 11, 62 (2012).
11) Sekowska, A., Kung, H. F., Danchin, A.: J. Mol. Microbiol. Biotechnol., 2, 145 (2000).
12) Sauerwald, A., Zhu, W., Major, T. A., Roy, H., Palioura, S., Jahn, D., Whitman, W. B., Yates, J. R., 3rd, Ibba, M., Soll, D.: Science, 307, 1969 (2005).
13) Oda, Y., Mino, K., Ishikawa, K., Ataka, M.: J. Mol. Biol., 351, 334 (2005).
14) Brasen, C., Esser, D., Rauch, B., Siebers, B.: Microbiol. Mol. Biol. Rev., 78, 89 (2014).