【トピックス】
増殖非依存型バイオプロセスを用いたバイオリファイナリー
清水雅士、乾 将行
1.はじめに
我々の身の回りには石油由来の燃料、プラスチック、繊維、ゴム、溶剤、塗料、洗剤など、様々な製品が溢れかえっている。これらは石油リファイナリーによって作り出されている。石油は枯渇が懸念される資源であるとともに、燃料として用いる際に発生するCO2が地球温暖化の原因となっているため、再生可能な原料への転換が地球環境保全の観点から望まれている。一方、植物 (バイオマス) は再生可能資源であり、石油の代替として原料に用いると大幅なCO2削減効果がある。植物を原料にした化学品生産産業はバイオリファイナリーと呼ばれ、国内外の大手化学メーカーが挙ってバイオリファイナリー分野に進出していることからもわかるように、非常に注目されている。2020年にはバイオマス由来の製品の市場規模は3750-4110億ドルに達すると予測されている1)。 図1にバイオリファイナリーの概要を示す。バイオマスは前処理・酵素糖化により糖類まで分解され、微生物がその糖類を原料に、有用物質を作り出す。微生物によるバイオ変換プロセスは常温・常圧で行われ、環境負荷が小さい。しかしながらバイオリファイナリーで製造できる製品は石油由来に比べまだ種類が少なく、また価格競争力が不十分であることが課題となっている。RITEが開発した増殖非依存型バイオプロセス (RITE Bioprocess) は、非可食バイオマスを利用する際に必要となる混合糖同時利用や発酵阻害物質耐性などの技術を装備した唯一の高生産バイオプロセスである。本稿では本プロセスに関するRITEでのラボレベルの試験の概要とGreen Earth Institute (株) における商用化に向けた取組みについて紹介する。
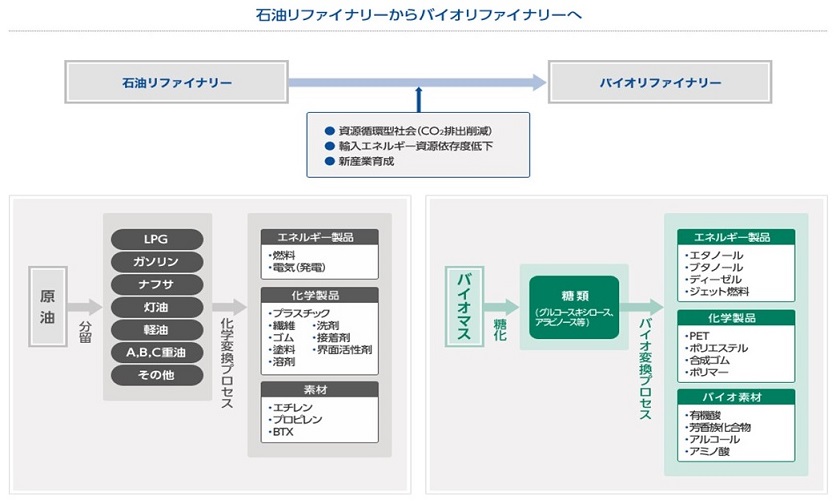
図1 バイオリファイナリーの概要
2.コリネ型細菌を用いた増殖非依存型バイオプロセスについて
RITEでは Corynebacterium glutamicum R (図2) を用いた増殖非依存型バイオプロセスをコア技術として、各種有用物質の生産技術の開発、特にバイオリファイナリーの研究に長年注力してきた。
図2 Corynebacterium glutamicum R
2-1 コリネ型細菌
コリネ型細菌C. glutamicumは、L-グルタミン酸を培地中に排出する微生物として1950年代に日本で分離された。コリネ型細菌はミコール酸含有放線菌群に属し、胞子形成能を持たない、非運動性、通性嫌気性のグラム陽性細菌である。現在、全世界で200万トン以上のL-グルタミン酸ナトリウムがうま味成分としてコリネ型細菌を用いた発酵法により製造されている。
コリネ型細菌の発見から約60年が経過した現在、従来のグルタミン酸、リジンなどのアミノ酸や核酸の生産のみならず、有機酸、アルコール、芳香族化合物などの様々な有用化合物の生産へとその応用の幅が広がっている。
コリネ型細菌は通常の条件下での増殖時にはグルタミン酸をまったく生産しないが、ビオチン制限、ペニシリン添加、界面活性剤添加などによって細胞表層構造の変化を誘起すると、グルタミン酸を生産することが知られている。RITEでは、コリネ型細菌が増殖不能な酸素制限条件下において高い代謝活性を維持することを見出した2)。この発見が素地となり、RITEでの「増殖非依存型バイオプロセス」の開発へとつながった。
2-2 増殖非依存型バイオプロセス (RITE Bioprocess)
通常の発酵では、微生物は増殖しながら目的物質を生産する。一方、増殖非依存型バイオプロセスでは菌体を好気条件で増殖させた後、酸素制限条件下で菌体を触媒のように用いて物質生産を行う (図3)。この方法のメリットとしては、菌体の増殖を伴わないため物質生産におけるエネルギーロスが少なく対原料収率が高いという点があげられる。また、菌体を触媒のように利用することから
繰り返し生産が可能で物質生産コストが抑えられるというメリットもある。これらに加え、最大のメリットは増殖を阻害する物質が含まれる原料からでも物質生産を行える点である。バイオリファイナリーにおいて木質及び草本系の非可食バイオマスを原料とする際、前処理・糖化の工程でフルフラールや4-ヒドロキシベンズアルデヒド (4-HB) などの発酵阻害物質が生じる。増殖非依存型バイオプロセスでは物質生産時に菌体の増殖を要しないことから、発酵阻害物質を含有するこのような原料からでも高効率な物質生産が可能である3) (図4)。また、コリネ型細菌には芳香族化合物やアルコール類に対する耐性が高いという特徴がある。この特徴を生かすことによって、生成物自体が増殖を阻害するため増殖を伴う従来の発酵では生産が難しいとされているブタノールや芳香族化合物などの生産に成功した8)。
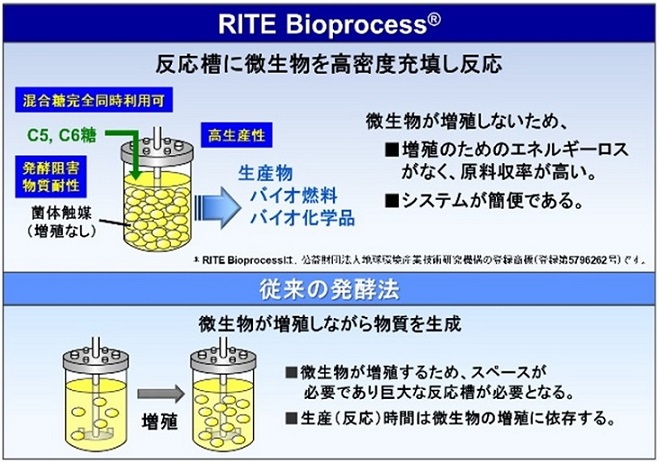
図3 増殖非依存型バイオプロセス
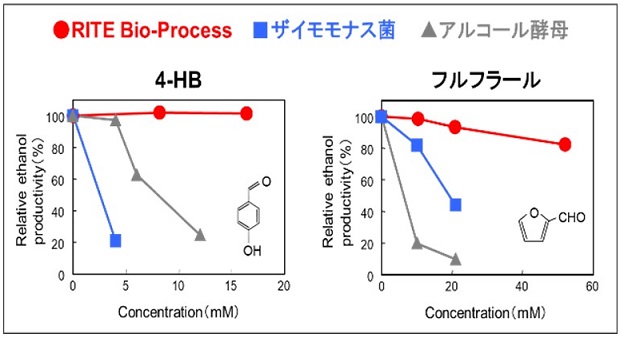
図4 発酵阻害物を含む原料でのエタノール生産
2-3 開発ポートフォリオ
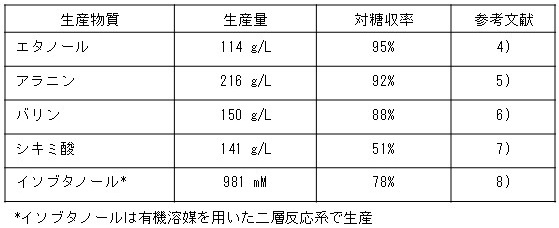
RITEでは表1に示す化合物を生産する菌体の開発を行っている。菌体開発には副生経路遺伝子の破壊、他生物由来遺伝子の導入、生産経路遺伝子の発現強化、糖取込み能強化、混合糖利用能の付与などの代謝経路の最適化や、フィードバック阻害解除、補酵素特性改良などの酵素機能改良の二つの方法を用いている。表2に増殖非依存型バイオプロセスで生産し得る主な物質の生産量を示す。
表1 RITEにおける加発ポートフォリオ
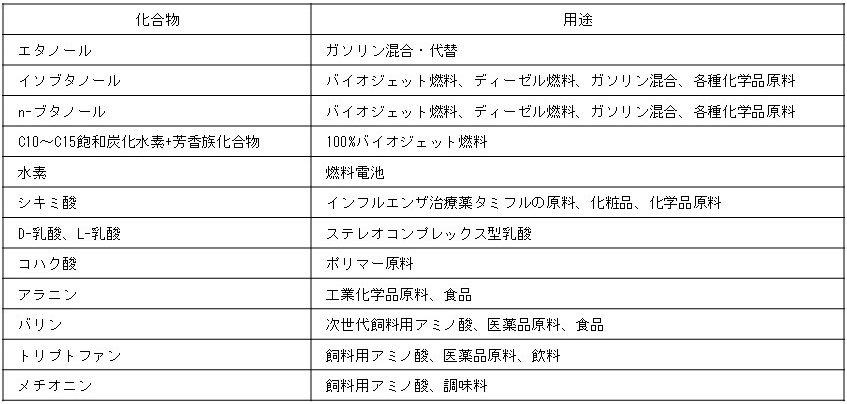
表2 増殖非依存型バイオプロセスでの生産量
3.増殖非依存型バイオプロセスを用いた産業応用
増殖非依存型バイオプロセスの商用化について、Green Earth Institute株式会社の事業活動を例として紹介する。
3-1 Green Earth Institute株式会社について
Green Earth Institute株式会社 (以下、GEI) は2011年9月にRITE Bioprocessの商用化実現のために設立されたベンチャー企業である。国内には大学発や理化学研究所、産業技術総合研究所などの国立研究開発法人発のベンチャー企業が存在するが、GEIは国内初の公益財団法人を母体とするベンチャー企業である。GEIではRITE で開発した増殖非依存型バイオプロセスを用いて、「食糧問題の解決」、「エネルギー問題の解決」、「廃棄物問題の解決」、「地球環境問題の解決」を目指し事業活動を行っている。その中で、現在特に注力しているアミノ酸事業を紹介する。
3-2 アミノ酸事業
GEIではアラニン、バリン、メチオニン事業に取り組んでいる。新興国における人口増加の影響から食品添加物や飼料添加物としてのアミノ酸の需要が高まっている。また、一部のアミノ酸についてはシャンプーや化粧品、ポリマー原料としても需要がある。
アラニンについては国内中堅アミノ酸メーカーと合弁会社を設立し、中国で生産に取り組んでいる。2016年には商用レベルでの生産に成功した。本プロセスで生産に成功したアラニンは、2017年8月現在、厚生労働省の遺伝子組換え食品の安全性に関する承認のための審査を受けている。承認されれば、味の素、協和発酵バイオ以外では初のアミノ酸における承認取得となる。
バリンについては菌体開発に目途がつき、商用化に向けて生産条件を検討している。今年度中にはパイロットスケールでの生産試験を行う予定である。増殖非依存型バイオプロセスの特徴として、生産する物質が異なっても生産条件は大きく変わらないことがあげられる。菌体が増殖しながら物質を生産する通常の発酵プロセスでは、菌体ごとに物質生産に適した培養条件の検討が必要であるが、増殖非依存型バイオプロセスは菌体が異なっても生産条件を大きく変更することなく、比較的簡単に運用できる。つまり、アラニンでの生産条件をバリンでも採用することが可能である。そのため、バリンでの商用生産までに要する時間をゼロから検討するのに比べ大幅に短縮できた。特にベンチャー企業にとって開発期間の短縮は非常に大きなメリットである。
メチオニンについてはGEIにて菌体開発中である。メチル基と硫黄を導入せねばならず、技術的に大きな課題があるが、鶏の飼料添加物としての需要が東南アジアを中心 (世界市場規模:年間100万トン) に高まっている。ベンチャー企業としては非常にチャレンジングながら、ニーズが明確なため、同時に極めてやりがいのあるターゲット物質である。
アラニンのように既に商用生産可能なものからメチオニンのように研究開発段階のものまで様々な開発パイプラインを擁して躍進を続け、バイオリファイナリー産業の拡大に向けて貢献していきたいと考えている。
4.おわりに
本稿では、増殖非依存型バイオプロセスがラボレベルの研究から商用生産にいたった背景と過程を紹介した。現在のバイオリファイナリーは石油リファイナリーに比べれば競争力が高いとは言い難いが、環境負荷軽減を求める声が日増しに高まっており、技術革新と価値観の変化に伴いやがて競争力が付くと信じている。また、石油化学では合成が難しい物質でもバイオリファイナリーでは生産できる場合があり、そのような物質を生産することはGEIのような小さなベンチャー企業の生存とバイオリファイナリー産業の発展のために特に重要と考えられる。
文献
1) Biotechnology Innovation Organization Report 2016
https://www.bio.org/advancing-biobased-economy-renewable-chemical-biorefinery-commercialization-progress-and-market
2) Inui, M., Murakami, S., Okino, S., Kawaguchi, H., Vertes, A. A., Yukawa, H.: J. Mol. Microbiol. Biotechnol., 7, 182-196 (2004).
3) Sakai, S., Tsuchida, Y., Nakamoto, H., Okino, S., Ichihashi, O., Kawaguchi, H., Watanabe, T., Inui, M., Yukawa, H.: Appl. Environ. Microbiol., 73, 2349-2353 (2007).
4) Jojima, T., Noburyu, R., Sasaki, M., Tajima, T., Suda, M., Yukawa, H., Inui, M.: Appl. Microbiol. Biotechnol., 99, 1165-1172 (2015).
5) Yamamoto, S., Gunji, W., Suzuki, H., Toda, H., Suda, M., Jojima, T., Inui, M., Yukawa, H.: Appl. Environ. Microbiol., 78, 4447-4457 (2012).
6) Hasegawa, S., Suda, M., Uematsu, K., Natsuma, Y., Hiraga, K., Jojima, T., Inui, M., Yukawa, H.: Appl. Environ. Microbiol., 79, 1250-1257 (2013).
7) Kogure, T., Kubota, T., Suda, M., Hiraga, K., Inui, M.: Metab. Eng., 38, 204-216 (2016).
8) Yamamoto, S., Suda, M., Niimi, S., Inui, M., Yukawa, H.: Biotechnol. Bioeng., 110, 2938-2948 (2013).