【トピックス】
バイオ直交化学による接着性成長因子の創成
宮武秀行、伊藤嘉浩
理研・伊藤ナノ医工学研、理研・伊藤ナノ医工学研
1.はじめに
遺伝子組み換え技術によってさまざまなタンパク質を設計し合成できるようになった。さらに近年では、遺伝子暗号でコードされた天然型アミノ酸を置換したり、配列を組み換えたりすることのみにとどまらず、様々なバイオ直交化学 (bioorthogonal chemistry) 的アプローチにより、遺伝子にはコードされていない、あるいは翻訳後修飾でしか導入できないような非天然アミノ酸をタンパク質に導入できるようなった。バイオ直交化学とは、2000年代に提唱された概念である1)。一般にバイオ直交化学とは、生体内のような多数のタンパク質が存在する混合系でも、特定のタンパク質に部位特異的に高効率で修飾基などを導入できる方法を指す。ここでは、バイオ直交化学により、水中接着タンパク質の接着性部位にある非天然アミノ酸を成長因子タンパク質に導入し、接着性の成長因子を創成した研究を紹介する。
現在わが国では、国民の10〜15人に1人が人工臓器を使用していると推定されている2)。高齢化社会の急速な進展や、スポーツ人口の増加に伴い、人工臓器の重要性は今後さらに高まって行くだろう。材料工学の進歩により、人工臓器に使用される材料も変化してきた。かつては生体に親和性のある素材が使用されるのみであったが、近年では、金属やセラミックスなどの無機材料や、プラスチックなどの有機材料も人工臓器用の新素材として使用されるようになった。金属材料としてはチタンがよく使用される。チタンは比重がアルミニウムと鉄との中間程度の軽い素材であるにもかかわらず、チタン合金は実用金属の中でも最大級の比強度 (密度あたりの引っ張り強度) を持つ。さらに、チタン材料の表面に形成される酸化チタン膜は非常に安定であるため、金や白金と同程度の耐腐食性を示す。そのため、チタンは人工関節や歯科インプラントなどの強度を必要とする人工臓器で実用化されている。しかしチタンは、本来生体との親和性が低いために、移植後に生着するまで長時間を要する。その間に感染症が引き起こされて、移植の失敗につながることが問題となっている。こうした問題を解決する方法としては、無機材料の表面に生着を促進する成長因子タンパク質などを固定化する手法が考えられる。しかし今まで、医療目的で、成長因子タンパク質を無機材料表面に効率よく固定化する方法はなかった。
そこで、無機医療材料の生着性を向上させるため、我々はムール貝が濡れた岩場にも接着できる性質に着目した3)。この接着性は、自身が分泌する粘性物質に含まれる接着タンパク質に由来する。この接着物質は、水中でガラス、プラスチック、テフロン、金属、木材、歯、骨などほぼ全ての物質に強力かつ可逆的に接着可能で4)、しかも生体への安全性が高いという、再生医療には理想的な性質を持つ。そのため、以前から医療への応用が期待されてきた。
2.ムール貝の接着機構
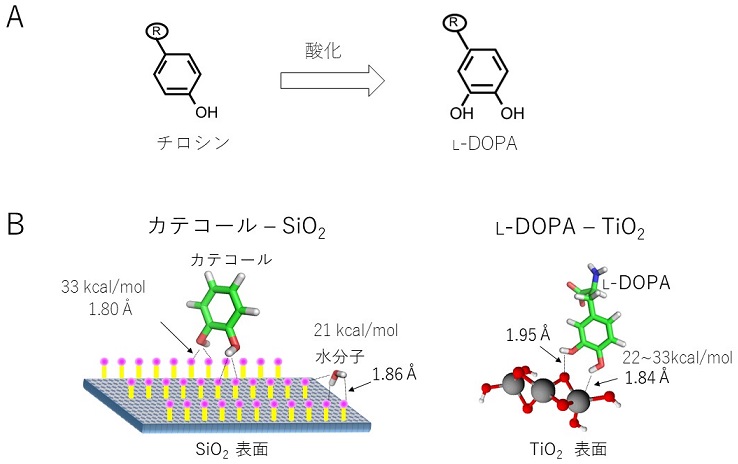
ムール貝は濡れた環境下で、糸足から分泌される接着プラークに含まれる接着タンパク質によって、岩場および他のムール貝にも強力に接着できる (図1)。接着タンパク質の主成分は、Mussel foot protein (Mfp) であり、現在までに少なくともMfp-1〜Mfp-10の10種類が同定されている5)。それらは、3,4-ジヒドロキシ-L-フェニルアラニン (L-DOPA) およびリシン (K) を高い割合で含有している4)。L-DOPAは天然アミノ酸のチロシン (Y) が酸化されることにより生成する6) (図2A)。L-DOPAはYよりも水酸基が1つ多く、Yや水分子と比較してより強く水素結合を形成できる。そのため、岩のモデル化合物であるSiO2との平均水素結合エネルギー (33 kcal/mol) や、チタン表面に形成される酸化チタンTiO2との平均水素結合エネルギー (22〜33 kcal/mol) は、ともに水分子の水素結合エネルギーを上回ると推定されている7,8)。そのため、L-DOPAは物質表面状の水分子に打ち勝って物質表面と強固な水素結合を形成し、濡れた環境下でも可逆的に接着性を発揮すると考えられる (図2B)。
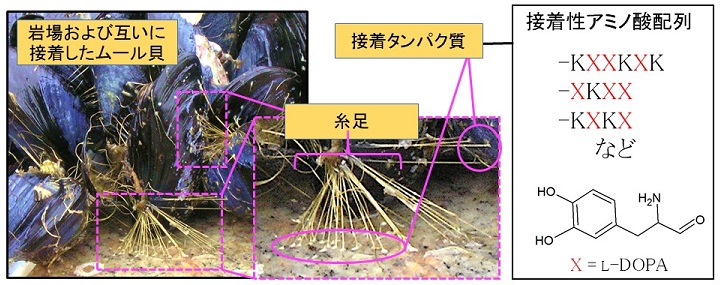
図1 ムール貝から分泌される接着性タンパク質中の接着性アミノ酸配列
一方、接着性アミノ酸配列にはKも多く含まれる。正電荷を帯びたKは、負電荷を帯びたコラーゲンや多糖類などとの吸着を強めると推定される9)。また、L-DOPAよりも吸着力が劣る、L-DOPAがさらに酸化されたL-DOPAキノンの生成を抑制したり10)、接着プラークの硬化を促進することで吸着力を向上させたりすることにも関与すると考えられている11)。

3.バイオ直交化学による、接着性成長因子タンパク質の調製
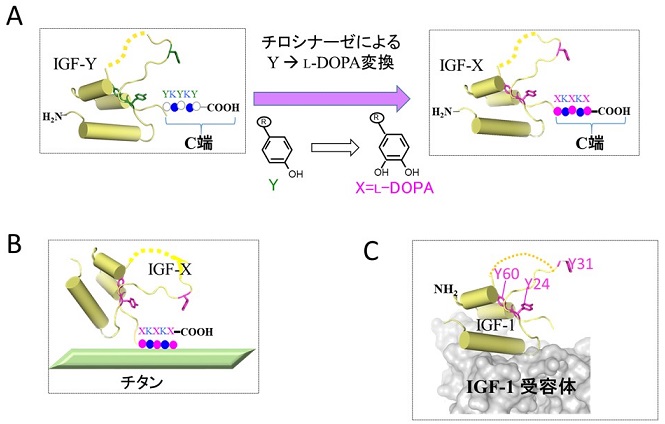
インスリン様成長因子 (IGF-1: Insulin-like Growth Factor-1) は、70アミノ酸残基ほどの小さなタンパク質である。IGF-1は、広く細胞増殖を促進する。そのため、IGF-1を医療材料表面に固定化できれば、それらの生着性の向上につながると期待できる。そこで、IGF-1に接着性を付与するために、タンパク質の狙いの箇所に目的の化学基を導入する方法、すなわちバイオ直交化学的な手法により、IGF-1をムール貝由来の接着成分で修飾した。まず、ムール貝の接着性ペプチド配列を模倣した人工接着配列である、XKXKX (X=L-DOPA) を設計した。次に、その前駆体である YKYKY配列を、IGF-1のC末端に遺伝子工学により導入し、IGF-Yを得た。さらに、チロシナーゼで IGF-1末端に導入されたYKYKYを、XKXKXに変換することによりIGF-Xを調製した (図3A)。IGF-Xは活性を保ったまま、C末端の XKXKXでチタンに吸着すると推定される (図3B)。チロシナーゼでY→Xに変換する際には、副反応として、IGF-1に元々含まれるY24、Y31、Y60もXに変換されるが、これらの残基はIGF受容体 (IGF1R) との相互作用には直接関与しないため、IGF-1の細胞成長促進活性には影響がないことを立体構造により確認した12) (図3C)。

4.IGF-Xの接着性測定
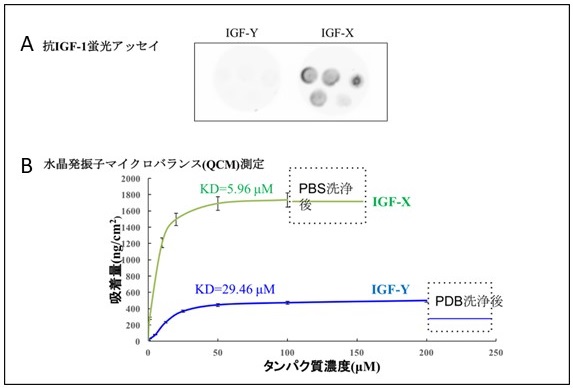
得られたIGF-Xのチタンに対する結合能を確認するために、抗IGF-1蛍光アッセイを行った。IGF-Xは、濃度の増加に伴いチタンへの結合量が増加するが、IGF-Yはまったく増加しなかった (図4A)。これにより、IGF-Xに接着性が付与されたことを確認できた。さらに、水晶発振子マイクロバランス (QCM) により、IGF-Xのチタンに対する吸着力を測定した。その結果、IGF-Yの解離定数KD=29.46µMに対して、IGF-Xでは5.96µMとなり、吸着力が約5倍増加したことがわかった。さらに、リン酸バッファーでチタン表面を洗浄後でも、IGF-Yが吸着量の半分程度洗い流されてしまうのに対して、IGF-Xではほとんど吸着量に変化がないことが分かった (図4B)。L-DOPAによって付与されたこのような吸着性は、ムール貝が波に洗われても岩場に強固に吸着し続ける姿を彷彿とさせる。

5.IGF-Xの細胞成長促進活性測定
一方、IGF-1の固定化により、IGF-1の活性そのものが増加することも分かった (図5)。固定化されていないIGF-Yと比較して、チタンに固定化されたIGF-Xに接触した細胞の増殖がより進行していることが分かる。これにより、IGF-1自身の活性が向上したことが分かった。
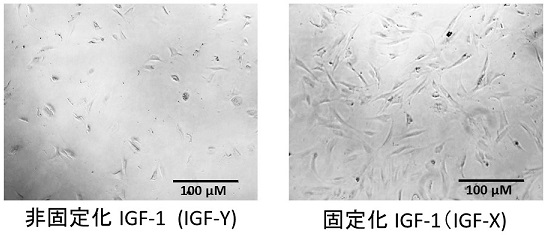
図5 固定化前後のIGF-1の細胞増殖促進活性の変化
固定化に伴うIGF-1の活性増強機構を解明するために、IGF-1とその受容体であるIGF1R間の情報伝達の様子を時分割で解析した。IGF-1がIGF1Rに結合すると、IGF1Rの細胞質側まで構造変化が伝達し、IGF1Rのチロシンがリン酸化することにより情報が伝達される。このリン酸化は、固定化されたIGF-Xの方が、固定化されていない場合に比べて長時間持続することが分かった (図6)。固定化されていないIGF-1では、IGF1Rに対する活性化効果が2時間程度で急速に減衰するのに対して、固定化されているIGF-Xでは、その効果が12時間以上持続していることが分かった。
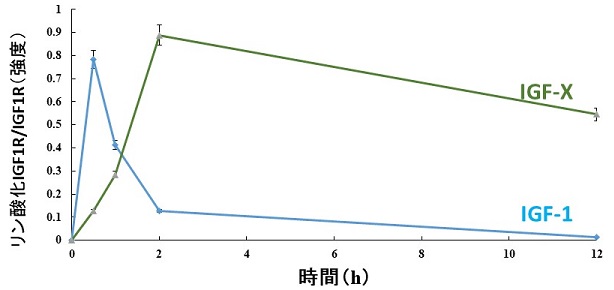
図6 IGF1受容体リン酸化の経時変化
これは、固定化されていないIGF-1は細胞表面のIGF1Rに結合後、細胞内部に取り込まれて増殖刺激が停止する一方、固定化されている場合には取り込まれず、長期間にわたり細胞に対して刺激を与え続けるためであると考えられる (図7)。固定化された成長因子タンパク質の活性が増強する現象は、すでにいくつかの例が報告されている13,14)。以上より、接着性IGF-1 (IGF-X) は長期間チタン表面に固定され、細胞内への取り込みを免れることにより、細胞増殖活性を増強させる分子機構が明らかになった。
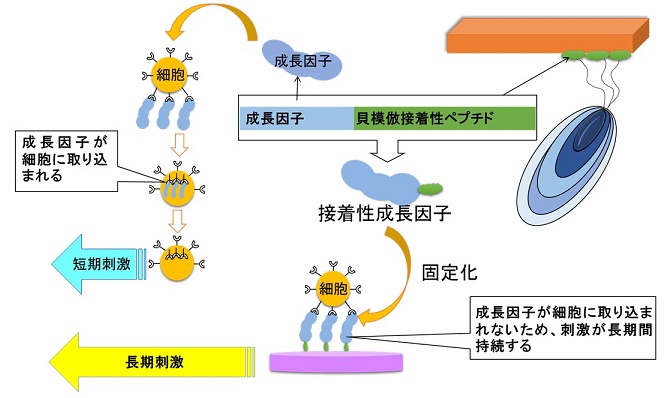
図7 接着性成長因子タンパク質の固定化と、それによる細胞への長期刺激
6.おわりに
今回のIGF-1の研究で得られた知見は、今後、他の成長因子タンパク質へ応用可能である。本手法で用いられた方法により、様々な成長因子タンパク質を、チタン、ステンレス、コラーゲン組織といった人工臓器に多用される素材に安定に固定化すれば、人工臓器の生着性の向上につながる。それにより、移植の成功率の改善が期待できる。また近年、複数の成長因子タンパク質を同時に適用することが、より効果的であることが報告されている。例えば、培養組織による血管生成を促すため、血管成長因子 (VEGF) とアンジオポエチンを足場組織に同時に固定したり15)、血小板由来成長因子PDGF-BBと線維芽細胞増殖因子FGF-2を同時にヒドロゲルに固定したりすると内皮細胞への刺激が大幅に強まることが報告されている16)。このように、複数の成長因子タンパク質を同時に使用することも、本手法により実現できると考えられ、今後、再生医療研究への応用が期待できる。
謝辞
本研究は、理研・稲葉岳彦博士、中国吉林大学・王宇教授、張晨博士、中国科学院長春応用化学研究所・章培標教授、王殻助教との共同研究である。LC/MS解析では、理研・BSIサポートユニットにお世話になった。関係者各位に深く謝意を表する。本研究は、科研費 (15H01810, 22220009)、MOST-RIKEN、CAS-JSPS (GJHZ1519) などの研究費で行われた。
文献
1) Sletten, E. M., Bertozzi, C. R.: Angew. Chem. Int. Ed. Engl., 48, 6974 (2009).
2) 巽 英介:週間医学界新聞, 2861, 1 (2010).
3) Lee, H., Scherer, N. F., Messersmith, B.: Proc. Natl. Acad. Sci. USA, 103, 12999 (2006).
4) Waite, J. K.: Int. J. Adhesion and Adhesives, 7, 9 (1987).
5) Heather, G. S., Roberto, F. F.: Marine Biotechnology, 9, 661 (2007).
6) Miaoer, Y., Jungyeon, H., Timothy, J. D.: J. Am. Chem. Soc., 121, 5825 (1999).
7) Mian, S. A., Saha, L. C., Jang, J., Wang, L., Gao, X. F., Nagase, S.: J. Phys. Chem. C, 114, 20793 (2010).
8) Vega-Arroyo, M., LeBreton, P. R., Rajh, T., Zapol, P., Curtiss, L. A.: Chemical Phys. Lett., 406, 306 (2005).
9) Suci, P., Geesey, G.: J. Colloid Interface Sci., 230, 340 (2000).
10) Yamamoto, H., Sakai, Y., Ohkawa, K.: Biomacromolecules, 1, 543 (2000).
11) Chawla, K., Lee, S., Lee, B. P., Dalsin, J. L., Messersmith, P. B., Spencer, N. D.: J. Biomed. Mater. Res. A, 90, 742 (2009).
12) Zhang, C., Miyatake, H., Wang, Y., Inaba, T., Wang, Y., Zhang, P., Ito, Y.: Angew. Chem. Int. Ed. Engl., 55, 11447 (2016).
13) Kang, J., Tada, S., Sakuragi, M., Abe, H., Ito, R., Ishikawa, J., Kurata, S., Kitajima, T., Son, T. I., Aigaki, T., Ito, Y.: Biomaterials, 34, 9747 (2013).
14) Ito, Y.: Biological Interactions on Materials Surfaces: Understanding and Controlling Protein, Cell and Tissue Responses, Springer, 173 (2009).
15) Chiu, L. L., Radisic, M.: Biomaterials, 31, 226 (2010).
16) Saik, J. E., Gould, D. J., Watkins, E. M., M.E.Dickinson, M.E., West, J. L.: Acta Biomaterialia, 7,133 (2011).