【トピックス】
胚中心におけるB細胞選択機構と記憶B細胞の生成
疋田正喜、藤堂景史
秋田大院・理工、京都大院・医
1.はじめに
免疫学の出発点の一つと言っても良いであろう成果として、にエドワード・ジェンナーによる種痘の開発が挙げられる。当時から現代に至るまで、ワクチンの基本原理は、抗原そのもの、もしくは弱毒化・無毒化した抗原と類似性のある構造を持つワクチンを接種して、生体内に記憶B細胞、記憶T細胞を生成するということに変わりはない。したがって、より効果的なワクチンの開発には、生体内でどのように記憶細胞が生成されているのかという基礎的な知識の蓄積が必須である。さらには、近年、様々なモノクローナル抗体が生物製剤として開発されており、これまでの低分子製剤では得られなかった顕著な治療効果が認められる場合があることが知られていおり、これらの抗体の性能改善を目的として、様々な人工抗体の開発が試みられている。しかし、最初の出発点となる抗体の可変部を構成するアミノ酸の構造には、依然として実験動物の免疫により得られる抗体産生細胞の遺伝情報が用いられることが多く、これらの細胞がどのような機構に基づいて生成されているのかという問題を明らかにすることは応用的側面からも非常に重要であると考えられる。本トピックでは、記憶B細胞生成の場であることが知られている胚中心と呼ばれる微小環境におけるB細胞のシグナル伝達と選択機構について概説する。
2.液性免疫と胚中心
免疫機構は、細胞傷害性T細胞やナチュラルキラー細胞といった異常な細胞を攻撃する細胞を中心とする細胞性免疫と、抗体産生細胞へと分化するB細胞や、その機能を制御するヘルパーT細胞や樹状細胞などの細胞によって実現されている液性免疫に大きく分けられる。両者のうち、液性免疫を特徴づけるもっとも基本的な現象として、免疫記憶と抗体の親和性成熟が挙げられる。これらの免疫反応は、液性免疫を介してウイルス等の感染から生体を守る防御機構において非常に重要な役割を果たしていると考えられている。B細胞の観点から見た場合、記憶応答においては、高親和性の抗体産生にはクラススイッチおよび体細胞突然変異によって高親和性を獲得した記憶B細胞が必須であることが広く知られている。また、組織局在性の観点から考えた場合、高親和性B細胞は主に胚中心と呼ばれる領域で生成されることが明らかとなっている。したがって、これらのB細胞の生成や活性化機構を明らかにするためには、胚中心におけるB細胞の活性化機構を明らかにする必要があると考えられる。
3.胚中心の形成
ナイーブなB細胞は、生体内に侵入した異物を抗原として認識・活性化することにより、ケモカイン受容体であるCCR7の発現を上昇し、T細胞領域との境界において増殖を始めることが知られている1,2)。その後、活性化したB細胞は濾胞の中心へと戻り濾胞樹状細胞 (follicular dendritic cells; FDC) のネットワークの中で増殖を繰り返し、胚中心と呼ばれる領域を形成する3,4)。マウスの場合、抗原の免疫数日後には初期の胚中心の形成が観察され、10日から2週間程度の間にピークを迎えることが知られている。その後、免疫応答の経過と共に徐々に胚中心が小さくなっていく (図1)。
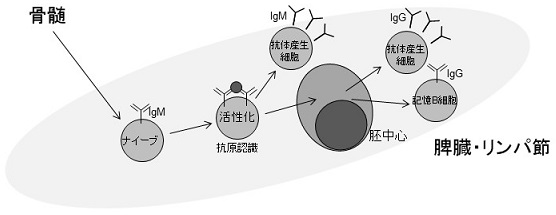
図1 B細胞の分化経路と胚中心
活発に活動している胚中心においては、FDCネットワークが密に形成されている明領域 (light zone; LZ) と暗領域 (dark zone; DZ) に識別される。LZに位置している胚中心B細胞はcentrocyteと呼ばれ、DZの細胞はcentroblastと呼ばれている。centroblastは、抗原受容体遺伝子に体細胞突然変異を起こしつつ、活発に増殖していることが知られており、細胞表面の抗原受容体の発現も低下している。一方で、centrocyteにおいては、増殖はほぼ停止しており抗原受容体の発現を再開している。centrocyteがLZに存在しているFDC上の補体レセプターに結合している抗原複合体を認識して分化・生存に必要なシグナルを受け取ると考えられている。この過程は、異なる抗原受容体を持つcentrocyte間で競争的に行われることから、体細胞突然変異の結果、抗原に対して高い親和性を獲得したcentrocyteがFDCからのシグナルを有利に獲得することができ、親和性成熟へとつながっていると考えられている5)。これらの成果に加え、近年のライブイメージング技術の発展により、LZ とDZの間の細胞の動きが1方向性の単純なものではなく、相互に行き来するダイナミックな過程であることが明らかにされている6-9)。
このような環境下で活性化した胚中心B細胞の一部は、骨髄中で長期にわたって生存し抗体を出し続ける形質細胞であるlong-lived plasma cellや高親和性抗体を産生する形質細胞へと分化し胚中心外へと移動する。さらに、残りの細胞の一部は、再度の抗原感作に備えて長期にわたって生き続ける記憶B細胞へと分化することが知られている (図2)。
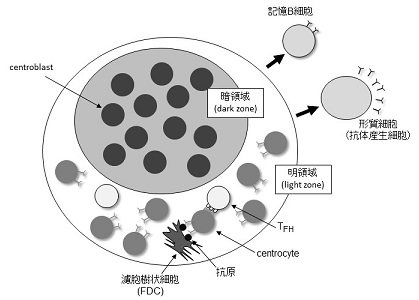
図2 胚中心の基本構造
4.胚中心B細胞の分化を制御するシグナル
では、どのような機構でこれらの細胞への分化が制御されているのであろうか? 胚中心B細胞は、胚中心において濾胞ヘルパーT細胞 (follicular helper T cells; TFH細胞) からの刺激を受け活性化や生存維持が行われている9,10) (図3)。
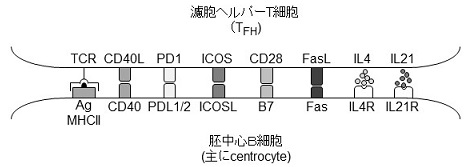
図3 胚中心B細胞にシグナルを伝える分子群
可溶性因子としては、インターロイキン4 (Interleukin 4; IL4) とIL21に対する要求性が広く知られている11-13)。IL4を欠失している場合には形質細胞数が激減し、IgM抗体からIgG1やIgE抗体へのクラススイッチも正常に起こらない11)。IL21または、IL21レセプターを欠失している場合には、形質細胞の数も減少するとともに、胚中心は形成されるものの正常に維持されず、比較的短期間で小さくなってしまうことが知られている11-13)。 細胞表面に存在している分子にも、胚中心B細胞の分化制御に必須の役割を果たしているものが複数存在している。胚中心B細胞が主要組織適合性抗原 (major histocompatibility complex; MHC) 上に抗原を提示し、T細胞がT細胞受容体 (T cell receptor; TCR) でこれを認識する最も基本的な相互作用以外にも胚中心B細胞の活性化・分化に必須である分子が複数見出されている。中でもT細胞が発現しているCD40リガンドからB細胞上のCD40へのシグナルは、胚中心の形成や維持に必須であることが初期の研究から明らかとなっている14-16)。また、最近の研究によれば、TFH細胞が発現しているPD1 (PDL1、PDL2の受容体) からB細胞上のPDL1、PDL2へのシグナルも胚中心B細胞の分化に重要な役割を果たしていることが明らかになっており17)、さらにこれらの分子の発現がアダプタータンパク質DOK3によって調節される細胞内カルシウムシグナルの抑制によって制御されているとことが示されている18)。
5.胚中心B細胞における抗原受容体シグナルの役割
上述の可溶性因子やB細胞表面上の分子からのシグナルは、胚中心B細胞全般の活性化や分化に必須の役割を果たしていることは言うまでもない。一方で、抗原に対する親和性を規定しているB細胞抗原受容体からのシグナルがどのような働きをしているのかについても多くの検討がなされている。
先にも述べたように、胚中心においては抗原受容体遺伝子座における体細胞突然変異が起こり、生殖細胞のgermline型とは異なるアミノ酸配列の抗原受容体を獲得したことによって、B細胞の抗原に対する親和性が変化することが知られている。しかし、体細胞突然変異自体には、高親和性を獲得する変異だけでなく親和性を低下させる変異も含まれる。むしろ、数多くの変異の中で高親和性に寄与できる変異は比較的少数であることが予想される。したがって、胚中心には何らかの高親和性B細胞の選択機構が存在していることは明らかである。抗原受容体からのシグナルは、B細胞が生存するために必須であることも示されており19)、このような抗原に対する親和性の高低による選択においても重要な役割を果たしていると考えられているが、その全貌は明らかとなっていない。
低親和性の胚中心B細胞と高親和性の胚中心B細胞との比較から、低親和性B細胞はアポトーシスに陥りやすく、逆に高親和性B細胞の生存性が高いことが報告されており、このことが高親和性B細胞の選択に有利に働いているのではないかと考えられている20)。一方、どのような分子機構で高親和性の胚中心B細胞の生存性が高くなっているのかという点については、複数の考え方が提唱されている20)。一つは、B細胞intrinsicにアポトーシスを抑制する機構があるのではないのか? という考え方である。二つ目は、先にも述べた、FDC上の抗原をB細胞が競争的に認識するという考え方である5)。さらに、効率良く抗原を取り込んだB細胞の方が多数の抗原断片を提示できるため、少数のTFHから効率良く分化・活性化シグナルを獲得することができるというものである。
これら、いずれも魅力的な考え方であり、それぞれが単独で働いているのではなく、複合的に選択機構が制御されていると考えるのが妥当であろう。しかし、抗原受容体シグナルを伝える分子群のノックアウトマウスの多くにおいては、B細胞の分化が正常に行われなかったり、胚中心の形成自体に異常をきたしてしまうことから、正常な胚中心で行われている選択過程の再現も困難であると考えられている。そのため、厳密な解析には分化段階選択的なコンディショナルノックアウト等の特別な工夫が必要となる21)。さらに、最近我々は、抗原受容体シグナルの伝達に必須であり、形質細胞に至る以前のB細胞の全分化段階で発現量が一定に保たれていると考えられてきたIgβの発現が、胚中心において一過性に低下することが正常な親和性の成熟に重要であることを明らかにしている22)。このことは、胚中心における抗原受容体からのシグナル伝達調節機構には、何らかの未知な制御機構が存在していることを強く示唆している。また、高親和性を獲得したB細胞が主に発現しているIgG型の抗原受容体は、IgM型の抗原受容体とは異なり、細胞質内ドメインを有しており、この領域が抗原受容体の細胞表面への発現や23)シグナル伝達に重要な役割を果たしている24,25)という報告が我々を含めて複数なされている。これらのことは、胚中心における抗原受容体のシグナル研究はこれまでのIgM型の濾胞B細胞を用いた検討のみでは不十分であることを強く示唆しており、今後はIgG型の抗原受容体におけるシグナル調節機構の解析が進められると予想される26)。
6.おわりに
抗体の親和性成熟や繰り返し感染に対する防御を担っている記憶細胞の分化・生成の場である胚中心におけるB細胞シグナル制御機構を明らかにすることは、液性免疫の調節機構を理解することを介して、種々の感染症に対する高性能のワクチンを効率良く開発する方法の開発や、制御の異常によって発症すると考えられるある種の自己免疫疾患の治療法開発に役立つと考えられる。
一方で、胚中心B細胞が極めて少数しか存在しないことや、その特徴でもある分化のダイナミズムに起因する研究の難しさがあるため、多くのことが不明のまま残されてきた。今後は、近年開発された少数の細胞を対象にした分析技術を利用することにより、これらの点が詳細に解析され、多くの免疫疾患に対する治療法や新規の抗体製剤が開発されていくことが期待される。
文献
1) Chan, T. D., Gatto, D., Wood, K., Camidge, T., Basten, A., Brink, R.: J. Immunol., 183, 3139 (2009).
2) Coffey, F., Alabyev, B., Manser, T.: Immunity, 30, 599 (2009).
3) Liu, Y. J., Johnson, G. D., Gordon, J., MacLennan, I. C.: Immunol. Today, 13, 17 (1992).
4) Wang, Y., Carter, R. H.: Immunity, 22, 749 (2005).
5) Allen, C. D., Okada, T., Cyster, J. G.: Immunity, 27, 190 (2007).
6) Allen, C. D., Okada, T., Tang, H. L., Cyster, J. G.: Science, 315, 528 (2007).
7) Hauser, A. E., Junt, T., Mempel, T. R., Sneddon, M. W., Kleinstein, S. H., Henrickson, S. E., von Andrian, U. H., Shlomchik, M. J., Haberman, A. M.: Immunity, 26, 655 (2007).
8) Schwickert, T. A., Lindquist, R. L., Shakhar, G., Livshits, G., Skokos, D., Kosco-Vilbois, M. H., Dustin, M. L., Nussenzweig, M. C.: Nature, 446, 83 (2007).
9) Victora, G. D., Schwickert, T. A., Fooksman, D. R., Kamphorst, A. O., Meyer-Hermann, M., Dustin, M. L., Nussenzweig, M. C.: Cell, 143, 592 (2010).
10) Zotos, D., Tarlinton, D. M.: Trends. Immunol., 33, 281 (2012).
11) Ozaki, K., Spolski, R., Feng, C. G., Qi, C. F., Cheng, J., Sher, A., Morse, H. C. 3rd., Liu, C.: Science, 298, 1630 (2002).
12) Ozaki, K., Spolski, R., Ettinger, R., Kim, H. P., Wang, G., Qi, C. F., Hwu, P., Shaffer, D. J., Akilesh, S., Roopenian, D. C., Morse, H. C. 3rd., Lipsky, P. E., Leonard, W. J.: J. Immunol., 173, 5361 (2004).
13) Avery, D. T., Deenick, E. K., Ma, C. S., Suryani, S., Simpson, N., Chew, G. Y., Chan, T. D., Palendira, U., Bustamante, J., Boisson-Dupuis, S., Choo, S., Bleasel, K. E., Peake, J., King, C., French, M. A., Engelhard, D., Al-Hajjar, S., Al-Muhsen, S., Magdorf, K., Roesler, J., Arkwright, P. D., Hissaria, P., Riminton, D. S., Wong, M., Brink, R., Fulcher, D. A., Casanova, J. L., Cook, M. C., Tangye, S. G.: J. Exp. Med., 207, 155 (2010).
14) de Vinuesa, C. G., Cook, M. C., Ball, J., Drew, M., Sunners, Y., Cascalho, M., Wabl, M., Klaus, G. G., MacLennan, I. C.: J. Exp. Med., 191, 485 (2000).
15) Xu, J., Foy, T. M., Laman, J. D., Elliott, E. A., Dunn, J. J., Waldschmidt, T. J., Elsemore, J., Noelle, R. J., Flavell, R. A.: Immunity, 1, 423 (1994).
16) Han, S., Hathcock, K., Zheng, B., Kepler, T. B., Hodes, R., Kelsoe, G.: J. Immunol., 155, 556 (1995).
17) Good-Jacobson, K. L., Szumilas, C. G., Chen, L., Sharpe, A. H., Tomayko, M. M., Shlomchik, M. J.: Nat. Immunol., 11, 535 (2010).
18) Ou, X., Xu, S., Li, Y. F., Lam, K. P.: Proc. Natl. Acad. Sci. USA., 111, 11431 (2014).
19) Lam, K. P., Kuhn, R., Rajewsky, K.: Cell, 90, 1073 (1997).
20) Anderson, S. M., Khalil, A., Uduman, M., Hershberg, U., Louzoun, Y., Haberman, A. M., Kleinstein, S. H., Shlomchik, M. J.: J. Immunol., 183, 7314 (2009).
21) Victora, G. D., Nussenzweig, M. C.: Annu. Rev. Immunol., 30, 429 (2012).
22) Todo, K., Koga, O., Nishikawa, M., Hikida, M.: Sci. Rep., 5, 10303 (2015).
23) Todo, K., Koga, O., Nishikawa, M., Hikida, M.: Biochem. Biophys. Res. Commun., 445, 572 (2014).
24) Engels, N., Konig, L. M., Heemann, C., Lutz, J., Tsubata, T., Griep, S., Schrader, V., Wienands, J.: Nat. Immunol., 10, 1018 (2009).
25) Engels, N., Konig, L. M., Schulze, W., Radtke, D., Vanshylla, K., Lutz, J., Winkler, T. H., Nitschke, L., Wienands, J.: Nat. Commun., 5, 5456 (2014).
26) Kurosaki, T., Kometani, K., Ise, W.: Nat. Rev. Immunol., 15, 149 (2015).