チューリップから発見された加水分解反応「非」触媒型カルボキシルエステラーゼの機能解析と物質生産への応用
野村泰治、加藤康夫
富山県大・工・生物工、富山県大・工・生工研セ
1.はじめに
植物は多種多様な二次代謝産物を産生しており、その総数は20万種類を超えるとも見積もられているが、植物にとっての存在意義が明らかにされているものは多くない。そのうち最も広く受け入れられているものとしては、病原菌や害虫といった外敵に対する防御物質としての役割が挙げられる。二次代謝産物を介したいわゆる化学防御は、抵抗性遺伝子産物を介した特定の病原菌に対する特異的な防御応答と比べると、生物活性が比較的穏和であることや、作用する対象の特異性が低いこともあり、その実効性について懐疑的な見方があるのも事実である。しかし、抗菌・殺虫等の生物活性を有している二次代謝産物は、防御システムの主役とまではいかないにしろ、植物にとっては防御上の有用性があるがゆえに生合成されていると考えるのが自然である。一方で、植物における存在意義はどうであれ、抗腫瘍、抗炎症、鎮痛等の顕著な薬理活性を示すものの医薬への利用をはじめとして、香料、染料、食品など、私たち人間にとっての有用性の観点から植物二次代謝産物は広く利用されている。植物、人間のいずれの立場に立脚するにしても、そういった有用な二次代謝産物の生合成経路を明らかにすることは、基礎研究としてだけでなく耐病性育種や効率的な物質生産法の開発といった応用を図る上でも重要な命題である。植物二次代謝産物の多様性は、多様な生合成酵素によって生み出されているものであるので、植物は未知酵素の宝庫でもあり、生合成研究を進めていく過程では思いがけず‘新奇’な酵素に遭遇することがある。最近筆者らは、チューリップの主要二次代謝産物である糖エステル化合物「チューリッポシド類」を、ラクトン化合物である「チューリッパリン類」へと変換する酵素「チューリッポシド変換酵素」の同定に成功した。本酵素は、分子内エステル転移反応を特異的に触媒するが、意外なことにカルボキシルエステラーゼファミリーに属するものであった。本稿では、この「加水分解反応を触媒しないカルボキシルエステラーゼ」の機能について、酵素学および植物生理学的観点から概説するとともに、本酵素の物質生産への応用についても併せて紹介する。
2.チューリッポシド変換酵素の発見の経緯
チューリッポシド (Pos) 類は、およそ半世紀ほど前にチューリップから発見された二次代謝産物である1,2)。現在までに、ユリ科植物のチューリップ属 (Tulipa)、キバナノアマナ属 (Gagea)、カタクリ属 (Erythronium)、近縁のユリズイセン科植物のアスルトロメリア属 (Alstroemeria)、ボマレア属 (Bomarea)、さらにはそれらとは遠縁のバラ科植物のシモツケ属 (Spiraea) においてその存在が報告されている3)。Pos類の構造は、D-グルコースとα-メチレン-γ-ヒドロキシ酪酸 (ヒドロキシ酸) ユニットからなるエステルであり、ヒドロキシ酸ユニットの構造やグルコースとの結合パターンが異なる、6-PosA、6-PosB、1-PosA、1-PosB、PosD、PosE、PosFの7種類のPos類がこれまでに報告されている (図1)。ちなみに、PosCについては過去の論文中2)で構造が示されないまま言及され、その後に続報が無かったため、構造不明ということで現在でも欠番となっている。一方、ヒドロキシ酸ユニットのラクトン化体はチューリッパリン (Pa) 類とよばれ、PaAとPaBの2種類が存在する (図1)。α-メチレン-γ-ブチロラクトン骨格をもっているPa類は、抗菌、殺虫といった生物活性を示すだけでなく、耐熱性透明樹脂、液晶素材などの機能性高分子の原料やリチウムイオン電池電極液など、工業原料としての利用価値も報告されている有用物質である4)。筆者らが主眼を置いているチューリップの化学防御の観点からみると、Pa類はチューリップの病原菌を含む種々の糸状菌や細菌に対して抗菌活性を示し、そのうちPaAは主に抗糸状菌活性を、PaBは主に抗細菌活性を有する5)。このようにPaAとPaBの間で生物活性に明瞭な差がみられることは、これらの化合物がチューリップにおいて合目的的に生合成されていることを示すものである。
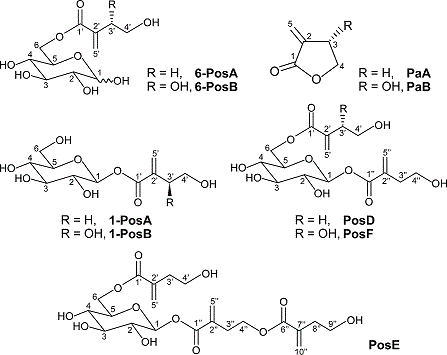
図1 Pos類およびPa類の化学構造
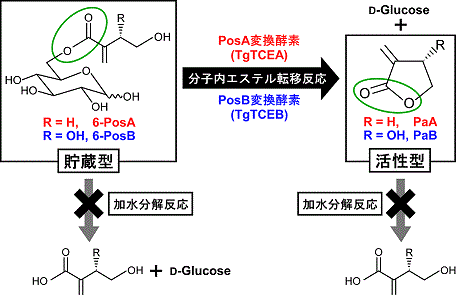
チューリップにおける主要Pos類は6-PosAと6-PosBである。6-Pos類はPa類の前駆体であり、6-PosAからPaAが、6-PosBからPaBが生成することは化合物の発見当初に明らかにされたが、それはこれらの反応が試験管内では中性以上のpHで自発的に進行することによるものである。したがって、植物体内でのPa類の生成も酵素非依存的なものであると考えられていたわけであるが、そうであるならば植物体内においてPa類は有意なレベルでみられるはずである。しかしながら実際には、組織新鮮重の2%以上に達する場合もあるほどの高含量で6-Pos類が蓄積しているのに対して、Pa類は痕跡レベルでしかみられないといった矛盾が存在した。そこで筆者らは、6-Pos類からPa類への変換が酵素依存的なものであるとの仮定のもと、チューリップ組織粗酵素中における同酵素活性の検出を試み、酵素添加反応液中でのPa生成量が、酵素無添加反応液中での非酵素的なPa生成量よりも明らかに多く、なおかつその生成が酵素量に依存したものであることを見いだした (図2)。この酵素反応は、貯蔵体であるPos類を活性体であるPa類に変換する、チューリップの化学防御の要の役割を担っていると考えられたことに加え、酵素学的観点からも、このエステルからラクトンへの分子内エステル転移反応を触媒する酵素の実体に興味がもたれたことから、筆者らはこの酵素を「Pos変換酵素」と命名し6)、その実体解明に着手した。

3.天然型チューリッポシド変換酵素の精製と機能解析
6-PosAおよび6-PosBを各々基質として、チューリップ各組織の粗酵素中におけるPos変換酵素活性を測定した結果、6-PosAに対する活性 (PosA変換酵素活性) と6-PosBに対する活性 (PosB変換酵素活性) の比 (A / B) が組織間で一定ではなく、6-PosAを優勢に蓄積する組織 (例えば花弁や球根) ではA / B比が高く、6-PosBを優勢に蓄積する組織 (例えば葯や根) ではA / B比が低いというように、各組織における主要Pos類と酵素活性のA / B比が概ね対応していることが見いだされた。この実験結果に基づいて、Pos変換酵素には「PosA変換酵素」と「PosB変換酵素」の2種類が存在するとの作業仮説を立て、植物体からの酵素精製を試みた。
PosA変換酵素については、花弁の粗酵素から計5段階の精製操作を経て均一に精製した3)。PosB変換酵素については、当初は雄しべからの精製を計画していたが、雄しべでみられるPosB変換酵素活性の大半が葯に付着した花粉に由来することが分かったため、およそ15,000個の雄しべ (チューリップ2,500個体分) から花粉を回収して酵素精製に供し、計6〜7段階の精製操作を経て、クロマトグラフィーの過程で分離・検出された3種のアイソフォームをすべて均一に精製した7)。PosAおよびPosB両変換酵素はいずれも2量体酵素であったが、サブユニットおよびネイティブ分子質量は両者で明らかに異なっていた。PosA変換酵素は6-PosAをよい基質とし、6-PosBに対する活性は6-PosAに対する活性の1/20程度であった。一方、PosB変換酵素は6-PosBをよい基質とし、6-PosAに対する活性は6-PosBに対する活性の1/130〜1/150程度であった。Pos変換酵素には基質の構造に対応して「PosA変換酵素」と「PosB変換酵素」の2種類が存在するという当初の仮説は、このように天然型酵素の精製によって実証された (図2)。
最適pHや最適温度、安定pHや安定温度といった諸性質は両酵素間で概ね一致していた。いずれの酵素もAg+、Hg2+、Cu2+といった重金属やPMSFによる強い阻害がみられたことから、本酵素の触媒過程へのセリン残基の寄与が想定された。また、本酵素は精製過程および精製後の保存中 (4℃ 、中性緩衝液中) における活性の低下がほとんどみられず、非常に高い安定性を有していたことから、糖鎖が安定化に寄与している可能性が予想されたが、本酵素への糖鎖の付加は確認されなかった。各種の合成基質アナログを用いて基質特異性を検討した結果、基質の認識には基質構造中のエステル結合、オレフィン、アシル側鎖末端の水酸基、アシル側鎖の炭素鎖長が特に重要であり、PosB変換酵素は、ヒドロキシ酸ユニットのアリル位不斉炭素の立体配置について、3’- (R) 体よりも3’- (S) 体 (天然型) をよりよい基質とすることが分かった (未発表データ)。
5員環のラクトンであるPa類の生成過程については、酵素反応によって直接6-Pos類から生成している可能性と、酵素反応によって生成したヒドロキシ酸が、反応中もしくは酸の添加による反応停止時に自発的に環化することで生成している可能性の2つが想定された。Pos変換酵素が触媒する反応は、前者の場合にはアシル基転移反応、後者の場合には加水分解反応となる。そこで、酵素反応および反応停止条件を種々検討したが、ヒドロキシ酸の生成は一切みられなかった。さらに、ヒドロキシ酸標品を用いて通常の酵素反応および反応停止条件下での挙動を調べたが、自発的環化反応によるPa類の生成はみとめられなかった。併せて、Pa類を基質とした酵素反応も検討したが、Pa類の加水分解によるヒドロキシ酸の生成はみられなかった。以上の結果から、Pos変換酵素は、6-Pos類を基質として分子内エステル転移反応によって直接Pa類を生成するラクトン化酵素であると結論付けた (図2)。
4.チューリッポシド変換酵素の実体
精製酵素の部分アミノ酸配列解析の後、定法に従ってPosA変換酵素遺伝子 (TgTCEA; Tulipa gesneriana tuliposide A-converting enzyme) およびPosB変換酵素遺伝子 (TgTCEB) をクローニングした3,7) (図3)。全長アミノ酸配列と精製酵素のN末端アミノ酸配列との比較から、いずれの酵素もN末端領域に輸送ペプチドをもつことが推定された。成熟ポリペプチド領域を大腸菌で発現させることで得られた両組換え酵素は、天然型酵素と同様に2量体であり、それぞれ天然型酵素と同程度のPos変換酵素活性を有し、なおかつ6-Pos類からPa類への変換反応以外の反応を触媒しないことも確認された。ちなみに本組換え酵素は、Hisタグを含む発現ベクター由来の21残基をN末端にもつ形で発現させたが、金属アフィニティカラムによる精製後にプロテアーゼ処理によってHisタグを含む17残基を除くことで、酵素活性は約2倍に向上した。
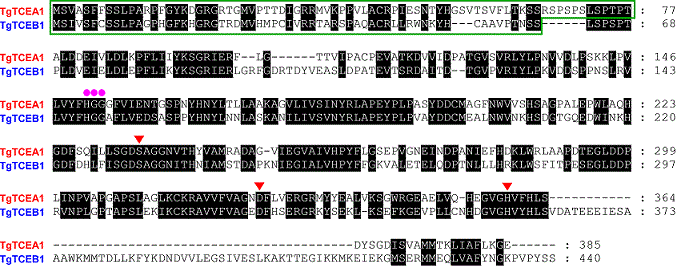

両酵素の一次配列間の相同性は52%であり、意外なことにいずれもカルボキシルエステラーゼファミリーに属することが判明した。典型的なカルボキシルエステラーゼが触媒する反応はカルボン酸エステルの加水分解反応であるが、Pos変換酵素が触媒するのは分子内エステル転移反応である。Pos変換酵素はカルボキシルエステラーゼの保存配列であるHGGモチーフ、およびセリン、アスパラギン酸、ヒスチジンからなる触媒3残基 (catalytic triad) を有していた (図3)。これらに変異を導入したところ、酵素活性は痕跡レベルにまで低下したことから、加水分解型のカルボキシルエステラーゼと同様に、Pos変換酵素においてもこれらのアミノ酸残基が触媒過程に必須であることが示された。またこの結果は、チューリップ組織から精製した天然型酵素の活性がセリン試薬であるPMSFによって強く阻害されたこととも矛盾しないものであった。以上のことから、Pos変換酵素は分子内エステル転移反応によるラクトン形成を触媒する、これまでに知られていなかったユニークなカルボキシルエステラーゼであることが分かった。ちなみに本酵素は、国際生化学・分子生物学連合命名法委員会 (NC-IUBMB) の基準ではリアーゼ (EC 4; carbon-oxygen lyase) に分類された (TgTCEA: EC 4.2.99.22、TgTCEB: EC 4.2.99.23)。Pos変換酵素は、「加水分解酵素 (カルボキシルエステラーゼ) と相同性を有しアシル基転移反応を触媒するリアーゼ」という一風変わった酵素であるといえる。
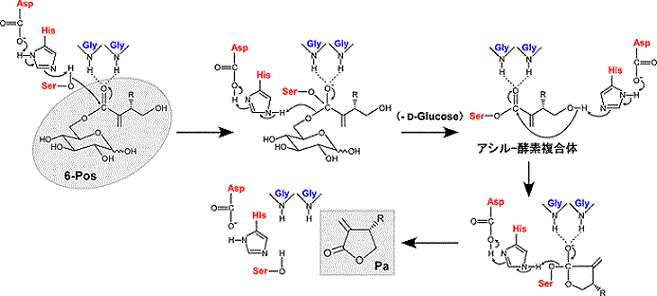
その反応機構は基本的には加水分解型カルボキシルエステラーゼの反応機構に則ったものと推定される。すなわち、触媒3残基の電荷リレーによって活性化されたセリンの水酸基が、基質である6-Pos類のカルボニル炭素に求核攻撃し、HGGモチーフ中のグリシン残基によって安定化された四面体中間体を経由した後、グルコースが脱離することでアシル−酵素複合体が形成される。加水分解酵素の場合には、この後に活性化された水分子によるアシル−酵素複合体への求核反応が起こるが、Pos変換酵素の場合には、基質4’位の水酸基が活性化されて分子内求核反応が起こることによってPa類のラクトン環を形成していると推測される (図4)。現在、Pos変換酵素のX線結晶構造解析を進めており、基質あるいは基質代替リガンドとの共結晶構造に基づいて、この反応機構を証明したいと考えている。
![]()
5.チューリッポシド/チューリッパリン酵素変換系によるチューリップの化学防御
PosA変換酵素は花弁から、PosB変換酵素は花粉から単離されたが、これら酵素遺伝子の発現様式を組織別に調べたところ、粗酵素中で高い酵素活性が検出されるにもかかわらず当該遺伝子の発現がみられない組織が見いだされた3,7)。このことから、PosA変換酵素とPosB変換酵素にはそれぞれ複数のアイソザイムが存在しており、アイソザイムによって主たる発現組織が異なることが想定された。そこで、PosA変換酵素については球根から再度酵素精製と遺伝子クローニングを行ったところ、予想通り花弁由来酵素とは異なるアイソザイムが得られ、その酵素遺伝子は花弁由来遺伝子が発現していなかった球根において構成的に発現していることが確認された8)。PosB変換酵素については根を対象として同様に実験を進めた結果、花粉由来遺伝子が発現していなかった根において高発現しているアイソザイムが同定された (未発表データ)。
このような分子多様性が存在しているのはどのような理由によるものであろうか。新たに同定されたアイソザイムも含め、Pos変換酵素翻訳産物のN末端に存在している輸送ペプチド (図3) とGFPの融合タンパク質をタマネギ表皮細胞で一過的に発現させ、GFPの蛍光の細胞内局在を蛍光顕微鏡下で観察したところ、いずれの場合もプラスチドへの局在がみとめられた。このことから、Pos変換酵素は翻訳後にプラスチドに輸送されていることが強く示唆された3,7,8)。花粉由来のPosB変換酵素については、樹脂包埋したチューリップの葯切片を用いて抗TgTCEBポリクローナル抗体による免疫染色を行ったところ、やはり花粉内のプラスチドへの局在がみとめられた。この結果は、主たる発現組織を異にするアイソザイムが存在する理由について重要なヒントを与えてくれる。すなわち、クロロプラストやアミロプラストなど、組織によって分化形態が異なるプラスチドの生理環境に応じて最適なアイソザイムが配備されるように発現調節がなされている可能性が考えられる。例えば、プラスチドがデンプンの合成・貯蔵器官であるアミロプラストに分化している球根のアイソザイムは、高デンプン環境下での安定性に優れているといった特長を有しているのかもしれない。こういった特定の環境下におけるアイソザイム間の性能差異に加え、各アイソザイム遺伝子の転写調節機構についても興味がもたれるところである。
Pos変換酵素の基質である6-Pos類は、品種、組織、生育時期による蓄積量の変動はみられるものの、健常植物体の全組織において構成的に存在している。このことは、6-Pos類が、プラスチドに局在しているPos変換酵素とは細胞内で隔離されていることを意味している。6-Pos類の細胞内局在部位についてはまだ実験的な証明には至っていないが、水溶性の高いグルコースエステルであることや、弱酸性条件下で安定であることを考慮すると、配糖体として存在する多くの二次代謝産物と同様に液胞内に貯蔵されていると考えられる。この酵素−基質の隔離は、病原菌の侵入等によって細胞が破砕された際に酵素反応によって速やかに抗菌活性物質であるPa類を生成し、被害を最小限にくい止める、構成的防御システムとして機能していると考えられる。一方、液胞が存在しない成熟花粉では、それを補完する巧妙な仕組みの存在をうかがわせる結果が得られた。すなわち、水中に懸濁することで集めた花粉のメタノール抽出物中には予想通りPos類はほとんど検出されなかったが、意外なことに、花粉の水洗浄液から高レベルのPos類が検出されたことから、液胞が存在しない花粉ではPos類がその表層にまぶされるようにして貯蔵されていることが強く示唆された7)。花粉におけるプラスチドと花粉表層間での酵素−基質の隔離もやはり、花粉の構成的防御システムとして備えられているものであると考えられる。
6.チューリッポシド変換酵素の物質生産への応用
先述したように、Pa類は多方面での利用が期待されている有用物質である。特にPaBは、PaAにみられるアレルゲン性が無いことから9,10)、天然抗菌剤としての産業利用が以前から注目されている。PaBの化学合成法としてはこれまでいくつかの報告があるが11-14)、効率やコストの点でいずれも実用性に乏しいのが現状である。そこで筆者らは、Pos変換酵素を用いた酵素法によるPaB調製プロセスを確立することとした。富山県ではチューリップの球根生産が盛んで、年間約2,000万球が出荷されている。球根栽培の過程では、球根の肥大化を促すために開花後の花部を刈り取る「摘花」作業が行われるが、この摘花花部の大半が廃棄処分されている。また、罹病球根や肥大不足球根といった規格外球根も副生する。花部は6-Pos類の含有量が高く、球根は高いPos変換酵素活性を有することから、これらを基質源および酵素源とするPaB調製プロセスを確立することができれば、未利用資源の高度利用を図ることにもつながる。そこで筆者らは、原料調達から最終精製までの全過程において、簡便性、廉価性、効率性を維持しつつ、環境負荷を最小化することを念頭に置き、石油由来溶媒を使用しない環境調和型プロセスとすることをコンセプトとした (図5)。
酵素反応液からのPaBの精製を効率的に行うためには、花部中の6-PosBの含有量/含有率が高いチューリップ品種を基質原料とすることが鍵となる。そこで、富山県で栽培されている115品種のチューリップについて、花部構成組織 (花弁、雄しべ、雌しべ) における6-Pos / Pa含有量を調べた。その結果、6-PosBをほぼ独占的に蓄積している3品種が見いだされた。酵素反応に用いるPos変換酵素については、球根から抽出した粗酵素を一切の精製操作を経ずに強陰イオン交換樹脂 (DIAION-HPA25L) 上に固定化した。この固定化酵素は、中性緩衝液中で少なくとも10週間にわたって安定に保存でき、少なくとも5回の使用後も活性を保持していた。6-PosB独占含有品種の花部組織を30〜40%エタノールにて抽出後、活性炭にて粗精製した濃縮基質液に固定化酵素を添加し、中性付近のpH下、室温で数時間穏やかに攪拌することで、反応液中の6-Pos類は完全にPa類へと変換された。濾別により固定化酵素を除いた反応液に活性炭を添加してPaBを吸着させ、蒸留水による洗浄と含水エタノールおよびエタノールによる溶出を経ることで、ほぼ純粋なPaBが得られた15) (図5)。本プロセスは、1) 未利用バイオマスを基質および酵素原料としていること、2) 再使用可能な固定化酵素による温和な条件下でのわずか一段階の酵素反応であること、3) 抽出・精製の過程で活性炭とエタノールのみを用いており、石油由来溶媒を一切使用しないこと、4) 煩雑なクロマトグラフィー工程を経ることのないバッチ法で行えること、の4点を特徴としており、簡便かつ環境適合性の高いものである。
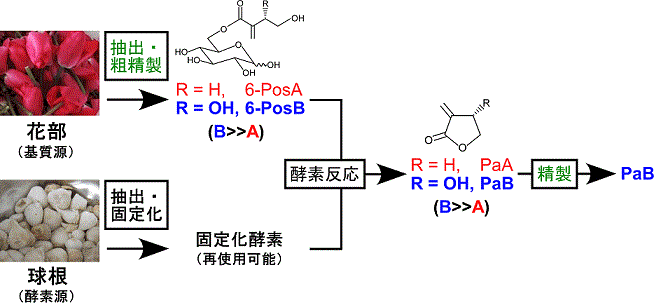

球根で主に発現しているのはPosA変換酵素であり、PosB変換酵素は発現していない。本プロセスにおける酵素反応は、PosA変換酵素が6-PosBに対して示す活性 (6-PosAに対する活性の1/20程度) を利用したものである。したがって、天然資源の利用の観点からは外れるが、組換えPosB変換酵素を使用すればさらに酵素反応効率を向上させることが可能である。本プロセスでは酵素の失活を避けるために含水エタノールによる花部抽出液を濃縮し、エタノールを留去した後に酵素反応に供する必要があり、プロセスのボトルネックとなっている。そこで将来的には、上述したPos変換酵素の結晶構造解析の結果に基づいて、アルコール耐性を向上させた変異型PosB変換酵素を創製したいと考えている。それに加えて、Pos変換酵素の基質特異性を合理的に改変することで、Pa類以外の有用ラクトン化合物の生産に応用していくことも展望している。
7.おわりに
Pos変換酵素の発見は、植物二次代謝生合成を研究する上で2つの重要な教訓を与えてくれる。1つ目は、試験管内で非酵素的に進行する反応であっても、それが必ずしも植物においても酵素が介在しない反応であることを意味しないということである。本酵素以外の例を挙げると、テルペノイド‐インドールアルカロイド生合成の初発反応であるトリプタミンとセコロガニンの縮合や、テルペノイド‐イソキノリンアルカロイド生合成の初発反応であるドーパミンとセコロガニンの縮合などはいずれも非酵素的にも進行するが、当該植物中にはこれらの反応を触媒する酵素が存在する16-18)。文献等において‘spontaneous’と書かれている反応が本当にそうなのか、先入観を廃して検討し直してみることも必要かもしれない。2つ目は天然型酵素の精製の重要性である。Pos変換酵素の実体がカルボキシルエステラーゼファミリー酵素であることが判明した後であれば、カルボキシルエステラーゼの一般的な反応機構に照らして、Pos変換酵素の反応機構を推定、考察することはできるが、Pos変換酵素が触媒する反応だけを見て、当初から「カルボキシルエステラーゼ」を予見することは困難である。筆者らは当初は「アシル基転移酵素」の可能性も想定していた。もし、酵素精製を経ずに既知のアシル基転移酵素との相同性に基づいてクローニングを進めていたら、本酵素の発見に至ることはなかった。二次代謝生合成関連の研究では、異種発現酵素で目的の酵素活性が検出されて論文になればよい、という組換え酵素偏重の風潮が以前にも増して強まっているように感じる。そのスピード感は魅力的だが、可能な限り、まずは「天然のモノ」をみて、そこに真実を求めることが自然科学本来の姿ではないだろうか。
謝辞
共同研究者である荻田信二郎先生 (現 県立広島大学教授) に心より感謝いたします。本稿で紹介した研究は、JSPS科研費「若手研究 (B) 」 (23780120、26850072) の助成を受けて行われました。
文献
1) Tschesche, R., Kämmerer, F.-J., Wulff, G., Schönbeck, F.: Tetrahedron Lett., 9, 701 (1968).
2) Tschesche, R., Kämmerer, F.-J., Wulff, G.: Chem. Ber., 102, 2057 (1969).
3) Nomura, T., Ogita, S., Kato, Y.: Plant Physiol., 159, 565 (2012).
4) Kato, Y., Yoshida, H., Shoji, Y., Sato, Y., Nakajima, N., Ogita, S.: Tetrahedron Lett., 50, 4751 (2009).
5) Shigetomi, K., Omoto, S., Kato, Y., Ubukata, M.: Biosci. Biotechnol. Biochem., 75, 718 (2011).
6) Kato, Y., Shoji, M., Ubukata, M., Shigetomi, K., Sato, Y., Nakajima, N., Ogita, S.: Biosci. Biotechnol. Biochem., 73, 1895 (2009).
7) Nomura, T., Murase, T., Ogita, S., Kato, Y.: Plant J., 83, 252 (2015).
8) Nomura, T., Tsuchigami, A., Ogita, S., Kato, Y.: Biosci. Biotechnol. Biochem., 77, 1042 (2013).
9) Slob, A.: Phytochemistry, 12, 811 (1973).
10) Slob, A., Varekamp, H. Q.: Proc. K. Ned. Akad. Wet. Ser. C Biol. Med. Sci., 80, 201 (1977).
11) Tanaka, A., Yamashita, K.: Agric. Biol. Chem., 44, 199 (1980).
12) Papageorgiou, C., Benezra, C.: J. Org. Chem., 50, 1144 (1985).
13) Ohgiya, T., Nishiyama, S.: Heterocycles, 63, 2349 (2004).
14) Shigetomi, K., Kishimoto, T., Shoji, K., Ubukata, M.: Heterocycles, 69, 63 (2006).
15) Nomura, T., Hayashi, E., Kawakami, S., Ogita, S., Kato, Y.: Biosci. Biotechnol. Biochem., 79, 25 (2015).
16) Kutchan, T. M., Hampp, N., Lottspeich, F., Beyreuther, K., Zenk, M. H.: FEBS Lett., 237, 40 (1988).
17) De-Eknamkul, W., Ounaroon, A., Tanahashi, T., Kutchan, T. M., Zenk, M. H.: Phytochemistry, 45, 477 (1997).
18) De-Eknamkul, W., Suttipanta, N., Kutchan, T. M.: Phytochemistry, 55, 177 (2000).