亂僩僺僢僋僗亃
娨尦宆儕儞壔崌暔傪棙梡偟偨僶僀僆僥僋僲儘僕乕
淎揷棽堦丄崟揷復晇
峀戝堾丒愭抂尋
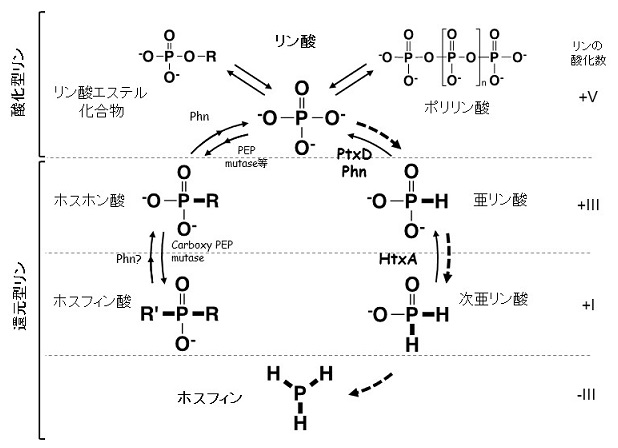
侾丏偼偠傔偵
儕儞偼妀巁丄ATP丄儕儞帀幙側偳偺惉暘偲偟偰惗柦偺昁恵尦慺偱偁傝丄堦斒偵偼巁壔悢+嘪偺惓儕儞巁 (PO43-)偑棙梡偝傟傞偲峫偊傜傟偰偄傞丅偦偺偨傔丄娐嫬拞偵懚嵼偡傞儕儞偼儕儞巁偲偦偺僄僗僥儖壔崌暔偱偁傞偲偺擣幆偑傎偲傫偳偱偁傝丄儕儞偺惗暔弞娐傕儕儞巁傪拞怱偵峫偊傜傟偰偄傞丅偟偐偟丄儕儞偼壔妛揑偵-嘨偐傜+嘪偺暋悢偺巁壔悢傪庢傞偙偲偑壜擻偱偁傝丄垷儕儞巁 (HPO32-,巁壔悢 +嘨)傗儂僗儂儞巁 (RPO32-, +嘨)丄師垷儕儞巁 (H2PO2-, +嘥)丄儂僗僼傿儞 (PH3,-嘨)側偳偺娨尦偝傟偨儕儞傪帩偮壔崌暔 (埲壓丄偙傟傜傪傑偲傔偰娨尦宆儕儞壔崌暔偲屇傇)偲偟偰傕懚嵼偡傞偙偲偑偱偒傞 (恾1)丅偙傟傜偺娨尦宆儕儞壔崌暔偺娐嫬拞偵偍偗傞懚嵼検傗摦懺偼傑偩傎偲傫偳柧傜偐偵偝傟偰偄側偄偑丄嵟嬤彮偟偢偮嫽枴怺偄抦尒偑摼傜傟巒傔偰偄傞丅昅幰傜偼旝惗暔偺儕儞巁戙幱偵偮偄偰尋媶傪恑傔偰偒偨夁掱偱丄偙偺儕儞偺儗僪僢僋僗曄姺偵娭傢傞婡擻偼條乆側僶僀僆僥僋僲儘僕乕偵棙梡偱偒傞壜擻惈偑偁傞偙偲偵拲栚偟偨丅杮峞偱偼丄堦斒偵偼偍偦傜偔偁傑傝撻愼傒偺側偄娨尦宆儕儞壔崌暔偺旝惗暔戙幱偵偮偄偰徯夘偟丄偙偺婡擻傪妶梡偟偨昅幰傜偺嵟嬤偺尋媶傪徯夘偟偨偄丅

俀丏娨尦宆儕儞壔崌暔偺惗惉偲戙幱偵娭傢傞旝惗暔婡擻
帺慠奅偵偍偗傞娨尦宆儕儞壔崌暔偺懚嵼偵偮偄偰偼丄屆偔偐傜曬崘偑偁傞傕偺偺尰嵼偱傕晄柧側揰偑懡偄丅偍偦傜偔應掕偑擄偟偄偨傔偵丄尋媶幰娫偱偺摑堦揑側尒夝偵帄傞嵞尰惈偑摼傜傟偰偄側偄傛偆偱偁傞丅偟偐偟丄嵟嬤堎側傞暋悢偺僌儖乕僾偵傛傞娨尦宆儕儞壔崌暔偺専弌偵娭偡傞嫽枴怺偄寢壥偑曬崘偝傟偰偍傝丄偙傟傑偱偺尰忬偲暪偣偰惍棟偟偰傒偨偄丅
2-1丂娐嫬拞偵偍偗傞娨尦宆儕儞壔崌暔偺懚嵼
娨尦宆儕儞壔崌暔偺桼棃偼柍惗暔揑側傕偺偲惗暔揑側傕偺偵暘偗傜傟傞丅慜幰偼偝傜偵帺慠婲尮偲恖堊婲尮偺傕偺偵暘偗傜傟傞丅帺慠婲尮偺傕偺偵偮偄偰偼丄僔儏儔僀僶乕僒僀僩 (schreibersite)偲偄偆瑕愇偑悈偲斀墳偡傞偙偲偱師垷儕儞巁傗垷儕儞巁側偳傪惗偠偨傝1)丄棊棆帪偺僄僱儖僊乕偵傛偭偰僸僪儘僉僔傾僷僞僀僩拞偺儕儞巁偑儂僗僼傿儞傑偱娨尦偝傟戝婥拞偵曻弌偝傟傞偙偲2)丄嬥懏偺晠怘偵傛偭偰儂僗僼傿儞偑惗惉偡傞偙偲3)側偳偑抦傜傟偰偄傞丅偙傟傜偺儕儞偺憤検傪攃埇偡傞偙偲偼崲擄偱偁傞偑丄尨巒抧媴娐嫬傗壩嶳側偳尷掕偝傟偨抧堟偱偼丄儕儞尮偲偟偰惗暔偵塭嬁傪媦傏偟偆傞検偑敪惗偟偰偄偨壜擻惈偑峫偊傜傟傞丅恖堊婲尮偺娨尦宆儕儞壔崌暔偼丄岺嬈梡搑偺墿儕儞偐傜攈惗偡傞傕偺偑偁傝丄偦偺堦晹偱偁傞師垷儕儞巁傗垷儕儞巁偑攑婞暔偲偟偰奀梞搳婞傗杽傔棫偰偵傛傝張暘偝傟傞偙偲偑偁偭偨偑丄尰嵼偼娐嫬拞傊偺棳弌偼尩偟偔婯惂偝傟偰偄傞4)丅娐嫬偵捈愙棳弌偡傞娨尦宆儕儞壔崌暔偲偟偰斾妑揑僀儞僷僋僩偑偁傞傕偺偵偼丄儂僗儂儞巁宯偺擾栻偑偁傞丅戙昞揑側傕偺偲偟偰偼丄暷崙儌儞僒儞僩幮偑奐敪偟偨旕慖戰揑彍憪嵻僌儕儂僒乕僩 (IUPAC柤丗僀僜僾儘僺儖傾儞儌僯僂儉 N-(儂僗儂僲儊僠儖)僌儕僔僫乕僩)偑嫇偘傜傟傞丅僌儕儂僒乕僩偼丄暷崙偵偍偄偰懴惈堚揱巕偑慻傒崬傑傟偨僟僀僘傗僩僂儌儘僐僔丄柸壴偺庬巕偲嫟偵戝検偵惗嶻偝傟偰偍傝丄偦偺巊梡検偼暷崙偩偗偱2007擭偵偼8枩2000枩僩儞偵偺傏傝丄尰嵼偦偺惗嶻検丄巊梡検偲傕偵憹壛偟偰偄傞丅
惗暔揑側桼棃偺娨尦宆儕儞壔崌暔偲偟偰偼丄屆偔偵寵婥徚壔墭揇丄燇悈搚忞偵偍偗傞垷儕儞巁傗師垷儕儞巁丄婗敪惈偺儂僗僼傿儞偺惗惉偑曬崘偝傟偰偄傞丅Devai傜偼偄偔偮偐偺攔悈張棟応偵擣傔傜傟偨検榑揑偵愢柧偺晅偐側偄儕儞偺懝幐偑丄婥懱偱偁傞儂僗僼傿儞偲側偭偰戝婥拞偵曻弌偝傟偨寢壥偱偁傞偲曬崘偟丄偝傜偵枹摨掕偺旝惗暔傪梡偄偨寵婥攟梴偱傕摨條偵儂僗僼傿儞偺敪惗傪専弌偟偨偲偟偰偄傞5)丅悈揷搚忞偵偍偗傞儕儞偺娨尦傪敄憌僋儘儅僩僌儔僼傿乕偵傛傝専弌偟偨捸揷偼丄戝挵嬠傗僋儘僗僩儕僕僂儉偺攟梴塼偐傜傕慡懱偺5%掱搙偵憡摉偡傞儕儞傪垷儕儞巁偍傛傃師垷儕儞巁偲偟偰専弌偟偨偲曬崘偟偰偄傞6)丅偟偐偟丄巆擮側偑傜偦偺屻偄偢傟偺幚尡偵偮偄偰傕嵞尰偵惉岟偟偨椺偼曬崘偝傟偰偍傜偢丄徻嵶偼晄柧側傑傑偱偁傞丅
2-2丂娨尦宆儕儞壔崌暔偺巁壔婡峔偺敪尒
堦曽丄娨尦宆儕儞壔崌暔偺巁壔宱楬偵偮偄偰傕尋媶偑峴傢傟偰偒偨丅1967擭偵偼Pseudomonas fluorescence偵偍偄偰NAD埶懚揑側垷儕儞巁巁壔妶惈偑7)丄1974擭偵偼Bacillus懏嵶嬠偐傜師垷儕儞巁巁壔妶惈偑8)曬崘偝傟偰偄偨丅偦偺屻丄2001擭丄2002擭偵Pseudomonas stutzeri WM88姅偐傜垷儕儞巁偲師垷儕儞巁偺巁壔傪怗攠偡傞峺慺丄垷儕儞巁僨僸僪儘僎僫乕僛 (PtxD)偲師垷儕儞巁巁壔峺慺 (HtxA)偑偦傟偧傟扨棧丄摨掕偝傟傞偵帄偭偨9,10)丅PtxD偼NAD埶懚惈偺僨僸僪儘僎僫乕僛偱偁傝丄NADH偺惗惉偵敽偄垷儕儞巁傪儕儞巁偵巁壔偡傞丅HtxA偼2-僆僉僜僌儖僞儖巁埶懚揑偵師垷儕儞巁傪巁壔偟丄僐僴僋巁偲垷儕儞巁傪惗偠傞 (恾2)丅WM88姅偼偙偺椉曽傪巊偆偙偲偱師垷儕儞巁傪儕儞尮偲偟偰巊梡偡傞偙偲偑偱偒傞丅
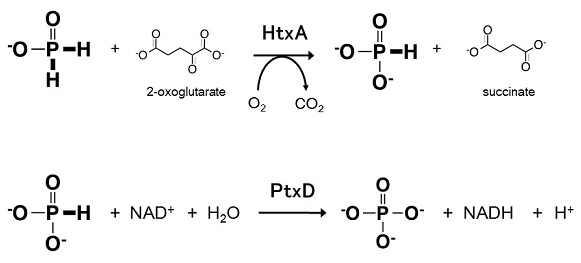
恾2丂師垷儕儞巁巁壔峺慺乮HtxA)偲垷儕儞巁壔娨尦峺慺乮PtxD)偺斀墳
儂僗儂儞巁偺巁壔婡峔偵偮偄偰偼堚揱妛揑傾僾儘乕僠偵傛偭偰1990擭偵C-P儕傾乕僛傪僐乕僪偡傞14屄偺堚揱巕偐傜峔惉偝傟傞phn僆儁儘儞偑敪尒偝傟11)丄嵟嬤偦偺斀墳婡峔偑揝-棸墿僋儔僗僞乕[Fe4S4]峺慺傪娷傓嫄戝側暋崌懱偵傛傞旕忢偵暋嶨側傕偺偱偁傞偙偲偑夝柧偝傟偨12,13)丅愭偵弎傋偨彍憪嵻僌儕儂僒乕僩偼搚忞嵶嬠偺C-P儕傾乕僛偵傛偭偰暘夝偡傞偲偝傟偰偄傞丅
偟偐偟丄偙傟傜偺暘巕婡峔偑夝柧偝傟偰側偍丄娨尦宆儕儞壔崌暔偺惗惉偵偮偄偰偼晄柧側傑傑偱偁傝丄媡偵偙傟偩偗娨尦宆儕儞壔崌暔偺巁壔宱楬偑懚嵼偟側偑傜側偤娨尦宱楬偑暘偐傜側偄偺偐偲偄偆撲傪嵺棫偨偣偰偄傞丅娨尦宆儕儞壔崌暔偼尨巒抧媴偺僾儗僶僀僆僥傿僢僋側娐嫬偱偼埨掕偵懚嵼偟摼偨壜擻惈偑偁傞偙偲偐傜丄偙傟傜偺堚揱巕偼懢屆偺旝惗暔偐傜堚偝傟偨晄梫側堚揱巕偱偁傝丄尰嵼偺抧媴娐嫬偵偍偄偰偼傕偼傗惗棟妛揑側堄枴偼傎偲傫偳帩偨側偄偲偄偆媍榑傕偁傞丅偟偐偟側偑傜丄嵟嬤偺尋媶偵傛偭偰丄奀梞惈僔傾僲僶僋僥儕傾Trichodesmium傪拞怱偲偟偨旝惗暔孮廤偑儕儞巁傪娨尦偟偰儂僗儂儞巁偲垷儕儞巁傪惗惉偡傞擻椡傪桳偡傞偙偲偑曬崘偝傟丄偝傜偵嬃偔傋偒偙偲偵偦偺検偼棨堟偐傜奀梞偵棳擖偡傞儕儞偺検傪椊偖婯柾 (1011 molP/擭)偱偁傞偲尒愊傕傜傟偰偄傞14)丅傑偨丄嵟嬤偺崅懍DNA僔乕僋僄儞僒乕傪梡偄偨尋媶偐傜儂僗儂儞巁偺崌惉宱楬偑丄5乣7%偺僶僋僥儕傾偵峀偔懚嵼偡傞偙偲偑柧傜偐偵偝傟偨15)丅堦晹偺儂僗儂儞巁偼旕峺慺揑偵垷儕儞巁偵曄壔偡傞偙偲偑抦傜傟偰偍傝丄C-P-C寢崌傪帩偮儂僗僼傿儞巁偐傜偼師垷儕儞巁偑惗偠傞偲傕峫偊傜傟偰偄傞丅偮傑傝丄偙傟傜偼惗暔妛揑側娨尦宆儕儞壔崌暔偺惗惉尮偲偟偰廳梫側堄枴傪帩偮偲峫偊傜傟傞丅偄偢傟偺敪尒傕垷儕儞巁傗師垷儕儞巁偺惗惉婡峔傪捈愙徹柧偟偨傕偺偱偼側偄偑丄尰嵼偺抧媴娐嫬偱偙傟傑偱儈僢僔儞僌儕儞僋偲側偭偰偄偨惗暔揑側儕儞偺娨尦宱楬偲側偭偰偄傞壜擻惈偑偁傝旕忢偵嫽枴怺偄丅
俁丏PtxD傪棙梡偟偨僶僀僆僥僋僲儘僕乕
偝偰丄偙偺條偵丄娨尦宆儕儞壔崌暔偺抧媴婯柾偱偺弞娐偵偍偄偰丄旝惗暔偺娭梌偑抐曅揑偵偼暘偐偭偰偒偰偄傞傕偺偺丄旝惗暔惗懺偵偍偗傞栶妱傗抧媴揑婯柾偺暔幙弞娐偵偍偗傞堄枴偼傑偩傑偩枹抦偺晹暘偑懡偄丅偟偐偟丄偙傟傑偱偵柧傜偐偵偝傟偨娨尦宆儕儞壔崌暔偺戙幱婡擻傪棙梡偡傞偙偲偱條乆側僶僀僆僥僋僲儘僕乕傊偺墳梡傪壜擻偵偡傞丅師偵変乆偑庢傝慻傫偱偄傞2偮偺墳梡椺偵偮偄偰徯夘偟偨偄丅
3-1丂PtxD偺曗峺慺嵞惗峺慺偲偟偰偺棙梡
3-1-1丂PtxD傪梡偄偨曗峺慺嵞惗宯
峺慺斀墳傪巊偭偨桳梡暔幙惗嶻偼丄壐榓側忦審偱塣揮偡傞偙偲偑壜擻側娐嫬挷榓宆偺僾儘僙僗偱偁傝丄壔妛斀墳偱偼擄偟偄暋嶨側斀墳傪壜擻偵偡傞丅偟偐偟丄尰嵼岺嬈僾儘僙僗偱棙梡偝傟偰偄傞峺慺斀墳偺65亾偼扨弮側壛悈暘夝斀墳偱偁傝24)丄桳梡側峺慺傪廫暘偵妶梡偱偒偰偄側偄丅偦偺棟桼偲偟偰丄懡偔偺峺慺偑ATP傗NAD (P)H側偳偺曗峺慺傪梫媮偡傞偙偲偑偁偘傜傟傞丅摿偵NAD(P)H偼旕忢偵崅壙偱偁傞偨傔丄幚嵺偺僶僀僆僾儘僙僗偵偍偄偰丄NAD (P)H傪斀墳摍検揧壛偡傞僾儘僙僗偼宱嵪揑偵惉棫偟側偄丅偦偙偱丄埨壙側婎幙偲嵞惗峺慺傪棙梡偟偨丄NAD (P)H嵞惗宯偺棙梡偑嫮偔朷傑傟偰偄傞丅尰嵼棙梡偝傟偰偄傞NADH嵞惗峺慺偵偼丄僊巁僨僸僪儘僎僫乕僛 (FDH)傗丄僌儖僐乕僗僨僸僪儘僎僫乕僛 (GDH)偑偁傞丅偟偐偟偙傟傜偼丄婎幙偺埨慡惈傗嵞惗峺慺偺斾妶惈丄斀墳塼偺pH曄壔傪傕偨傜偡暃斀墳暔偺惗惉側偳偵栤戣傪書偊偰偄傞16)丅
偙傟偵懳偟丄PtxD傪梡偄偨NADH嵞惗宯偼師偺傛偆側儊儕僢僩偑偁傞丅嘆垷儕儞巁偺壙奿偑旕忢偵埨壙偱偁傞 (NADH偺1/1000埲壓)嘇斀墳偑旕忢偵恑峴偟堈偔傎傏晄壜媡偱偁傞 (ΔGº'=-63.3 kJ/mol)嘊斀墳暃嶻暔偱偁傞儕儞巁偼娚徴嶌梡傪帩偮偨傔pH曄摦偵傛傞斀墳慾奞偑婲偙傜側偄嘋嵞惗斀墳偺婎幙偲惗惉暔偑柍婡暔幙偱偁傝桳婡攑塼傪弌偝側偄僋儕乕儞側僔僗僥儉偺峔抸偑壜擻偱偁傞丅偟偐偟丄P. stutzeri WM88偐傜扨棧偝傟偨PtxD偼擬埨掕惈偵朢偟偔晄埨掕偱偁傞偲偄偆栤戣傪書偊偰偄偨丅Woodyer傜偼儔儞僟儉曄堎偵傛偭偰P. stutzeri桼棃偺PtxD偺擬埨掕惈傪60亷埲忋偵崅傔傞偙偲偵惉岟偟偰偄偨偑丄偙偺曄堎懱偵偼擬埨掕惈偲堷偒懼偊偵垷儕儞巁偵懳偡傞摿堎惈偑掅壓偟偰偄傞偆偊偵丄戝挵嬠偱敪尰偝偣傞偲晄梟壔偟傗偡偄偲偄偆栤戣偑偁偭偨16,17)丅
3-1-2丂懴擬惈PtxD偺扨棧
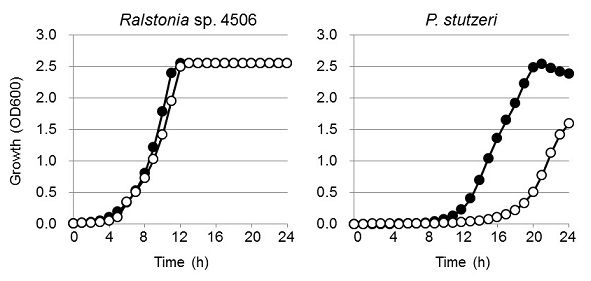
偦偙偱変乆偼岲擬惈嵶嬠偐傜PtxD傪庢摼偡傞偲偄偆傾僾儘乕僠偵傛傝擬埨掕惈偺崅偄PtxD偺庢摼傪帋傒偨丅Ralstonia sp. 4506姅偼垷儕儞巁傪桞堦偺儕儞尮偲偟偨崌惉攟抧偱廤愊攟梴偱45亷偱傕惗堢偡傞姅偲偟偰僗僋儕乕僯儞僌偝傟偨18)丅P. stutzeri偼垷儕儞巁攟抧偵偍偄偰憹怋懍搙偑掅壓偡傞偺偵懳偟丄4506姅偼垷儕儞巁攟抧偲儕儞巁攟抧偱偺憹怋偑傎偲傫偳曄傢傜偢丄岠棪揑側垷儕儞巁帒壔擻椡傪桳偟偰偄傞偲峫偊傜傟偨 (恾俁)丅4506姅偺PtxD (RsPtxD)傪庢摼偟丄惗壔妛揑夝愅傪峴偭偨偲偙傠丄斀墳帄揔壏搙偼45亷丄45亷偵偍偗傞妶惈敿尭婜偼栺73帪娫偱偁傝P. stutzeri偺PtxD (PsPtxD)偵懳偟丄3,000攞偺擬埨掕惈傪帵偟偨 (恾4a, b)丅傑偨丄峺慺妶惈傕Vmax/Km儀乕僗偱6.7攞埲忋偺抣傪帵偟丄敪尰偟偨僞儞僷僋幙偺90%埲忋偑壜梟惈僞儞僷僋幙偲偟偰敪尰偟偰偄傞偙偲偑傢偐偭偨 (恾4c)丅埲忋偺偙偲偐傜丄崅偄怗攠岠棪丄壜梟惈丄擬埨掕惈傪帵偡RsPtxD偼丄岺妛揑棙梡偵揔偟偨惈幙傪桳偟偰偄傞偙偲偑暘偐偭偨18)丅

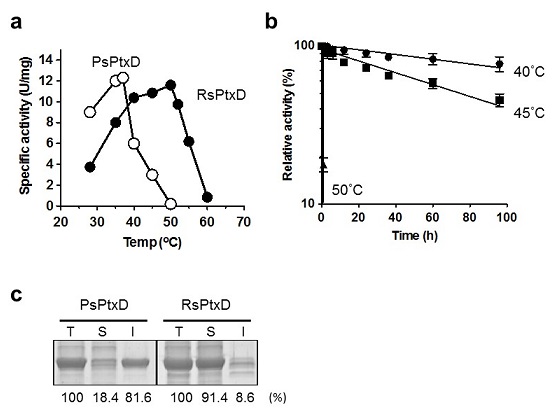

3-1-3丂RsPtxD偺曗峺慺梫媮惈偺夵曄
RsPtxD偼NAD傪棙梡偡傞偑丄NADP偵懳偟偰偼傎偲傫偳妶惈傪帵偝側偐偭偨丅NADPH偼NADH偵斾傋偰儌儖摉偨傝10攞埲忋崅壙偱偁傞偨傔NADPH嵞惗宯偺廀梫傕旕忢偵崅偄丅偦偙偱丄RsPtxD偺曗峺慺梫媮惈偺夵曄傪帋傒偨丅偙傟傑偱偵丄悢庬椶偺NAD埶懚惈僨僸僪儘僎僫乕僛偵偍偄偰僞儞僷僋幙棫懱峔憿偑夝柧偝傟丄Rossman-fold偲屇偽傟傞NAD寢崌晹埵偺β2埵僔乕僩峔憿偲α3埵僿儕僢僋僗峔憿偺拞娫偵埵抲偡傞傾僗僷儔僊儞巁巆婎丄偁傞偄偼偦偺嬤朤偵墫婎惈傾儈僲巁抲姺傪摫擖偡傞偙偲偱丄NADP傊偺摿堎惈偑崅傑傞偙偲偑抦傜傟偰偄傞19)丅RsPtxD偵偍偄偰傕摨摍偺婡擻傪帩偮偲峫偊傜傟傞傾僗僷儔僊儞巁巆婎 (D175)偑懚嵼偟偨偨傔丄D175傪傾儔僯儞傊丄椬愙偡傞176埵偺僾儘儕儞傪傾儖僊僯儞傊抲姺偟偨曄堎懱 (RsPtxD-DM)傪嶌惢偟偨丅摼傜傟偨僞儞僷僋幙偺懍搙榑揑夝愅傪峴偭偨偲偙傠丄RsPtxD-DM偼NADP偵懳偡傞Km偑栰惗姅偵斾傋偰戝偒偔掅壓偟丄NADP傊偺摿堎惈偑崅傑偭偰偄傞偙偲偑柧傜偐偵側偭偨丅傑偨丄Vmax傕戝偒偔忋徃偟偰偍傝丄Vmax/Km抣偱斾妑偡傞偲栰惗宆偲斾傋偰NADP傪曗峺慺偲偟偨偲偒偺怗攠妶惈偑栺170攞傕忋徃偟偰偄傞偙偲偑柧傜偐偵側偭偨丅
3-1-4丂RsPtxD傪巊偭偨NAD (P)H嵞惗宯偺桳岠惈昡壙
RsPtxD傪巊偭偨NADH嵞惗宯丄偍傛傃RsPtxD-DM傪巊偭偨NADPH嵞惗宯偺桳岠惈昡壙傪峴偭偨丅峈僂僀儖僗栻偺慜嬱懱偲偟偰巊梡偝傟傞L-tert-儘僀僔儞 (LTL)偼丄儘僀僔儞僨僸僪儘僎僫乕僛 (LeuDH)偵傛傞NADH埶懚揑側棫懱慖戰揑娨尦揑傾儈僲壔偵傛偭偰崌惉偡傞偙偲偑偱偒傞 (恾5a忋)丅偦偙偱丄RsPtxD傪梡偄偨NADH嵞惗宯傪偙偺斀墳偲嫟栶偝偣偰丄LTL崌惉傪峴偭偨丅0.5 mM偺NAD傪巊偭偨斀墳宯偵偍偄偰50 mM偺僩儕儊僠儖僺儖價儞巁傪3帪娫偱慡偰LTL偵曄姺偱偒偨 (恾5a壓)丅師偵RsPtxD-DM偵傛傞NADPH嵞惗宯偺昡壙傪峴偭偨丅Thermus thermophius桼棃偺僔僉儈巁僨僸僪儘僎僫乕僛 (TtSDH)偺僔僉儈巁崌惉斀墳 (恾5b忋)偲RsPtxD-DM偺嫟栶斀墳傪丄10 mM 3-僨僸僪儘僔僉儈巁 (3-DH)丄0.2 mM NADP懚嵼壓偱峴偭偨丅偦偺寢壥丄50暘偱斀墳偑姰寢偟丄慡偰偺3-DH傪僔僉儈巁偵曄姺偡傞偙偲偑弌棃偨 (恾5b壓)丅
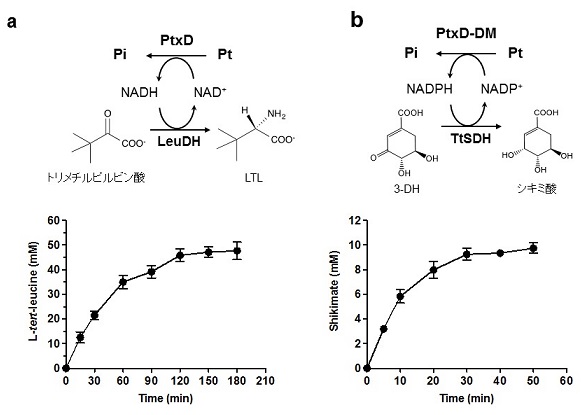

偙偺條偵丄RsPtxD傪梡偄偨NADH嵞惗宯丄RsPtxD-DM傪梡偄偨NADPH嵞惗宯偼丄嫟偵桳岠偱偁傞帠偑柧傜偐偵側偭偨丅傑偨丄椉斀墳宯嫟偵45亷偱斀墳傪峴偭偰偍傝丄RsPtxD偺崅偄擬埨掕惈偑偙偺壏搙忦審偱偺斀墳傪壜擻偲偟偰偄傞丅尰嵼棙梡偝傟偰偄傞NAD (P)H嵞惗峺慺偱偼丄峺慺帺懱偺斾妶惈偑崅偄帠偐傜丄GDH偑嵟傕岲傑傟偰巊傢傟偰偄傞傛偆偱偁傞丅偟偐偟丄RsPtxD傪梡偄偨NAD (P)H嵞惗宯傕丄慜弎偺儊儕僢僩偑偁傞偙偲偐傜丄崱屻NAD (P)H嵞惗宯偺慖戰巿偺傂偲偮偲偟偰棙梡偝傟傞偙偲偑婜懸偝傟傞丅
3-2丂PtxD偺慖戰儅乕僇乕偲偟偰偺棙梡
慖戰儅乕僇乕偼堚揱巕岺妛偺廳梫側僣乕儖偺堦偮偱偁傝丄堦斒偵偼峈惗暔幙懴惈堚揱巕傗丄塰梴梫媮惈曄堎姅偺梫媮惈傪憡曗偡傞堚揱巕側偳偑慖戰儅乕僇乕偲偟偰梡偄傜傟傞丅慡偰偺惗暔偼儕儞傪惗堢偵昁梫偲偡傞偑丄垷儕儞巁傪棙梡偱偒傞惗暔偼堦晹偱偁傞丅偦偙偱垷儕儞巁傪棙梡偱偒側偄惗暔偵PtxD傪摫擖偟丄垷儕儞巁傪桞堦偺儕儞尮偲偟偨攟抧偱攟梴偡傟偽丄PtxD摫擖姅偺傒傪慖戰揑偵憹怋偝偣傞偙偲偑偱偒傞丅偮傑傝丄ptxD偑慖戰儅乕僇乕偲偟偰棙梡偱偒傞偲峫偊傜傟傞丅垷儕儞巁偼旍椏偺惉暘偲偟偰傕擣壜偝傟偰偄傞條偵埨慡惈偼栤戣柍偄偆偊丄壙奿偼旕忢偵埨偄丅偦偙偱PtxD偑幚嵺偵慖戰儅乕僇乕偲偟偰棙梡偱偒傞偐丄嶻嬈忋廳梫側旝惗暔偱偁傞峺曣偲戝挵嬠偵偍偄偰偦偺桳岠惈傪専徹偟偨丅
3-2-1丂峺曣偵偍偗傞棙梡
峺曣偼丄恀妀惗暔偺廳梫側儌僨儖旝惗暔偲偟偰尋媶偵巊梡偝傟偰偄傞偩偗偱側偔丄僶僀僆擱椏傗壔惉昳丄堛栻昳拞娫懱傪惗嶻偡傞旝惗暔廻庡偲偟偰梡偄傜傟偰偄傞丅扨攞懱偺幚尡幒峺曣偵偮偄偰偼丄偝傑偞傑側慖戰儅乕僇乕偑懚嵼偡傞丅摿偵Ura, His, Leu側偳偵戙昞偝傟傞塰梴梫媮惈儅乕僇乕偼丄摿掕偺壔崌暔傪昁梫偲偣偢攟抧偺慻惉傪曄偊傞偩偗偱棙梡偱偒傞偙偲偐傜丄棙曋惈偑旕忢偵崅偄丅偟偐偟丄塰梴梫媮惈儅乕僇乕偺棙梡偼丄曄堎姅偺庢摼偑慜採偱偁傝丄懡攞懱偺幚梡峺曣偱偼旕忢偵崲擄偱偁傞20)丅曄堎姅偺庢摼偼棟孅忋晄壜擻偱偼側偄偑丄愼怓懱偺悢偵墳偠偰栚揑偺曄堎姅偑摼傜傟傞妋棪偼巜悢揑偵尭彮偡傞偆偊丄壖偵曄堎姅偑庢摼偱偒偨偲偟偰傕栚揑奜偺曄堎偑懡悢摫擖偝傟丄杮棃偺昞尰宆偑幐傢傟傞偙偲傕偁傞丅偙偺條側応崌丄宍幙揮姺懱傪億僕僥傿僽偵僗僋儕乕僯儞僌偡傞偙偲偑偱偒傞乽僪儈僫儞僩慖戰宆乿偺慖戰儅乕僇乕偑朷傑傟傞偑丄偦偺懡偔偼栻嵻懴惈堚揱巕偱偁傝戝検攟梴偱巊偆偵偼晄岦偒偱偁傞21)丅
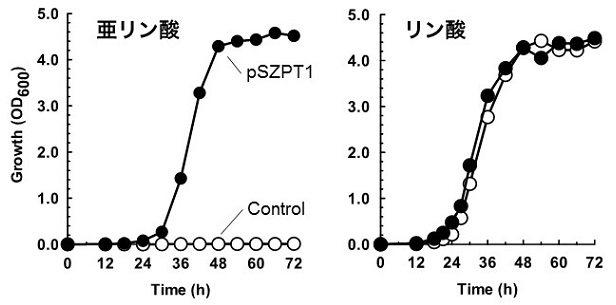
弌夎峺曣偲偟偰S. cerevisiae Kyokai No-6丄-7丄-9丄Shochu SH-4 (幚梡峺曣丄懡攞懱)丄S. cerevisiae W303a (幚尡幒峺曣丄扨攞懱)丄暘楐峺曣偲偟偰丄Shizosaccharomyces pombe (扨攞懱)偺垷儕儞巁棙梡擻傪挷傋偨偲偙傠丄慡偰垷儕儞巁傪儕儞尮偲偟偰棙梡偱偒側偄偙偲偑妋擣偝傟偨22)丅偦偙偱丄RsPtxD傪儅儖僠僐僺乕儀僋僞乕偵摫擖偟偨僾儔僗儈僪 (pSZPT1)傪嶌惢偟丄Sz. pombe偵摫擖偟偨偲偙傠丄垷儕儞巁傪扨堦偺儕儞尮偲偟偨崌惉攟抧偱憹怋偟丄嵟廔摓払嬠懱検偼儕儞巁傪儕儞尮偲偟偨偲偒偲傎傏曄傢傜側偄偙偲偑妋擣偝傟偨22)(恾6)丅傑偨丄崌惉攟抧僾儗乕僩忋偵偍偗傞宍幙揮姺懱偺慖戰岠棪傕丄塰梴梫媮惈儅乕僇乕傪棙梡偟偨応崌偲懟怓側偄偙偲偑妋擣偝傟偨傎偐丄愼怓懱偵摫擖偟偰扨堦僐僺乕偱偺慖戰傕壜擻偱偁傞側偳丄旕忢偵棙曋惈偺崅偄慖戰儅乕僇乕偲偟偰棙梡偱偒傞偙偲偑妋擣偝傟偨22)丅堦曽丄S. cerevisiae偵偍偄偰偼丄栰惗宆RsPtxD偼婡擻偣偢丄垷儕儞巁帒壔擻傪晅梌偡傞偙偲偼偱偒側偐偭偨丅偙偺尨場傪挷傋偨偲偙傠僐僪儞巊梡昿搙偵婲場偡傞偙偲偑帵嵈偝傟偨偨傔丄僐僪儞傪S. cerevisiae偵嵟揔壔偟偨堚揱巕 (OPTptxD)傪崌惉偟丄儅儖僠僐僺乕僾儔僗儈僪偵憓擖偟偨丅偙偺僾儔僗儈僪pSCPT傪忋婰5庬偺弌夎峺曣偵摫擖偟偨偲偙傠丄宍幙揮姺姅偵尠挊側垷儕儞巁巁壔妶惈偑擣傔傜傟丄垷儕儞巁崌惉攟抧忋偱憹怋偡傞偙偲偑偱偒偨丅崌惉攟抧僾儗乕僩忋偵偍偗傞捈愙慖戰偺岠棪傕塰梴梫媮惈儅乕僇乕偲傎傏曄傢傜偢丄宍幙揮姺偺慖戰儅乕僇乕偲偟偰桳岠偱偁偭偨22)丅偟偐偟側偑傜丄塼懱攟梴偵偍偗傞嵟廔摓払嬠懱検偑儕儞巁巊梡帪偺30亾掱搙偱偁傝丄傛傝懡偔偺嬠懱廂検傪摼傞栚揑偱PtxD傪棙梡偡傞応崌偼丄偙偺栤戣傪夝寛偡傞昁梫偑偁傞丅S. cerevisiae偼垷儕儞巁偵姶庴惈傪帵偟丄攟梴塼偵垷儕儞巁傪揧壛偡傞偲憹怋偑埆偔側傞偙偲偐傜丄PtxD偺敪尰検傪偝傜偵崅傔丄庢傝崬傑傟偨垷儕儞巁偺巁壔懍搙傪忋偘傞偙偲偑昁梫側偺偐傕偟傟側偄丅

3-2-2丂戝挵嬠偵偍偗傞棙梡
戝挵嬠偼尵偆傑偱傕側偔丄僶僀僆僥僋僲儘僕乕偵偍偄偰嵟傕棙梡偝傟傞帠偺懡偄僶僋僥儕傾偺傂偲偮偱偁傞丅戝挵嬠偼C-P儕傾乕僛 (Phn宱楬)偲傾儖僇儕儂僗僼傽僞乕僛 (PhoA)偵傛傞垷儕儞巁巁壔宱楬傪桳偡傞丅屻幰偼丄戝挵嬠偺PhoA偵偺傒尒傜傟傞妶惈偱丄偦偺妶惈偼PtxD偵斾傋傞偲1/100埲壓偱偁傞23)丅戝挵嬠偵偍偄偰PtxD傪儅乕僇乕偲偟偰棙梡偡傞偵偼丄偙傟傜偺撪嵼惈偺垷儕儞巁巁壔妶惈偑懚嵼偟偰傕慖戰惈傪敪婗偱偒傞偐傪昡壙偡傞昁梫偑偁傞丅4506姅桼棃偺ptxD傪垷儕儞巁僩儔儞僗億乕僞乕偱偁傞ptxABC偲嫟偵pUC儀僋僞乕偵僋儘乕僯儞僌偟丄戝挵嬠MG1655姅偵摫擖偟偨姅傪嶌惢偟丄偙偺姅偲PtxD傪帩偨側偄栰惗姅傪0.5 mM偺垷儕儞巁傪娷傓崌惉攟抧偵摨帪偵怉嬠偟丄攟梴廔椆帪偺椉幰偺妱崌傪應掕偟偨丅偦偺寢壥丄攟梴奐巒帪偵PtxD摫擖姅偲摨検 (106 cells)丄50攞 (5亊107 cells)偺栰惗姅偑嫞崌姅偲偟偰嫟懚偟偰傕攟梴廔椆帪 (80帪娫屻)偵偼PtxD摫擖姅偑偦傟偧傟99.7%丄97.0%偺妱崌傪愯傔傞偙偲偑暘偐偭偨丅偙傟偼丄PtxD摫擖姅偺曽偑垷儕儞巁傪岠棪揑偵棙梡偱偒傞偨傔偵憹怋偑懍偔丄偦偺寢壥桪愯偟偨偲峫偊傜傟傞丅崱屻丄暘巕夵曄側偳偵傛傝PtxD偺妶惈傪崅傔傞偙偲側偳偱丄傛傝慖戰惈傪崅傔傞偙偲偑偱偒傞偲峫偊偰偄傞丅
3-2-3丂怉暔偵偍偗傞棙梡
変偑崙偱偼擾嬈偵枅擭栺40枩僩儞偺儕儞偑搳擖偝傟偰偄傞偑丄嶌暔拞偺惉暘偲偟偰夞廂偝傟傞儕儞偼傢偢偐偵栺4.3枩僩儞偱偁傞24)丅偮傑傝9妱嬤偔偺儕儞偑棙梡偝傟傞帠側偔搚忞偵巆棷偟偰偄傞丅偙傟偼丄儕儞巁偑搚忞拞偺嬥懏偲寢崌偟丄晄梟壔偟偰偟傑偭偰偄傞偙偲偑庡側尨場偱偁傞丅摿偵揝傗傾儖儈僯僂儉偑懡偄擔杮偺傛偆側壩嶳惈偺搚忞偱偼夁忚偵儕儞傪嶵偔孹岦偑掕拝偟偰偄傞丅搚忞拞偵晄梟壔偟偨儕儞傪壜梟壔偡傞帋傒傕偁傞偑丄偦傕偦傕儕儞傪搚忞偵屌掕偝偣傞偙偲側偔怉暔偵媧廂偝偣傞帠偑偱偒傟偽丄儕儞巤旍偺崻杮揑側栤戣夝寛偵側傞壜擻惈偑偁傞丅
垷儕儞巁偼儕儞巁僀僆儞偲斾傋偰嬥懏墫偺梟夝搙偑崅偔 (椺偊偽垷儕儞巁偺僇儖僔僂儉墫偼儕儞巁偺僇儖僔僂儉墫偵斾傋偰1,000攞悈偵梟偗堈偄)丄揝偵懳偟偰傕晄梟惈偺墫傪嶌傝偵偔偄1)丅栤戣偼怉暔偑垷儕儞巁傪捈愙儕儞尮偲偟偰棙梡偱偒側偄偙偲偱偁傞丅嬤擭丄垷儕儞巁傪巊偭偨旍椏偑擾嬈帒嵽偲偟偰斕攧偝傟傞働乕僗偑憹偊偰偒偰偄傞偑丄偙傟偼垷儕儞巁偑怉暔偺儕儞尮偲偟偰捈愙嶌梡偡傞栿偱偼側偔丄怉暔偺昦尨嬠掞峈惈傪桿摫偟偨傝丄垷儕儞巁偑昦尨嬠偺憹怋傪梷惂偡傞偙偲偵傛傞娫愙揑側岠壥偲峫偊傜傟偰偄傞25,26)丅偦偙偱PtxD傪怉暔偵摫擖偡傟偽丄垷儕儞巁傪捈愙偺儕儞尮偲偟偰棙梡偱偒傞傛偆偵側傞偲峫偊傜傟傞丅偙偺庢傝慻傒偵偼変乆埲奜偵傕儊僉僔僐偺僌儖乕僾偑摨條偺僐儞僙僾僩偱尋媶傪恑傔偰偍傝丄憃曽偵偍偄偰PtxD傪摫擖偡傞偙偲偱垷儕儞巁偑棙梡偱偒傞傛偆偵側傞偙偲傪妋擣偟偰偄傞22,27)丅崱屻丄僋儘儃僋搚側偳幚嵺偺搚忞偱傕垷儕儞巁偑棙梡偱偒傞偙偲偑妋擣偝傟傟偽丄儕儞偺搚忞屌掕傪夞旔偟偰儕儞巤旍検傪戝暆偵尭傜偡媶嬌偺徣儕儞媄弍偵側傞偱偁傠偆丅
3-2-4丂PtxD儅乕僇乕偺崱屻偺壽戣偲揥朷
偙傟傑偱昅幰傜偑條乆側廻庡偱PtxD偺堎庬敪尰傪帋傒偰偒偨寢壥傪傒傞偲丄垷儕儞巁攟抧偱偺廫暘側惗堢懍搙傪摼傞偨傔偵偼丄師偺3偮偺億僀儞僩偑偁傞偲峫偊傜傟傞丅傑偢丄堦偮傔偼PtxD僞儞僷僋幙偺敪尰検偱偁傞丅傎傏慡偰偺廻庡惗暔偵偍偄偰丄敪尰検偑懡偄傎偳崅偄憹怋懍搙偑摼傜傟偨偑丄偙傟偼儕儞巁偑憹怋傪惂尷偡傞帠傪峫偊傞偲摉慠偺偙偲偱偁傞偲傕偄偊傞丅師偵丄廻庡偺垷儕儞巁偵懳偡傞姶庴惈偑嫇偘傜傟傞丅垷儕儞巁偑嵶朎偵懳偡傞撆惈傪敪婗偡傞儊僇僯僘儉偵偮偄偰偼傑偩偁傑傝暘偐偭偰偄側偄偑丄旝惗暔偺庬椶偵傛偭偰姶庴惈傪帵偡傕偺偲偦偆偱柍偄傕偺偑偁傞丅PtxD偑廫暘偵婡擻偡傟偽懍傗偐偵儕儞巁偵曄姺偝傟傞偨傔丄姶庴惈偺偁傞廻庡偵偍偄偰偼摿偵PtxD偺敪尰検偼懡偄曽偑椙偄偲峫偊傜傟傞丅3偮傔偼垷儕儞巁偺嵶朎撪傊偺庢傝崬傒偱偁傞丅戝挵嬠偍傛傃峺曣偺僩儔儞僗億乕僞乕攋夡姅傪梡偄偨幚尡偐傜丄垷儕儞巁偼暋悢庬懚嵼偡傞儕儞巁僩儔儞僗億乕僞乕傪夘偟偰庢傝崬傑傟偰偄傞偙偲偑暘偐偭偰偍傝丄偝傜偵儕儞巁僩儔儞僗億乕僞乕偺庬椶偵傛偭偰庢傝崬傒擻椡偑堎側偭偰偄傞偙偲偑暘偐偭偰偄傞丅偙傟傜偺億僀儞僩傪拞怱偵夵椙傪恑傔傞偙偲偱丄PtxD傪梡偄偨慖戰揑攟梴偺岠壥傪崅傔傞偙偲偑偱偒傞偲峫偊偰偄傞丅
傑偨丄PtxD傪梡偄傞偙偲偵傛傞傕偆堦偮偺儊儕僢僩偲偟偰丄攟梴宯偺柵嬠傪娙慺壔偱偒傞壜擻惈偑偁傞丅偡側傢偪丄僶僀僆僄僞僲乕儖惗嶻偺傛偆偵帠幚忋攟抧傪柵嬠偡傞偙偲偑擄偟偄攟梴偵偍偄偰巊梡偡傟偽丄嶨嬠偺崿擖偵傛傞惗嶻岠棪偺掅壓傪杊偓丄惗嶻岠棪傪戝偒偔岦忋偝偣傞偙偲偑偱偒傞偲峫偊傜傟傞丅尰嵼HtxA偲PtxD傪暪梡偡傞偙偲偱丄慖戰惈傪崅傔傜傟傞偙偲傪妋擣偟偰偍傝丄戝婯柾攟梴偵偍偄偰傕峈惗暔幙傪棙梡偟側偄偱慖戰埑傪梌偊傞攟梴偑壜擻偱偁傞偲峫偊傜傟傞丅
係丏偍傢傝偵
儕儞偺惗暔弞娐偵偍偗傞娨尦宆儕儞壔崌暔偺栶妱偼枹偩晄柧側揰偑悢懡偔巆偝傟偰偄傞丅摿偵儕儞偺娨尦偵娭傢傞旝惗暔婡擻偵偮偄偰偼偙傟傑偱慡偔曬崘偝傟偰偍傜偢丄偦偺儊僇僯僘儉偵偼旕忢偵嫽枴偑帩偨傟傞丅旝惗暔偵傛傞儕儞偺巁壔偲娨尦偑柧傜偐偵偝傟傟偽丄抧媴壔妛揑側暔幙弞娐偲偟偰偺僀儞僷僋僩偩偗偱偼側偔丄儕儞帒尮帒尮偺桳岠棙梡傪偼偠傔偲偟偨條乆側僶僀僆僥僋僲儘僕乕偺奐敪偵傕戝偒偔峷專偡傞偲峫偊傜傟傞丅崱屻丄娨尦宆儕儞壔崌暔偺惗惉丒戙幱偵娭傢傞婡峔偺徻嵶偑柧傜偐偵偝傟傞偲偲傕偵丄僒僗僥僫僽儖側儕儞偺棙梡媄弍傗妚怴揑側僶僀僆僥僋僲儘僕乕偑惗傒弌偝傟傞偙偲傪婜懸偟偨偄丅
暥專
1) Pasek, M. A.: Proc. Natl. Acad. Sci. USA, 105, 853 (2008).
2) Pasek, M., Kristin, B.: Nat. Geosci., 2, 553 (2009).
3) Roels, J., Verstraete, W.: Sci. Tot. Environ., 327, 185 (2004).
4) 嫶捾壚, 撪摗榓媣, 壀攷岾, 墱懞尦: 昞柺媄弍, 58, 13 (2007).
5) Devai, I., Felfoldy, L., Wittner, I., Plosz, S.: Nature, 333, 343 (1988).
6) Tsubota, G.: J. Soil Sci. Plant Nutr., 5, 10 (1959).
7) Malacinski, G., Konetzka, W.: J. Bacteriol., 93, 1906 (1967).
8) Heinen, W., Lauwers, A. M.: Arch. Microb., 95, 267 (1974).
9) Costas, A. M., White, A. K., Metcalf, W. W.: J. Biol. Chem., 276, 17429 (2001).
10) White, A. K., Metcalf, W. W.: J. Biol. Chem., 277, 38262 (2002).
11) Chen, C. M., Ye, Q. Z., Zhu, Z. M., Wanner, B. L., Walsh, C. T.: J. Biol. Chem., 265, 4461 (1990).
12) Seweryn, P., Van, L. B., Kjeldgaard, M., Russo, C. J., Passmore, L. A., Hove-Jensen, B., Jochimsen, B., Brodersen, D. E.: Nature (2015).
13) Kamat, S. S., Williams, H. J., Raushel, F. M.: Nature, 480, 570 (2011).
14) Van Mooy, B. A., Krupke, A., Dyhrman, S. T., Fredricks, H. F., Frischkorn, K. R., Ossolinski, J. E., Repeta, D. J., Rouco, M., Seewald, J. D., Sylva, S. P.: Science, 348, 783 (2015).
15) Yu, X., Doroghazi, J. R., Janga, S. C., Zhang, J. K., Circello, B., Griffin, B. M., Labeda, D. P., Metcalf, W. W.: Proc. Natl. Acad. Sci. USA, 110, 20759 (2013).
16) Woodyer, R., Zhao, H., van der Donk, W. A.: FEBS J., 272, 3816 (2005).
17) Woodyer, R., van der Donk, W. A., Zhao, H.: Comb. Chem. High Throughput Screen, 9, 237 (2006).
18) Hirota, R., Yamane, S. T., Fujibuchi, T., Motomura, K., Ishida, T., Ikeda, T., Kuroda, A.: J. Biosci. Bioeng., 113, 445 (2012).
19) Katzberg, M., Skorupa-Parachin, N., Gorwa-Grauslund, M. F., Bertau, M.: Int. J. Mol. Sci., 11, 1735 (2010).
20) Hashimoto, S., Ogura, M., Aritomi, K., Hoshida, H., Nishizawa, Y., Akada, R.: Appl. Environ. Microb., 71, 312 (2005).
21) Akada, R., Shimizu, Y., Matsushita, Y., Kawahata, M., Hoshida, H., Nishizawa, Y.: Yeast, 19, 17 (2002).
22) Kanda, K., Ishida, T., Hirota, R., Ono, S., Motomura, K., Ikeda, T., Kitamura, K., and Kuroda, A.: J. Biotechnol., 182-183, 68 (2014).
23) Yang, K., Metcalf, W. W.: Proc. Natl. Acad. Sci. USA, 101, 7919 (2004).
24) 徏敧廳堦戙, 媣曐桾栫, 戝抾媣晇, 挿嶁揙栫: 幮夛媄弍尋媶榑暥廤, 5, 106 (2008).
25) Lim, S., Borza, T., Peters, R. D., Coffin, R. H., Al-Mughrabi, K. I., Pinto, D. M., Wang-Pruski, G.: J. Proteomics, 93, 207 (2013).
26) Lovatt, C. J., Mikkelsen, R. L.: Better Crops, 90, 11 (2006).
27) Lopez-Arredondo, D. L., Herrera-Estrella, L.: Nat. Biotechnol., 30, 889 (2012).