【トピックス】
「コク味」ペプチドの発見と製法開発
鈴木俊一
味の素株式会社
1.はじめに
ヒトが感じる“おいしさ”に関係する最大の要素は、甘味、塩味、苦味、酸味、うま味の5基本味や香りであるが、広義では味に含まれる辛味、渋味や「こく・コク」、「こく味・コク味」などの関与も重要である1)。なお、「こく・コク」、「こく味・コク味」は、一般に区別なく、時にはひらがな、時にはカタカナが使われているので、本稿では以降、カタカナ表記を用いる。また、誰もが認める定義がまだ無いので、「」付やイタリックとする。「コク味」物質とは、それ自身呈味を発現しない濃度において、うま味・塩味溶液やスープに“持続性” (continuity)、“広がり” (mouthfulness)、“厚み” (thickness) を付与する物質と考えられており、ニンニクからはグルタチオン (GSH;γ-Glu-Cys-Gly)2)、インゲン豆からはγ-Glu-Leu、γ-Glu-Val、γ-Glu-Cys-β-Alaが単離、同定された3)。日常的に古くから「コク」あるいは「コク味」という表現が使われる一方で、「コク味」の理解を進める味覚受容体との関係については不明であった。このような状況下、当社で行われた「コク味」受容機構の解明研究、新規「コク味」物質の探索、またその製法開発に関して、ここに報告する。
2.「コク味」受容機構
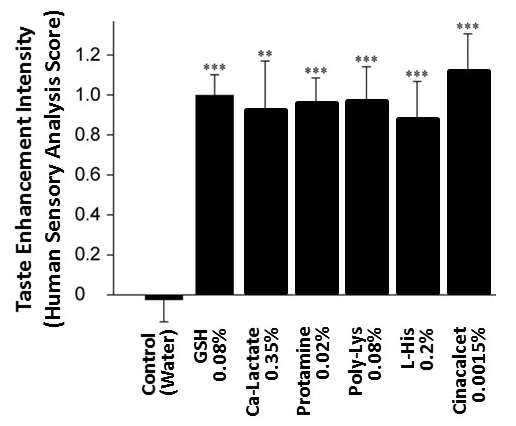
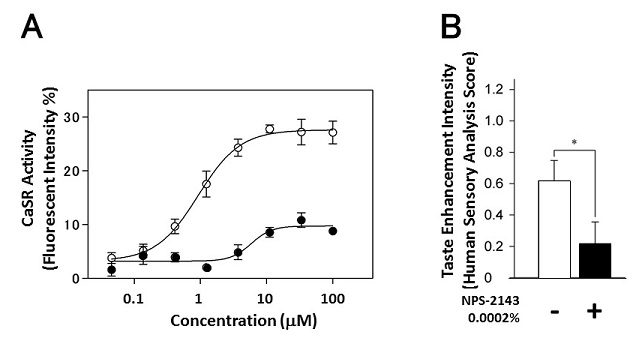
当社におけるアミノ酸受容機構に関する研究の過程で、カルシウム感知受容体 (Calcium Sensing Receptor;CaSR) が、L-アミノ酸のみならず、GSHを含む幾つかのペプチドを受容することを見出した4)。CaSRはT1R1やT1R2、T1R3など、うま味や甘味の受容に関与するGタンパク共役型受容体と同じクラスCに属していることから、味覚に何らかの関係があることが予想された。また上述のようにGSHは「コク味」物質としての機能が報告されていたことから、CaSRが、「コク味」物質を受容する、という作業仮説を立てた。この仮説検証のため、CaSR活性測定系としてCaSR遺伝子を導入したHEK-293細胞を調製し各種化合物のCaSRアゴニスト能を評価した。また同時に、グルタミン酸ナトリウム (MSG) とNaClからなる溶液に標品を添加した際の呈味増強効果をヒト官能評価で測定することにより「コク味」強度を定量化し、CaSRアゴニスト能との相関を確認することとした。まず、既知の各種CaSRアゴニストの「コク味」官能評価を実施した。評価対象としたのは、乳酸カルシウム (Ca-Lactate)、白子由来塩基性タンパク質であるプロタミン (Protamine)、アニオンであるポリリジン (Poly-Lysine)、アミノ酸としてヒスチジン (L-His)、代表的アゴニストであるシナカルセット (Cinacalcet) で、0.1% MSG+0.5% NaClコントロール溶液にこれら化合物を添加した際の“厚み”を官能評価で測定した (図1)。その結果、各CaSRアゴニストは、「コク味」物質であるGSHと同様に、コントロール溶液と比較して、官能評価において有意な評点増を示した。次に、CaSRに選択的なアンタゴニストであるNPS-2143の影響を評価した。NPS-2143は、GSHによるCaSR活性化 (図2A)、およびうま味+塩味溶液におけるGSHの呈味増強効果 (図2B) の両者を有意に低下させた。以上の結果は、CaSRアゴニストの官能 (「コク味」) への関与を強く支持するものであった。


3.新規「コク味」物質の探索
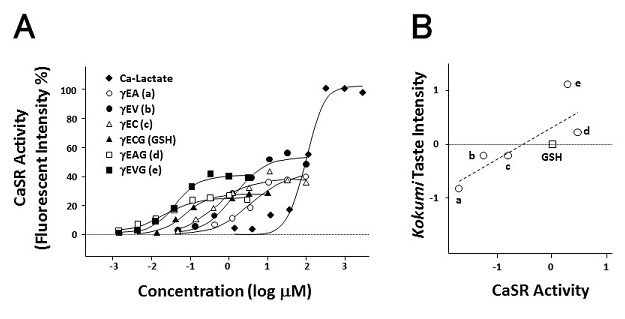
上述のように、CaSR活性と官能評価における「コク味」に相関が見られたため、CaSR活性測定系を用いて種々化合物を評価し、新たな有望「コク味」物質の探索を行った。GSHが良い「コク味」物質であることと、予備評価の結果を踏まえ、γ-Gluペプチドの評価結果を中心に報告する。CaSR活性の強さは、hCaSR発現遺伝子を導入したHEK-293細胞を用いる評価系において、最大反応Emaxの50%の反応強度を示す濃度 (EC50値) で評価した (図3A)。評価対象化合物に対しては、官能評価においてもその「コク味」強度を測定し、CaSR活性との相関を調べた (図3B)。その結果、CaSR活性と「コク味」強度は、γ-Gluペプチドでは正の相関関係を示した。この結果も、CaSRアゴニストの「コク味」官能特性への関与を強く支持した。評価化合物の中で最も高い「コク味」強度を示したのはγ-Glu-Val-Gly (γEVG) であり、その強度はGSHのおよそ10倍であった。GSHは肉汁など多くの食品中にその存在が認められ、また上述したように、その他多くのγ-Gluペプチドの天然物中の存在が報告されているが、γEVGは天然物から見出されていなかった。当社では、新たな分析手法の開発を経て、いくつかの食品素材を評価し、ホタテや醤油、魚醤などにγEVGが存在することを確認し、γEVGもまた天然に存在する「コク味」物質であることを見出した5-7)。

4.γEVGの製法開発
以上のように、新たな有用「コク味」物質としてγEVGが選抜されたため、この工業生産に向けた製法開発を検討することとした。ペプチド合成には化学合成、酵素合成とも多くの知見があるが、対象となるγEVGに特化し、改めて最適製法の構築検討を開始した。
4-1 化学合成法
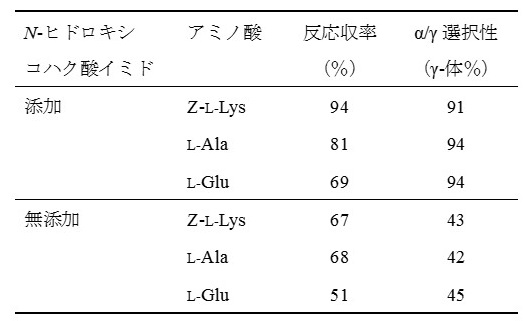
従来、グルタミン酸γ-誘導体を製造するには、N-保護グルタミン酸のα-カルボキシル基を保護し、ジシクロヘキシルカルポジイミド、アジド化等により脱水縮合した後、α-保護基を除去する方法が一般に用いられてきた。このような方法によれば、高純度のγ-誘導体が得られるものの、工程が長く操作が煩雑であり、収率も低い場合が多い。一方、N-保護グルタミン酸無水物を用いたN-保護グルタミン酸誘導体の製造法も知られているが、この方法は簡単である反面、N-保護基の種類によっては、α-誘導体とγ-誘導体の混合物が生成し、その選択性は高くない。そこで、より少ない工程数で、しかも高収率かつ高選択性でグルタミン酸γ-誘導体を生成することを目的に、当社で新たな合成法を模索した。そして、N-保護グルタミン酸の無水物をN-ヒドロキシコハク酸イミドの存在下にアミノ酸と反応させると、N-保護グルタミン酸のγ-ペプチドが高い選択性で、しかも良好な収率で生成することを見出した8)。例えば、Z-L-Lys、L-Ala、あるいはL-Gluを炭酸水素ナトリウムおよびN-ヒドロキシコハク酸イミドと共に水に懸濁し、40℃に加温後、Z-Glu無水物を含有する酢酸エチル溶液を加え反応させる。その後、塩酸を加えて分層し、酢酸エチル層を分取後、脱保護反応を行い、得られたペプチドの反応収率およびγ/α生成比を求めた (表1)。その結果、N-ヒドロキシコハク酸イミドには、反応収率を高めるだけでなく、γ-体選択性を顕著に高める作用があることが示された。本法におけるアミノ酸原料をジペプチドVal-Glyとし、N-ヒドロキシコハク酸イミド存在下でZ-Glu無水物と反応させ、その後脱保護反応を行うと、同様にγEVGが高い選択性と収率で得られた。
表1 グルタミン酸γ-ペプチド合成へのN-ヒドロキシコハク酸イミド添加効果
4-2 酵素合成法
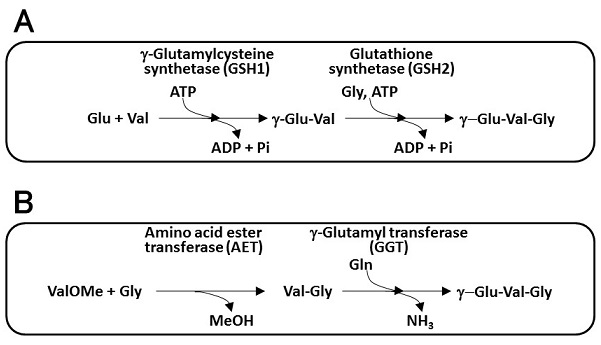
上述のように、化学合成法によるγEVGの製法が確立されたが、保護基の不使用による製造コスト低減や、溶媒使用料削減による環境負荷低減を目的として、酵素を用いるγEVG製法の開発検討を行った。化学合成法開発においても、γ/α選択性の発揮が開発のポイントとなったが、位置選択性の発揮は酵素の得意とするところであり、この点においても酵素利用の有用性が期待された。合成スキームのデザインに際しては、γEVGと類似構造を持つ生体内物質であるGSHの合成例を参考とし、合成酵素を用いる方法 (図4A) と転移酵素を用いる方法 (図4B) の2つの案を検討した。
![]()
4-2-1 合成酵素を用いる方法
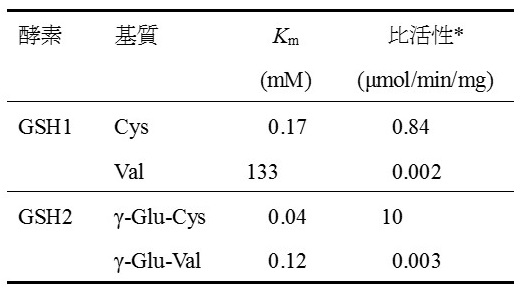
GSHのアミノ酸からの生合成は、2段階のリガーゼ反応による。1段階目の反応はγ-グルタミルシステイン合成酵素 (GSH1) によるL-グルタミン酸とL-システインからのγ-Glu-Cys合成であり、2段階目の反応はグルタチオン合成酵素 (GSH2) によるγ-Glu-CysとGlyからのGSH合成である。何れもATPをエネルギー源として用いる反応であり、本法を工業生産に応用する場合は、グルコース等の代謝からのATP供給や何らかのATP再生法を組み合わせる必要があり工夫を要するが、直接発酵法への発展も期待できるという利点がある。これらの酵素のγEVG合成への利用のためには、GSH1がL-システインの代わりにL-Valを基質として利用できること、およびGSH2がγ-Glu-Cysの代わりにγ-Glu-Valを基質として認識できることが必要となる。このような基質特異性を確認するため、Escherichia coliおよびSaccharomyces cerevisiae由来のGSHをモデル酵素として選抜した。まず、それぞれの精製酵素を調製しin vitroでのγEVG合成反応に供した (E. coli由来酵素利用の場合:12.5 mM Glu, 12.5 mM Val, 12.5 mM Gly, 12.5 mM ATP, 0.10 mg/ml γ-グルタミルシステイン合成酵素GshA, 0.11 mg/ml グルタチオン合成酵素GshB, 37℃, pH 8.0, 16 h; S. cerevisiae由来酵素利用の場合:10 mM Glu, 10 mM Val, 10 mM Gly, 10 mM ATP, 0.25 mg/ml γ-グルタミルシステイン合成酵素GSH1, 0.35 mg/ml グルタチオン合成酵素GSH2, 30℃, pH 9.0, 8 h)。その結果、何れの場合もγEVGの生成が観察され、グルタチオン生合成酵素のγEVG合成への利用可能性が示されたが、本実験におけるγEVG生成量は、何れの酵素を利用した場合も微量に留まった。この反応結果を解析する目的で、S. cerevisiae由来酵素を題材に精査を行った (表2)。その結果、GSH1ではCysに対するKm値が0.17 mMである一方、Valに対するKm値は133 mMと大きく異なった上、合成比活性もγ-Glu-Cys合成速度に比べるとγ-Glu-Val合成速度は約400分の1程度であった。GSH2では、基質親和性の点では大きな開きはなかったが、合成速度は著しく異なり、γEVG合成速度を1とするとGSH合成速度は約3000であった。工業的なγEVG製法確立に向けては、変異導入による将来的な酵素性質改善の可能性は考えられるものの、グルタチオン合成酵素が多種生物に広く存在していることを考えると、まずはγEVG合成に相対的に適した親酵素の探索と選抜が重要と考えられた。
表2 S. cerevisiae由来グルタチオン生合成酵素の基質特異性

4-2-2 転移酵素を用いる方法
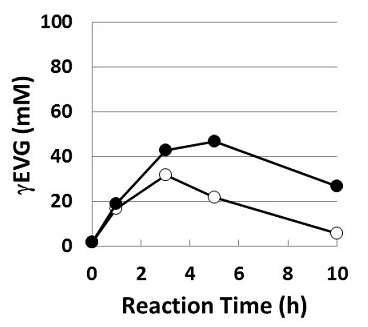
転移酵素を用いるγEVG合成においては、まずアミノ酸エステルトランスフェラーゼ (AET) によってL-バリンメチルエステル (L-ValOMe) とGlyからVal-Glyを合成する。AETは当社において微生物から見出された酵素で、アシルドナーであるアミノ酸エステル、求核剤であるアミノ酸の双方に対して広い基質特異性を示すため、汎用的なジペプチド合成酵素として有用である9)。ValOMe、Glyの何れも基質としてAETに認識され、本酵素によってVal-Glyが合成可能であることが確認されている。2段階目の反応では、AETによって合成されたVal-Glyをグルタミン酸のγ-位に付加することが求められる。γ-Gluペプチド合成に用いる転移酵素として、γ-グルタミルトランスフェラーゼ (GGT) に着目した。GGTは微生物からヒトに至るまで多くの生物種に広く存在する酵素で、GSH等のγ-Gluペプチドから加水分解によりグルタミン酸を切り出す活性を示すが、これに加え、Glnをドナーとした転移反応によってアミノ酸にγ-Glu基を転移させγ-Gluペプチドを生成する活性も示す。工業的なγ-Gluペプチドの合成を考える際、安価なGlnをドナーとして利用できる点で、魅力的な酵素である。また求核剤としてアミノ酸のみならずジペプチドも認識することが報告されており10)、今回の目的であるGlnとVal-GlyからのγEVG合成への適用が期待された。この可能性検証のため、E. coli由来GGTをモデル酵素として選抜し、その精製酵素を調製してγEVG合成反応に供した。その結果、100 mM Gln、100 mM Val-Glyから最大で32 mMの、そしてGln当量を倍とした200 mM Gln、100 mM Val-Glyからは最大で47 mMのγEVG生成がそれぞれ観察された (図5)。反応副生物を解析した結果、生成量の多い副生物としてGlu、γ-Glu-Gln、およびγ-Glu-γEVGが見出された。副生物解析の結果からγEVG生成収率の不十分な理由を考察すると、目的の転移反応の他にGlnを加水分解する反応、およびVal-Gly以外のGlnやγEVGにγ-Glu基を転移する副反応の存在が推察された。精製したGGTを酵素源として用いていることから、これらの副生物の生成はGGTの特異性に係る問題であると考えられ、今後、加水分解に対する転移活性の向上、求核剤としてのVal-Glyに対しての選択性の向上が求められ、反応条件の最適化や変異導入による酵素改質を試みる必要がある。

5.おわりに
以上のように当社では、CaSR機能の再発見から、新規「コク味」物質であるγ-グルタミルペプチドの発見に至り、その中から特にγEVGに注目して、その製法開発を開始した。また、製法開発と並行して、γEVGの呈味特性に関する研究や、その商品化に関しても検討を行っている。本研究は、受容体を用いる新規化合物探索、バイオ技術を用いる有用化合物の製法開発、そして食品アプリケーションと、多岐に渡る企業研究から新商品を生み出そうという活動であると同時に、新たな味覚・風味のサイエンスの発展に貢献するものであると期待したい。また、商品化を通じて味覚修飾の概念を啓蒙すれば、世界中の人々の食生活向上が実現するとの信念に基づき、今後の研究に邁進したいと考えている。
文献
1) 山口静子: 味と匂誌, 4, 515 (1997).
2) Ueda, Y., Sakaguchi, M., Hirayama, K., Miyajima, R., Kimizuka, A.: Agric. Biol. Chem., 54, 163 (1990).
3) Dunkel, A., Koster, J., Hofmann, T.: J. Agric. Food Chem., 55, 6712 (2007).
4) Ohsu, T., Amino, Y., Nagasaki, H., Yamanaka, T., Takeshita, S., Hatanaka, T., Maruyama, Y., Miyamura, N., Eto, Y.: J. Biol. Chem., 285, 1016 (2010).
5) Kuroda, M., Kato, Y., Yamazaki, J., Kageyama, N., Mizukoshi, T., Miyano, H., Eto, Y.: Food Chemistry, 134, 1640 (2012).
6) Kuroda, M., Kato, Y., Yamazaki, J., Kai, Y., Mizukoshi, T., Miyano, H., Eto, Y.: J. Agric. Food Chem., 60, 7291 (2012).
7) Kuroda, M., Kato, Y., Yamazaki, J., Kai, Y., Mizukoshi, T., Miyano, H., Eto, Y.: Food Chemistry, 141, 823 (2013).
8) Nakazawa, M.: JP-119916 (1996).
9) Yokozeki, K., Hara, S.: J. Biotechnol., 115, 211 (2005).
10) Hofmann, T., Meyerhof, W., Schieberie, P.: Recent highlights in flavor chemistry & biology, 227 (2007).