【トピックス】
α位に置換基を持つアミノ酸を利用する非リボソームペプチド生合成系の機能解析
勝山陽平、大西康夫
東大院・農生科・応生工、東大院・農生科・応生工
1.はじめに
放線菌は多様な二次代謝産物を生産する菌であり、古くから重要な医薬品源となってきた。それらの中でも特に重要なのが非リボソームペプチド (NRP) と呼ばれる化合物群である1)。抗生物質であるバンコマイシンやダプトマイシン (図1) がその代表的な化合物であるが、他にも実に様々な構造、生理活性を持つNRPが単離同定されている。これらの機能と構造の多様性はそれらを生合成する酵素機能の多様性によりもたらされている1)。
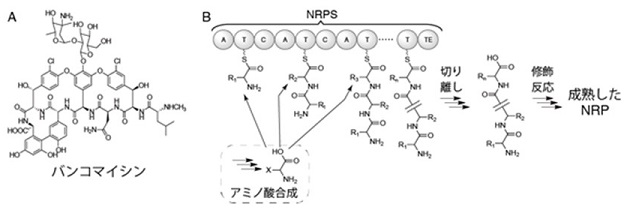
図1 代表的なNRP (A) と 一般的なNRPの生合成経路 (B) 。
NRPの生合成経路は3段階に分けることができる1)。第一段階はNRPの構成単位となるアミノ酸 (場合によってはカルボン酸) の合成である。これらのアミノ酸の多くは一次代謝により生合成されるが、独自の経路により生合成される非タンパク質性アミノ酸も数多く含まれる。これらが構造中に含まれる点がNRPの多様性に大きく寄与している。代表的な非タンパク質性アミノ酸としてヒドロキシフェニルグリシンやジヒドロキシフェニルグリシンがあげられる。
第二段階はNRP合成酵素 (NRPS) により触媒されるペプチドの合成であり、この反応がNRPの生合成において最も重要である。NRPSは多くの場合、複数の異なる機能を持つドメインが結合した長大なタンパク質 (小さいもので60 kDa程度、大きいものだと700 kDa以上) である。ペプチド結合の形成には縮合 (C)、アデニル化 (A)、チオール化 (T) の3種のドメインが必要である。Aドメインは基質となるアミノ酸の活性化、Cドメインはペプチド結合の形成、Tドメインは基質や中間体と共有結合することでそれらを運搬する役割を担っている。また、通常NRPSのC末端にはチオエステラーゼ (TE) ドメインが存在し、ペプチドをNRPSから切り離す役割を担っている。これら以外にもヘテロ環の形成を担うヘテロ環化 (CYC) ドメインやメチル化を担うメチルトランスフェラーゼ (MT) ドメインが存在する場合があり、NRPの構造多様性に寄与している。NRPSは様々な非タンパク質性アミノ酸を基質として用いることで多様な構造のペプチドを合成する。
第三段階はポストNRPS修飾酵素群によるペプチドの修飾反応である。グリコシル化、水酸化、プレニル化など様々な反応がこの段階に用いられており、これらの反応がNRPの構造多様性に与える影響は決して小さくない。
本研究では放線菌より単離されたNRP, JBIR-34, -35の生合成に着目しその生合成酵素群の解析を行い、α位に置換基を持つアミノ酸 (α-メチル-L-セリン) を利用するNRPSの解析に成功したので紹介する (図2)2)。JBIR-34, -35は放線菌Streptomyces sp. Sp080513GE-23の生産するテトラペプチドであり、弱いラジカル消去活性を有する3)。その構造の特徴はN末端にハロゲン化などの修飾を受けたインドール環が存在することと、4位にメチル基を持つオキサゾリン環が存在することである。オキサゾリン環を持つNRP は数多く存在するが、4位にメチル基を持つものはほとんど知られておらず、その生合成経路に興味が持たれた。
2.JBIR-34, -35生合成遺伝子クラスターの探索と同定
原核微生物において特定の化合物の生合成遺伝子群はゲノム上にまとまって存在する場合が多く、それは生合成遺伝子クラスターと呼ばれている。まず、ゲノムの解読により生合成遺伝子クラスターの探索を行った。その結果、5つのNRPSとハロゲン化酵素をコードする遺伝子を含む生合成遺伝子クラスターが見つかった。NRPSをコードする遺伝子のうち1つを破壊した株を作製したところ、JBIR-34, -35の生産が消失したことから、この生合成遺伝子クラスターがJBIR-34, -35の生合成を担うことが証明された。そこでこれらの遺伝子をfmo遺伝子と名付けた。NRPSであるFmoA1-A5はそれぞれ図2に示したドメインを持っていた。
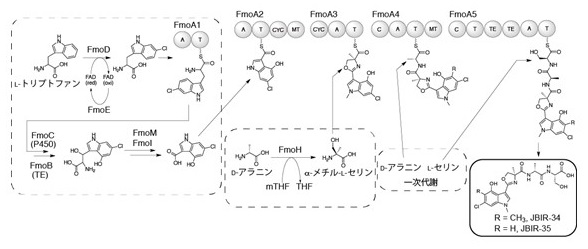
![]()
3.安定同位体取り込み実験による4-メチルオキサゾリン合成機構の推定
まず、4-メチルオキサゾリン環のメチル基の由来を推定するために安定同位体の取り込み実験を行った。このメチル基は非タンパク質性アミノ酸であるα-メチル-L-セリンに由来すると考えられる。このアミノ酸はSAM依存型メチルトランスフェラーゼによるL-セリンのα位のメチル化、もしくはD-アラニンのヒドロキシメチル化によって生合成されることが予想された。そこで [methyl -13C]-メチオニンもしくは [3-13C]-アラニンを培地に添加し、JBIR-34への安定同位体の取り込みを調べた。その結果、メチオニンのメチル基はインドール環に存在する2つのメチル基には取り込まれたが、4-メチルオキサゾリン環には取り込まれなかった。一方、アラニンのメチル基は4-メチルオキサゾリン環に取り込まれることが明らかとなった。このことから上述した後者の経路で4-メチルオキサゾリン環が生合成されると予想された。
4.α-メチル-L-セリン合成酵素の機能解析
次にα-メチル-L-セリンの生合成を担うと予想される酵素を探索し、JBIR-34, -35生合成遺伝子クラスター内に存在するグリシン/セリンヒドロキシメチルトランスフェラーゼ (GSHMT) ホモログ、FmoHに着目した。GSHMTは通常グリシンを基質とし、N5,N10-メチレンテトラヒドロ葉酸 (mTHF) を補酵素としてセリンを合成する反応を触媒する4)。もしFmoHがグリシンの代わりにアラニンを用いる酵素であればα-メチル-L-セリンの合成を担うことができると考えられる。そこで、この逆反応を用いてFmoHの性質を解析した。大腸菌を用いて調製した組換えFmoHをテトラヒドロ葉酸 (THF)、α-メチル-L-セリン、α-メチル-D-セリン、L-セリンもしくはD-セリンとともに反応させ基質特異性を調べた (図3)。その結果、D-セリンとともに反応させた場合、グリシンの生成は観測されなかった。一方、L-セリンもしくはα-メチル-D-セリンを基質として用いた場合、それぞれごく微量のグリシンもしくはアラニンの生成がみられた。α-メチル-L-セリンを基質とした場合は多量のアラニンが生成した。このアラニンの立体をマーフィー法を用いて調べたところD-アラニンであることが明らかとなった。また、D-アラニン合成反応はTHF非存在下では進行しなかった。α-メチル-L-セリンを基質としたときのD-アラニン生成反応の速度論解析を行ったところ、kcat = 0.40 min-1, Km = 105 µMであった。これらの実験からFmoHはJBIR-34, -35の生合成においてD-アラニンからα-メチル-L-セリンの生合成を担っていると予想された。
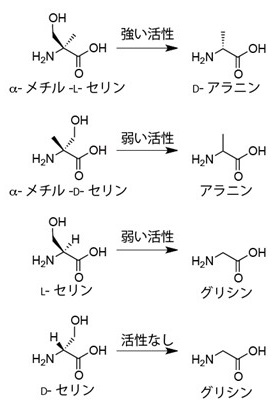
図3 FmoHのin vitroにおける反応性。
5.NRPSの基質特異性の解析
JBIR-34, -35の生合成経路に関する更なる知見を得るためにNRPS(FmoA2-A5) の持つAドメインが認識する基質を調べた。AドメインはTドメインにアミノ酸を結合させる前にATPを消費し、アミノアシルAMPを合成する。このとき同時に生成するピロリン酸をフォスファターゼによって分解し、得られたリン酸の量を定量することで相対活性を見積もった。その結果、FmoA1のAドメインは6-クロロ-L-トリプトファンを基質として好むことが明らかとなった。L-トリプトファンも基質として認識したが、6-クロロ-L-トリプトファンを基質とした際により高い活性を示した。FmoA2, A3, A4, A5のAドメインはそれぞれ6-chloro-4-hydroxyindole-3-carboxylic acid、α-メチル-L-セリン、D-アラニン、L-セリンを基質として好むことが明らかとなった。これらのアミノ酸もしくはカルボン酸はJBIR-34, -35を構成するアミノ酸と一致し、これら4つの酵素が共同してJBIR-34, -35の合成を行っていることがわかった。
6.JBIR-34, -35の予想生合成経路
これらの実験結果からJBIR-34, -35は以下の経路で生合成されると予想された。JBIR-34, -35の第一段階は構成要素となるアミノ酸とカルボン酸の合成である。6-chloro-4-hydroxyindole-3-carboxylic acidの合成には複数の酵素が関わっており、初発反応はフラビン依存型酸化酵素 (FmoD) によるL-トリプトファンの6-クロロ化である。6-クロロ-L-トリプトファンはFmoA1のAドメインにより認識され、そのTドメインと結合する。6-クロロ-L-トリプトファンはFmoA1と結合した状態でP450(FmoC) によりβ-位が酸化され、その後TE(FmoB) により切り離される。その結果得られた化合物はFmoMの触媒する逆アルドール反応によりアルデヒドとグリシンへと分解される。このアルデヒドがさらにFmoIにより酸化されることで6-chloro-4-hydroxyindole-3-carboxylic acidが得られる。α-メチル-L-セリンはFmoHによりD-アラニンから生合成される。D-アラニンはペプチドグリカン合成経路より、L-セリンは一次代謝におけるアミノ酸合成の結果得られたものが用いられていると考えられる。第二段階においてこれらの構成要素がFmoA2, A3, A4, A5により組み立てられ、JBIR-34, -35が合成される。インドール環のメチル基はFmoA2, A4に存在するMTドメインにより導入されると予想される。
7.おわりに
本研究で我々はα-位に置換基を持つアミノ酸を利用するNRPSを見いだした。このようなアミノ酸を認識するNRPSは2-アミノイソブチル酸を認識するもののみがこれまで知られており5)、非常に珍しい酵素であるといえる。また、α-メチル-L-セリンの生合成酵素を明らかにした。これまでに公開されているゲノム情報を用いてα-メチル-L-セリン合成酵素 (FmoH) のホモログとNRPSの両方をコードしている遺伝子クラスターを探索したところ、いくつかの菌株からそのような遺伝子クラスターが見いだされた。α-メチル-L-セリンを構造中に持つNRPはこれまであまり多く知られていない。そのため、これらの遺伝子群の機能を解析することで新規NRPの発見につながることが期待される。
謝辞
本研究は文科省科学研究費補助金新学術領域研究「生合成マシナリー研究」と最先端・次世代研究開発支援プログラムから助成を受けて行われました。
文献
1) Sattely, E. S., Fischbach, M. A., Walsh, C. T.: Nat. Prod. Rep., 25, 757 (2008).
2) Muliandi, A., Katsuyama, Y., Sone, K., Izumikawa, M., Moriya, T., Hashimoto, J., Kozone, I., Takagi, M., Shin-ya, K., Ohnishi, Y.: Chem. Biol., 21, 923 (2014).
3) Motohashi, K., Takagi, M., Shin-Ya, K.: J. Nat. Prod., 73, 226 (2010).
4) Pai, V. R., Rajaram, V., Bisht, S., Bhavani, B. S., Rao, N. A., Murthy, M. R., Savithri, H. S.: Biochem. J., 418, 635 (2009).
5) Gao, X., Chooi, Y.-H., Ames, B. D., Wang, P., Walsh, C. T., Tang, Y.: J. Am. Chem. Soc., 133, 2729 (2011).