【トピックス】
古賀雄一、金谷茂則
1.はじめに
プロテアーゼは洗浄、皮革・繊維加工等に用いられる産業用酵素であるが、その中でもよく使われているのがサチライシンファミリープロテアーゼである。サチライシンファミリープロテアーゼはSerを活性中心にもつアルカリプロテアーゼで、枯草菌由来のSubtilisin CarlsbergやSubtilisin BPN’、Proteinase Kなどがよく知られている。これらの酵素の多くは、比較的耐熱性が高く60〜70℃が反応至適温度であるため使いやすい。洗浄剤の添加剤や研究用試薬として広く使用されている。近年、80℃以上の高温環境で生育する超好熱菌PyrococcusやThermococcusからもサチライシンファミリープロテアーゼが見出されており、100℃でも失活しないサチライシンも単離されている1)。本稿では、超好熱菌由来のプロテアーゼの例としてThermococcus kodakarensis から単離されたサチライシンファミリープロテアーゼであるTk-SPについてその耐熱性だけではない独特な性質、その分子構造から産業応用の可能性までを紹介したい。
2.Thermococcus kodakarensis KOD1由来プロテアーゼ
T. kodakarensis KOD1 は生育至適温度が85℃の超好熱始原菌 (古細菌) で、そのゲノムは福居等によって全ゲノム解析が行われデータベースが公開されている2)。Subtilisin family proteaseのアミノ酸配列を用いてこのゲノム情報をBLAST検索すると、“Subtilisin-like ser protease”としてアノテーションされている遺伝子が3種類見いだされる。Tk-subtilisin (Accssion no: BAB60701)、Tk-1689 (同: YP184102)、Tk-0076 (同: YP182489) である。この内Tk-subtilisinについては、2001年以降、構造と機能についての研究が進められており、90℃以上の高温環境に適応した酵素学的性質や、その高い構造安定性を決めている構造因子の解明が行われてきた3-7)。枯草菌由来サチライシン同様、Tk-subtilisinも発現後、成熟化プロセスを経て活性化する。Tk-subtilisinは、N末端にあるPro配列が成熟化の鍵となっている。Pro配列はこの成熟化の過程で立体構造の形成を促進する他、活性部位に結合して活性を阻害して不要な自己分解を防ぐ働きがある。Tk-subtilisinは温度やCaイオンなどの条件がそろうと、このPro配列が分解され一気に活性化する。このような複雑な成熟化メカニズムは、強力なタンパク質分解活性がfolding過程の分子を自己分解してしまうことを防ぐ仕組みではないかと考えられている。
T. kodakarensis ゲノムに存在する残りの2つのプロテアーゼと思しき遺伝子Tk-0076とTk-1689についても同様に組換え体を取得して研究は進められた。Tk-0076のコードするタンパク質は、Tk-subtilisinと高い相同性を示し、活性中心と思われるアミノ酸残基もよく保存されているにもかかわらず、プロテアーゼ活性を示す活性化酵素は得られていない。一方、Tk-1689がコードするタンパク質は、非常にfoldingし易く、高温条件下でオートプロセッシングされて成熟化するプロテアーゼであることが確認できている8)。このプロテアーゼをTk-SPと名付けその構造と機能を解析した。
3.Tk-SPの成熟化機構
Tk-subtilisinは大腸菌で組換えタンパク質として発現させると不溶性画分に蓄積するが、リフォールディング操作を行うことで、効率よく正しい構造を取ることができるため、比較的研究のしやすい酵素である。一方、Tk-SP (全長663残基) のシグナル配列を除いた640残基 (Pro-Tk-SP) を大腸菌で組換えタンパク質として発現させると少し様子が異なることがわかる。大腸菌溶菌液サンプルをトリクロロ酢酸 (TCA) で処理し、全タンパク質を沈殿させた後、SDS-PAGEにかけると図1aのように全タンパク質を確認することができるが、予想されるPro-Tk-SPの誘導発現が確認できない。一見、組換え体が発現していないように見える。しかし同じサンプルをTCA処理せずにSDS-PAGEに供すると、図1bのように誘導発現後のサンプルはタンパク質分解がおこる。これはTk-SPの安定性が強いため、1%程度のSDSが入ったサンプルバッファー中では変性せず、溶液中に共存するタンパク質を分解していると考えられる。つまり、Pro-Tk-SPは微量ながら発現しており、SDSサンプルバッファー中での熱処理中に活性化し、他のタンパク質を分解していると予想された。果たして、この発現誘導4時間後の大腸菌溶菌液サンプルをSDS-PAGEに供し、プロテアーゼ活性染色を行うと、強い活性を持つバンドが検出される (図1c)。Pro-Tk-SPの予想分子量は68.6kDaであるが、図1cより、Pro-Tk-SPの大部分は44kDaタンパク質にプロセシングされて活性Tk-SPとなっていることが分かる。ちなみに68kDaの活性バンドは、泳動後の活性染色中にゲル中でPro-Tk-SPから活性化したTk-SPに起因すると予想される。
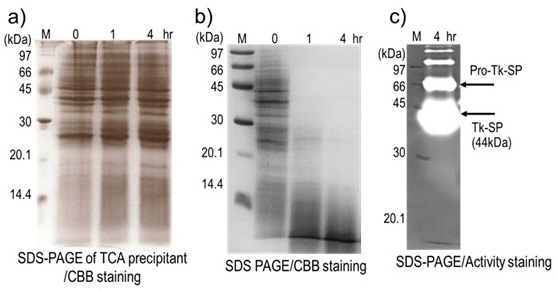
図1 Pro-Tk-SP発現大腸菌溶菌液のSDS-PAGE解析
44kDaタンパク質を精製しN末端配列を決定し、プロセシング位置を同定したところ、Pro-Tk-SPの113番目のAlaと114番目のValの間でプロセシングされていた。しかしこの切断位置では予想分子量が55kDa程度になることから、C末端側のプロセシングを予想した。この44kDaタンパク質の質量をMALDI-TOF MSで精密に分析したところ、分子量は44187 ± 202 Daであったことから、C末端側の切断点は539番目のValと540番目のAspの間で有ることが分かった。この一連のプロセシングによって除去されるアミノ酸配列をN-propeptide、C-domainとした (図2)。Pro-Tk-SPはN-propeptideが活性部位に結合することで、自己分解を阻害している。これを熱処理 (例80℃、1時間) することでN-propeptideが自己触媒的に切断、分解されTk-SPは活性型となる。C-domainの働きを明らかにするために、C-domain欠損変異体を作成したところ、Tk-SPの安定性に寄与するドメインであることがわかってきた。In vitroではC-domainは切断されるが、本来はプロセシングされるべきものではない可能性も考えられる9)。
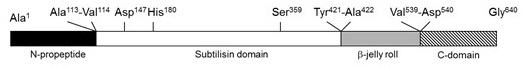
図2 Pro-Tk-SPのドメイン構造
Tk-SPは自己分解するため、結晶化するための高濃度酵素液の調製が出来ない。そこで、活性中心の359番目のSerをAlaに置換した活性中心変異体を構築し、結晶構造解析を行った (図3)10)。その結果、N-propeptide (図中赤色) と触媒ドメインである (subtilisin domain:図中緑色) は、他のサチライシンファミリープロテアーゼと非常によく似た構造をとっていることが明らかとなった。また、活性ドメインとC-domainの間に、119残基からなる新たなドメインがありβ-jerry roll構造をとっていることが明らかとなった (図中黄色)。この β-jerry rollドメインはCaイオン (図中水色) を2分子配位していた。このドメインを除去した変異Tk-SPではその変性温度がおよそ30℃低下することから、β-jerry rollドメインが酵素の構造安定性に寄与していることが予想される。このような β-jerry roll構造は超好熱菌Pyrococcus furiosus、Thermococcus gmmatolerans、Thermococcus onnurineusのアルカリSerプロテアーゼ (各Accession No. NP579399、YP002958734、YP002307742) にも存在しており、超好熱菌酵素の安定化メカニズムの一つといえる。
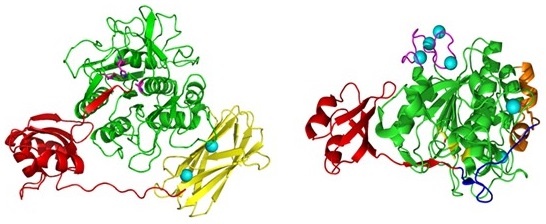
図3 Tk-SPの結晶構造 (左) とTk-subtilisinの結晶構造 (右)
4.Tk-SPの特性
先行研究で、Tk-subtilisinは反応至適温度が100℃に達する極めて熱安定性の高い酵素であることがわかっている。Tk-subtilisinには独自の挿入配列が有り最大7つのカルシウムイオンが結合することで、そのfolding速度を早め、安定性を高めている。しかし、Tk-SPにはこのようなTk-subtilisinに見られる安定化機構は見当たらない。しかし、その反応至適温度や熱処理に対する残存活性を見てみると、Tk-SPも90℃以上で最大活性を示し (図4a)、また、熱処理に対する安定性を見ても100℃における半減期が90分と、Tk-sutilisinに匹敵する極めて高い熱安定性を示す (図4b)8)。
図4cは10 mM EDTA存在下での熱安定性を比較したものである。Tk-subtilisinは55℃でもすみやかに失活するのに対し、Tk-SPは80℃60分の熱処理でもほとんど失活しない。この差は両者の安定化機構の違いによるものである。Tk-subtilisinは図3のように多くのCaイオンを活性ドメイン中に配位して構造の安定化を図っている。Tk-SPもCaイオンが配位しているがそれは β-jerry rollドメインと活性ドメインの境界に位置しており、数も少ない。これらも構造安定性に寄与しているが、その貢献度はTk-subtilisinほどではない。後述するが、EDTAに対する耐性が強いことは、プロテアーゼを洗浄剤添加酵素として実用化するうえで重要な意味がある。
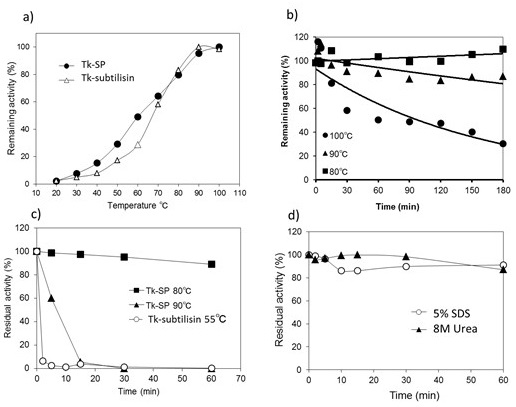
図4 Tk-subtilisinとTk-SPの安定性
Tk-SPはその構造の安定性から、変性剤に対する安定性も非常に高い。図4dのように5% SDSや8M Ureaによる変性を行っても不可逆的に変性することはなく、高い酵素活性を保つことができる8)。超好熱菌由来の酵素の産業利用を考えるとき、その多くは耐熱性が高い為に、高温条件下での利用や、長期の保存安定性を期待されるが、様々な添加剤との共存下でも高い活性を維持できる点も魅力の一つといえる。
5.プリオン分解と産業応用
Tk-SPの特性を考えると、いろいろな利用の可能性が見えてくる。中でも一番現実的なのが医療用洗浄剤としての活用である。医療用洗浄剤とは医療機関で使用されるリユース器具の洗浄に使用される洗浄剤である。多くの場合ウォッシャーディスインフェクター (WD) と呼ばれる自動洗浄機 (家庭用食洗機の医療用バージョン) で使用されている。洗浄は高温のジェット水流の吹付けで行われている。よく使われているのはアルカリ洗浄剤で、強いアルカリの作用で、体液等タンパク質を多く含んだ汚れを効率よく除去することができる。しかし、アルカリ洗浄液は長期の仕様によって、器具や洗浄機を傷める可能性が有り、より温和な条件で洗浄することが望まれている。そこで、プロテアーゼをタンパク質汚れ除去の有効成分として医療用洗浄剤に添加した中性洗浄剤が市販されている。アルカリの洗浄効果をプロテアーゼの活性で補うことができるため、市場に浸透しつつ有る。酵素洗浄剤に使われているのは主に枯草菌由来のサチライシンである。洗浄機洗浄の際は洗浄温度が高いほど効率が良いのであるが、酵素の使用条件にあわせ60〜70℃までで使用する必要がある。一方超好熱菌のプロテアーゼは100℃でも安定した酵素活性を発揮できるため、洗浄効率のよい高温で器具の洗浄が可能であり洗浄力の高い酵素として活用の可能性がある。
さらに、超好熱菌由来のプロテアーゼは医療現場で、単なる洗浄にとどまらない新たな付加価値を提供できる。その一つがプリオン不活化効果である。プリオンタンパク質は、プリオン病の感染因子と考えられており、異常プリオンタンパク質の混入が疑われた場合、厳重にその不活化が求められる。しかし、異常プリオンタンパク質は熱や洗浄に対して抵抗性があり、ステンレスの表面などに残留してしまうため通常の洗浄、滅菌操作では不活性化できない。また、一般的なプロテアーゼによる分解にも耐性があることが知られており、異常プリオンタンパク質の除去は医療用器具洗浄の一つの課題である。
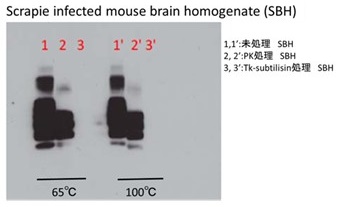
図5 プリオン感染マウス脳ホモジネートのプロテアーゼ分解試験
羊のスクレイピーに感染させたマウスの脳ホモジネート (SBH) に、Tk-subtilisinまたはProteinase K (PK) を加え反応させ、残存したプリオンタンパク質を抗プリオンタンパク質抗体 (SAF83) を用いたウエスタンブロット法により検出した (図5)。未処理SBHには正常型、異常型両方のプリオンタンパク質が含まれている。PK処理を施したものは、正常型だけが分解され、異常型プリオンタンパク質が残存する。ここにTk-subtilisinを加え、65℃以上の高温で反応させると、プロテアーゼ耐性と言われる異常プリオンタンパク質も検出できないレベルにまで分解が進んでいることが分かる11)。さらに、1%SDS存在下では分解が短時間で完了し分解効率が良くなることが示唆された。Tk-SPについても同様の試験を行った結果、分解が進行することが確認できている12)。この結果は、これらの酵素が特異的にプリオンタンパク質を分解しているためというよりも、変性条件下におかれたプリオンタンパク質の構造が変化して、そのプロテアーゼ感受性が増したためと考えられる。プリオンタンパク質は、変性剤や界面活性剤とともに高温に晒すことで、効果的にプロテアーゼ感受性を増すと考えられる。熱安定性が高く、変性剤や界面活性剤、そしてキレート剤に対して高い耐性のあるTk-SPにとって、プリオンタンパク質は格好のターゲットであるといえる。汚染体液等を効率的に除去するために必須のキレート剤存在下で分解を行うことができることから、Tk-SPは医療用特殊洗浄剤の有効成分として実用化に向けた研究が進められている。
6.おわりに
Tk-SPは優れた性質を持った酵素であるが、必ずしも扱いやすいタンパク質ではない。活性が強いために、宿主菌に対して毒性を示し菌体内大量調製が難しい。また、SDS-PAGEのサンプルバッファー中では自己分解してしまいゲルに流してもタンパク質のバンドが得られない、研究者泣かせの「消えるタンパク質」である。しかし、その分子構造をよく観察すると、活性を制御する方法、効率的に発現させる方法が見えてくる。超好熱菌由来の優れたプロテアーゼの能力を社会に活かすには、まだ、乗り越えなければならない課題があるが、これらの酵素は近い将来必ず実用化されると思われる。
文献
1) Voorhorst, W. G., Eggen, R. I., Geerling, A. C., Platteeuw, C., Siezen, R. J., Vos, W. M.: J. Biol. Chem., 271, 20426 (1996).
2) Fukui, T., Atomi, H., Kanai, T., Matsumi, R., Fujiwara, S., Imanaka, T.: Genome Res., 15, 352 (2005).
3) Pulido, M., Saito, K., Tanaka, S., Koga, Y., Morikawa, M., Takano, K., Kanaya, S.: Appl. Environ. Microbiol., 72, 4154 (2006).
4) Tanaka, S., Saito, K., Chon, H., Matsumura, H., Koga, Y., Takano, K., Kanaya, S.: J. Biol. Chem., 282, 8246 (2007).
5) Tanaka, S., Matsumura, H., Koga, Y., Takano, K., Kanaya, S.: J. Mol. Biol., 372, 1055 (2007).
6) Takeuchi, Y., Tanaka, S., Matsumura, H., Koga, Y., Takano, K., Kanaya, S.: Biochemistry, 48, 10637 (2009).
7) Uehara, R., Takeuchi, Y., Tanaka, S., Takano, K., Koga, Y., Kanaya, S.: Biochemistry, 51, 5369 (2012).
8) Foophow, T., Tanaka, S., Koga, Y., Takano, K., Kanaya, S.: Protein Eng. Des. Sel., 23, 347 (2010).
9) Sinsereekul, N., Foophow, T., Yamanouchi, M., Koga, Y., Takano, K., Kanaya, S.: FEBS J., 278, 1901 (2011).
10) Foophow, T., Tanaka, S., Angkawidjaja, C., Koga, Y., Takano, K., Kanaya, S.: J. Mol. Biol., 400, 865 (2010).
11) Koga, Y., Tanaka, S., Sakudo, A., Tobiume, M., Aranishi, M., Hirata, A., Takano, K., Ikuta, K., Kanaya, S.: Appl. Microbiol. Biotechnol., 98, 2113 (2014).
12) Hirata, A., Hori, Y., Koga, Y., Okada, J., Sakudo, A., Ikuta, K., Kanaya, S., Takano, K.: BMC Biotechnol., 13, 19 (2013).