【トピックス】
機能複合体としてのリグニン
-構成セグメントの逐次解放と持続的応用展開-
舩岡正光
三重大院・生資
1.はじめに
生態系では様々な生命システムが分子レベルでネットワークを形成し、絶妙の平衡のもとに持続的な流れが形成されている。光合成により地球上で普遍的に形成されるリグノセルロースは、生態系の基礎を形成する最重要ユニットである。経済性を最優先した取り組みや、可食か非可食かでその価値を判定する人間中心の安易な資源評価システムは、地球生態系を攪乱し、修復不可能な環境破壊を引き起こす可能性がある。
本稿では、リグノセルロース資源を “エネルギー”、“時間”、“機能” の3因子で動的に把握するとともに、リグニンを分子セグメント複合体として捉え、その資源特性、高分子特性、循環特性を逐次切り替え利用する新しいシステムについて紹介する。
2.樹木を構成するフェーズ
樹木は、炭素循環システムとして、エネルギー (E)、機能 (F)、時間 (T) の3因子で動的に表示することが出来る (図1):フェーズI (濃縮)、フェーズII (平衡)、フェーズIII (解放)。林業・木材工業は、最高濃縮レベルにある炭素集合体をその総体として活用する合理的なシステムであるが、そこには分子複合系という認識はなく、木材として活用後、そのほとんどが燃焼により短絡的に炭酸ガスへと転換されている。地球生態系を健全に維持するためには、その基盤構成要素であるリグノセルロースの循環を攪乱してはならず、そのためには現行社会ではほとんど認識されていないフェーズIIIを人間社会における物質とエネルギーの流れに再現することが必須となる。
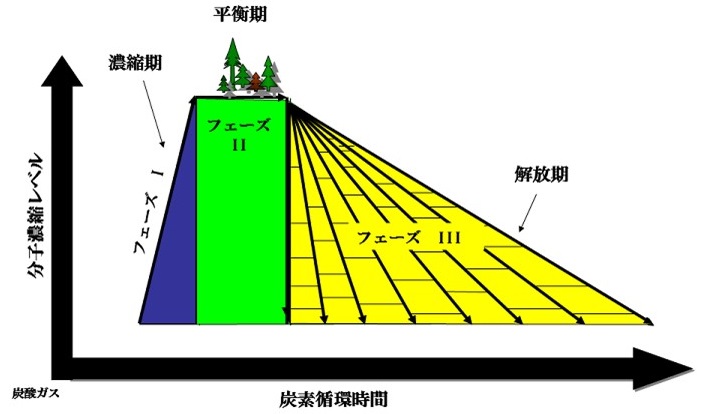
図1 炭素循環システム
3.樹木の分子規格
植物体は周辺の環境に最適化され、ストレスフリーなエネルギーミニマム型生命システムを構築している。植物体内には4つの環境因子が包含されている:①分子基本構造、②重合度、結晶化度、③配向、分布、④環境系2次変位。脂肪族系素材は、酵素制御のもとに規則的にその基本が成り立っており、包含される因子は②と③が主となる (生態系統一規格分子)。一方リグニンは、その高分子構造形成に酵素は関与せず、さらに、その構造は周辺の環境変化に応じて変動する。リグニンは生態系において個別環境に最適化されており、4環境因子全てを包含する生態系唯一の “環境規格素材” である。
分子規格が大きく異なるリグニンを炭水化物と同一のプラットホームで画一的に論議してはならず、この認識の欠如がリグニンの機能的活用を妨げる因子となっている。
4.分子構造への環境の取り込み
天然リグニンの基本構造は、以下のステップにより誘導される。
I 基本構成単位 (C6-C3,1st Segment) の誘導
①フェニルアラニンの脱窒素、②フェノール性水酸基の付加、③フェノール性水酸基のメチル化、④カルボキシル基の還元
II 1次高分子鎖 (2nd Segment) の形成 (図2、3)
⑤フェノール性水酸基の脱水素、⑥ラジカル共鳴混成体間のランダムカップリング
III 3次元ネットワーク構造 (3rd Segment) の形成 (図2、3)
⑦1次高分子鎖間の結合 (付加反応)
IV 高分子会合体 (4th Segment) の形成 (図3)

図2 リグニン高分子の形成

図3 リグニン構成分子セグメント
リグニンの高分子鎖形成に関与する1次 (⑤)、2次 (⑥)、3次 (⑦) 反応は、いずれもランダム系であるため、結果として形成される高分子リグニンは構造に規則性を有しない。
上記7段階で形成されるリグニンはその地上ステップでの機能体としての必要条件を有し、かつその下流側に必要な機能をも潜在的に包含している。樹木を背にし、炭酸ガスへ向かう資源フローの下流側に視点を置くとき、樹木中の天然リグニンは構造変換の出発点に位置する原料物質となる。分子レベルでの詳細な理解により現在の精密石油化学工業が誘導されたように、リグニンのポスト石油系素材レベルまでの機能的な長期活用には、天然リグニンに包含される構造を動的に理解し、それを分子セグメントレベルで個別に逐次活用し、最終的に石油と同列のプラットフォームで評価できる分子種へと転換する精密分子変換システムが必須となる。
5.樹木の精密リファイニング
-新素材を誘導する新しい仕掛け-
リグノセルロースをフェーズIIからフェーズIIIへとなめらかに移行させる一つのプロセスとして、リグニンと炭水化物の生合成ルートを逆にたどる分子複合系解放システム
(相分離系変換システム) を以下に紹介する。本システムは1988年に基本原理を考案し、その後 JST CREST研究 (1999~2004)、JST SORST研究 (2004~2009)、そして林野庁PJ (2000~)、農水省PJ (2010~)、環境省PJ (2011~) として発展させてきたプロセスである。
分子変換基礎設計を以下に示す。
リグニンの変換設計 (図4)
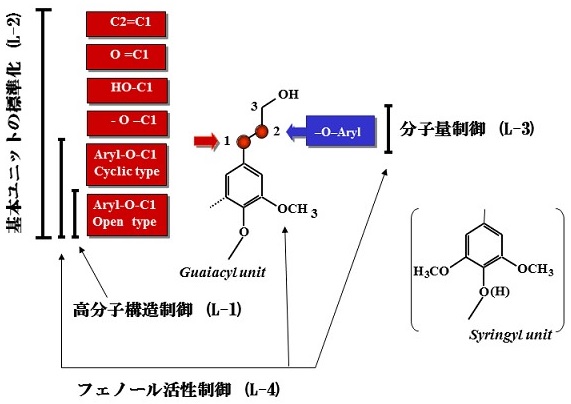
図4 リグニンの逐次機能制御
L-1 高次構造制御 (3D→リニア) (側鎖C1-アリールエーテル結合制御)
L-2 C9基本ユニット標準化 [1,1-ビス (アリール) プロパン型構造構築]
L-3 分子量制御 (C2-アリールエーテル制御)
L-4 フェノール活性制御 (アルキルアリールエーテルユニットの逐次解放)
炭水化物の変換設計
C-1 結晶領域膨潤によるセルロース分子鎖の解放
C-2 分子内グリコシド結合の加水分解制御
細胞壁内においてSemi-IPN構造を形成し高度に複合化されているリグニンおよび炭水化物のリファイニングには、リグノセルロース複合体に与える初期反応環境下で上記変換ステップのうち、L-1、L-2、C-1、C-2を同時に達成しなければならず、この選択的反応制御が精密リファイニング達成の鍵となる。筆者は、ジアリールメタン型構造ユニットの特異的脱アルキル化反応 (核交換反応) とそれを応用するリグニンの選択的解重合プロセス1-3)について長年研究を行ってきたが、その延長線上において、1988年、上記目的に対し、酸-フェノール系常温常圧相分離環境が非常に有効であることを見出した4-8) (図5)。“相分離系変換システム” と名付けた本システムのキーポイントは、疎水性リグニンと親水性炭水化物に個別の系 (機能環境媒体) を設定すると共に、両媒体の界面に両素材に共通の微視的な相溶化相 (反応場) を形成させ、この反応場へリグノセルロース複合体を短時間誘導し、リグニンはPhenolysis、炭水化物はHydrolysisにより選択的に変換・分離することにある (アクロバット反応制御システム)。
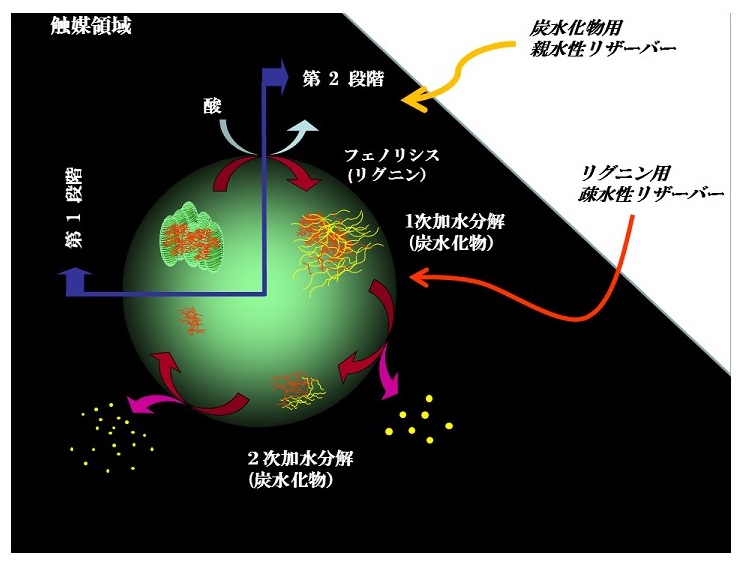
図5 相分離系変換システム
1st 制御:リグノセルロース系複合体 (粉体) を疎水性媒体 (フェノール誘導体)で溶媒和した後、過剰量の酸水溶液と接触させる。疎水性フェノールは水中で微粒子状に分散し、その表層には水相と有機相両相からなる微視的相溶化相 (反応場) が形成される。疎水性 (リグニン)、親水性 (炭水化物) 両素材からなるリグノセルロース (両親媒性) は反応場との親和性が高く、反応初期に速やかに反応場に移行し、短時間酸と接触する。炭水化物は膨潤、部分加水分解をうけ、一方リグニンのベンジルアリールエーテルが開裂、生成したカチオンにはフェノール誘導体が導入され、高度な細胞壁複合系がゆるみ始める。
2nd 制御:加水分解を受けた親水性炭水化物はフェノール相から水相へと抜け出すが、一方変換によって疎水性の高まったリグニンは反対に反応場からその中心部 (疎水相) へと移行し、結果として酸との接触による複雑な2次変性は可及的に抑制される。
3rd 制御:系の攪拌を停止すると、両相の比重差により反応系は機能変換リグニンを含む有機相 (上層) と炭水化物を溶解した水相 (下層) に分離する。
本反応系において、疎水性有機相は、リグニン変換試薬としてのみならずリザーバーとして機能し、一方、水相は炭水化物のリザーバーとして機能する。触媒 (酸) は水相側に包含させる。変換に重要な微視的反応場は、有機相の疎水性、酸の濃度、反応系の温度、反応時間で制御する。
相分離系変換処理により、リグノセルロース系複合体を構成する天然リグニンはほぼ定量的に1,1-ビス (アリール) プロパンユニットを高頻度で含むリニア型フェノール系リグニン素材 (2nd Segments誘導体) に変換される。白色粉末状で得られる本リグニン素材は、従来の工業リグニンやリグニン試料とはその構造と機能において一線を画しており、“リグノフェノール” という固有の名前を与えている (図6)。
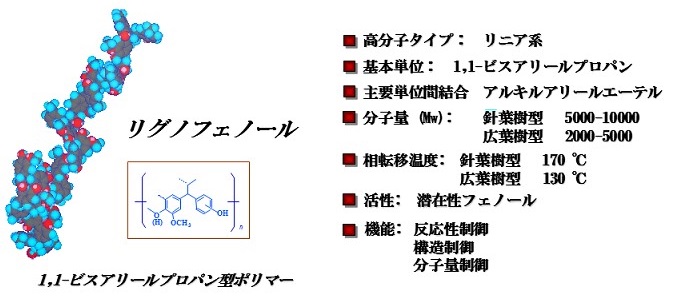
図6 リグノフェノールの分子特性
一方水相には、構成多糖が主として分子量2000以下の低分子画分および分子量10万以上の水溶性ポリマーとして分離され、時間と共に低分子体へと移行する9-11)。
上記変換・分離は、樹木系リグノセルロースで20~60分、草本系リグノセルロースで5~10分の相分離系常温処理で達成される。この迅速なリファイニングは、リグニン高分子鎖の解放による炭水化物に対するベルト効果の消失、炭水化物の膨潤・部分加水分解によるフレームワーク構造の解放、の両効果に基づく。
6.リグニンの構造制御と新しい展開
リグノフェノールにはその分子構造内にC1フェノール核をスイッチング素子とする循環機能が組み込まれている12-18)。スイッチング機能には、電子欠損した側鎖C2炭素に対するC1フェノール核OHの求核攻撃性を活用し、その開始はフェノール核の塩基性と運動性によって制御する (図7)。立体的に隣接炭素攻撃が可能なp-アルキル置換フェノールはいずれもスイッチング素子として機能する。この分子機能変換は、C1フェノール核とリグニン母体芳香核間のフェノール活性交換により発現し、結果として分子量は低下する一方、その全フェノール活性は一定に保たれる。制御分子量はスイッチング素子の分子内頻度と明確に相関しており、コントロール素子 (例えば2,6-ジメチルフェノール) を活用し、スイッチング素子の分子内分布を制御することによって、リグノフェノールの2次制御分子量を任意にコントロール可能である。
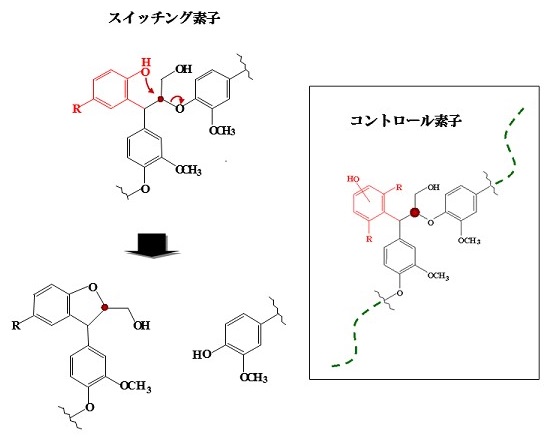
図7 リグノフェノールのスイッチング機能
芳香核上に活性ポイントを保持した反応性素子 (例えばC1導入p-クレゾール核) は、活性基付加・架橋により隣接分子との接合ユニットとして機能し、リグノフェノール分子は安定な3次元構造へと生長するが、一方活性ポイントを有しない安定素子 (例えばC1導入2,4-ジメチルフェノール核) を保持した素材では、リグニン分子末端でのみ活性基付加・架橋が生じ、リニア型へと生長する。両素材の混合率や両素子の同一分子内頻度を制御することにより、高分子の架橋密度とそのリサイクル特性を精密に制御することができ、様々な物性を有するリグニン系循環型機能材料を誘導することができる。
以下にリグノフェノールの応用例を示す8,19-21)。 相分離系変換時における触媒酸強度を制御することにより、長鎖セルロース構造を維持しつつ天然リグニンをリグノフェノールへと選択的に変換することが可能である。本素材[リグノフェノール-炭水化物 (LC) 複合体]はリグノフェノールの可塑化温度領域 (150℃~170℃) で総体として流動し、注型成形などによって任意の形状に成形可能である。水酸基のアシル化によって、流動温度の低下と高い流動性が発現し、緻密な連続層と高耐水性を有する成形体が得られる。アシル化LC複合体は総体としてクロロホルムなどに溶解、キャスト法にて透明フィルムへの応用も可能である。一方、一部ナノファイバー化した植物繊維を湿式成形後、リグノフェノール溶液に浸漬することにより、表層に高密度リグノフェノール添着層を有するリグノフェノール-セルロースファイバー複合体が誘導される。リグノフェノールの添着により、木材を超える物理的強度、耐水性および高い寸法安定性が発現する。高次構造を有しないセルロース微粉末も、リグノフェノール収着、加熱圧縮により、表面平滑性に富む木質素材様リグノフェノール-セルロースパウダー複合体が得られる。本複合体は、切削や研磨など二次加工が可能であり、リグノフェノールの高次構造制御により、その寸法安定性、物理的特性およびリサイクル特性を自在にコントロール可能である。
反応性素子を導入したリグノフェノールを金属微粒子と複合化すると、架橋構造の形成により素材粒子がより強固に拘束され、複合成形体は極めて高い撥水性を発現する。一方、多孔質ガラス系 (吸水材料) をフィラーとした場合には、吸水特性を保持しつつ寸法安定性に優れた複合成形体が得られる。
さらにアシル化、エステル化、ハイドロキシメチル化、ウレタン化、エポキシ化、カルボキシメチル化などにより、リグノフェノールをコアとする新規循環型機能性材料 (ウレタン、エポキシ系樹脂、フェノール系樹脂、塗料など) が誘導される。また、環境応答リグニン、草本系リグニンの分子部品としての応用、木質系廃棄物の分子分離と高度資源化、フェノール性水酸基を活用する酵素重合 (高分子素材)、フォトレジスト材料、親水基導入によるリグノフェノール系吸水ゲル開発やHIVウイルスプロテアーゼ阻害剤、構造可変機能の応用による吸着性能や電子伝達系の制御、バイオポリエステルP(3HB) の可塑化、紫外吸収能制御、細胞のアポトーシス抑制、高分子ネットワーク制御、炭素骨格を応用する吸着剤や電磁波遮断材料、高性能炭素分離膜の誘導、鉛蓄電池の負極性能制御剤開発、貴金属の回収、バイオリアクターシステムの設計、電子伝達系を応用するリグノフェノール増感光化学電池、導電性材料開発、などが報告されている。
7.使えるリグニンを創る
-脇役から主役への転換-
リグニンは構造の固定しない環境規格素材である。これを原料として石油製品に対抗できる工業製品を誘導するためには、製品化の前にまず “構造、機能が特定できる規格化リグニン素材”、そしてその機能を評価するための “分子規格評価指針” を創成しなければならない。
“リグノフェノール” は総称であり、その機能は目的に応じて任意に設定可能である (Tailor-made materials)。原料植物種、変換工程で使用する有機系機能環境媒体 (フェノール誘導体)、水系機能環境媒体 (酸)、変換工程操作条件、精製工程で使用する薬品、精製工程条件などを選択することにより、リグノフェノールの分子量、流動性、疎水性、親水性、安定性、循環性などを自在に制御可能であり、さらにその2次的環境制御により、リグニンの環境応答性を活用した精密な分子機能制御を行うことができる。リグノフェノール系素材に共通する基本分子規格は “Diarylmethane” である。
第1号 (2001年、JST CREST研究) および第2号 (2003年、農林水産省林野庁補助事業) システムプラントに引き続き、2008年 (第3号、和歌山、JST SORST研究)、2012年 (第4号、徳島、環境省PJ) には一部連続システムを組み込んだ新しいベンチプラントを建設し、フィールドでの実用化試験を進めている。変換分離特性は、実験室試験値と同様ほぼ定量的であり、さらに天然リグニンのリグノフェノールへの変換レベルを制御し、分子量とその機能を制御する仕組みも工程に組み込んでいる。第4号システムでは精製工程で使用する有機溶媒の回収再利用システム、硫酸回収システム、糖液の発酵システムも導入し、クローズドシステムを目指した設計となっている。素材の変換・分離は全て常温、常圧で達成され、さらに全工程を液相で進めるため、非常に低エネルギーかつ短時間にリグノセルロースの精密リファイニングが達成される。リグニン・炭水化物の同時活用を達成する世界初の工業化基礎モデルである。
8.生態系を受け入れる
現行のリグノセルロース分子利用プロセスは、高エネルギー処理を基本としている。環境変化に鋭敏なリグニンは、その過程で活性ポイントが消費され、結果として構造制御不可能な高変性体へと転換される。生態系は絶妙の生物平衡で成り立っており、生物素材を基盤とする脱石油型社会の構築には、生態系を攪乱することなく芳香族、脂肪族両素材を持続的に獲得するシステムの構築が必須であり、それにはリグニンの機能的な活用がキーとなる。
個別環境規格を有するリグニンは、その構造内に全ての地球環境に対応できる仕組みを包含しており、これはとりもなおさず、リグニンは我々が環境に対応し持続的な物作りをするために必要な分子設計とその原料そのものであることを意味する。 20世紀型のピンポイント的な資源評価とその利用システムから脱却し、生態系のシステムを肯定し、それを多段階に使い分ける新しい社会システムを早急に立ち上げなければならない。
文献
1) Funaoka, M., Abe, I.: Mokuzai Gakkaishi, 24, 256 (1978).
2) Funaoka, M.: Wood Sci. Technol., 21, 261 (1987).
3) Funaoka, M.: “Methods in Lignin Chemistry”, Springer-Verlag, Berlin Heidelberg (1992).
4) Funaoka, M.: Tappi J., 72, 145 (1989).
5) Funaoka, M.: Holzforschung, 50, 245 (1996).
6) Funaoka, M.: Polymer International, 47, 277 (1998).
7) Funaoka, M.: Macromol., Symp., 201, 213 (2003).
8) Funaoka, M.: Reactive & Functional Polym., 73, 396 (2013).
9) Mikame, K., Funaoka, M.: Polymer J., 38, 694 (2006).
10) Mikame, K., Funaoka, M.: Polymer J., 38, 585 (2006).
11) Mikame, K., Funaoka, M.: Polymer J., 38, 592 (2006).
12) Nagamatsu, Y., Funaoka, M.: Trans. Mater. Res. Soc. J., 26, 821 (2001).
13) 永松ゆきこ,舩岡正光: 繊維学会誌,57, 54 (2001).
14) 永松ゆきこ,舩岡正光: 繊維学会誌,57, 75 (2001).
15) 永松ゆきこ,舩岡正光: 繊維学会誌,57, 82 (2001).
16) 永松ゆきこ,舩岡正光: 日本接着学会誌,37, 479 (2001).
17) Nagamatsu, Y., Funaoka, M.: Green Chem., 5, 595 (2003).
18) Nagamatsu, Y., Funaoka, M.: Mater. Sci., Res., Int., 9, 108 (2003).
19) Aoyagi, M., Funaoka, M.: Trans. Mater. Res. Soc. Japan, 35, 967 (2010).
20) Aoyagi, M., Iwasaki, K., Funaoka, M.: Trans. Mater. Res. Soc. Japan, 32, 1119 (2007).
21) Aoyagi, M., Murai, K., Funaoka, M.: Kobunshi Ronbunshu, 70, 722 (2013).