【トピックス】
ナノの発想からの新しい酵素複合体設計:ハイブリッドナノセルロソーム
梅津光央、中澤 光
東北大院・工、東北大院・工
1.はじめに
量子力学の父であるエルヴィン・シュレーディンガーが1944年に「生命とは何か」を執筆し1)、物理的法則の延長上に生物を理解する分子生物学という学問が始まった。そして、1983年に蛋白質工学が提唱2)されて約30年が経つ現在では、大腸菌などの宿主細胞に目的遺伝子を導入することによって組換え蛋白質を大量産生することができるようになり、さらには、一次構造レベルではあるが、自分の好きなアミノ酸配列を持つ蛋白質を合成することも可能になった。また、X線結晶やNMRを用いた構造解析技術も進歩し、膨大な蛋白質の立体構造と機能がドメイン単位で解析され情報化されるようになった。その結果、蛋白質は、年間1万件程度のペースで構造と機能のデータが蓄積され続け、他の有機・無機材料と比較すると構造安定性は劣るものの、機能の多様性と特異性の面では他素材を凌駕する分子と認識されつつある。
しかし、その一方、蛋白質の産業利用が進むにつれて、生体外で利用する素材としては、高価で構造安定性が劣ることがしばしば問題となり、思ったよりも普及が進んでいない面もある。そこで我々は、必要最小限な機能を生み出す素材として蛋白質を利用し、その他の必要な構造形成要素は他の素材で代用するハイブリッド蛋白質の設計を行っている。本稿では、近年発展が目覚ましいナノ素材を骨格構造として利用することによって、固相基質分解酵素であるセルラーゼの機能を飛躍的に向上させた研究を紹介する。
2.酵素:セルラーゼ
非食物系バイオマスであるセルロースは、自然界に豊富に存在する炭素源であり、化石燃料と補完的に働く次世代の環境調和型エネルギー資源として注目されている。そのエネルギー化には、セルロースを糖化する工程が必要であるが、セルラーゼ等の糖化酵素を用いた酵素処理法は、室温・中性水溶液中で反応が可能な環境負荷の小さい糖化工程として研究されている。しかし、水に不溶なセルロースの分解反応は固―液不均一反応のため効率が非常に低く、実用化には飛躍的に高機能化したセルラーゼを発見・開発しなければならない。
我々が調べた限りでは、2012年現在で、PDB, CaZy, Pfamのデータベースに1017種のセルラーゼが報告されている。それらを構造的分類で分けると、1017種中の60%はセルロール中の β-1,4 グルコシド結合を加水分解する触媒ドメイン (CD) のみからなるが、33%はCDにセルロース表面に吸着できる結合ドメイン (CBD) が融合したモジュール型構造を形成しており、触媒ドメイン周辺の基質濃度を増加させることによって、効率的にセルロース分解を行っている (図1ab)。そして、残りの11%は、Rumen bacteriaに多くみられるが、CBDを持つ100 nm程度の巨大な骨格蛋白質に機能の異なった複数のCDが集積してセルロソームと呼ばれる巨大複合体を形成することにより、セルロース表面にCDを効率的に局在化させ共役的な分解反応を引き起こしている (図1c)3,4)。このように自然界では、モジュール型やセルロソーム型の構造的設計を行うことによって、水に不溶なセルロースを効率良く分解する工夫がなされており、60%の標準構造セルラーゼにモジュール型やセルロソーム型の構造を適用することによって酵素活性を向上させることが期待できる。しかし、それら構造は組換え蛋白質として調製が困難なことが多く、実用化レベルで調製することは難しい。そこで我々は、CDとCBDを独立に発現調製し、それらを生体外で積木細工的に再編成させることによって、組換え蛋白質の製造コストを増加させることなく複数のモジュールを持つクラスター化セルラーゼを設計することを提案している。
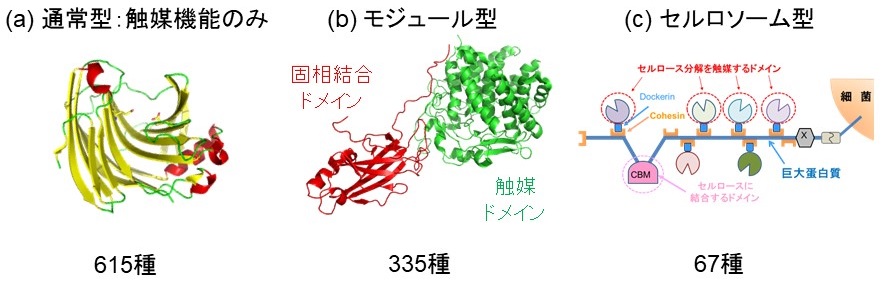
図1 報告されているセルラーゼの基本構造
3.ハイブリッドナノセルロソーム
蛋白質は、機能の多様性と特異性の面では他の有機分子・無機材料を凌駕する分子であるが、構造安定性や生産コストの面では課題が多い。その中で我々は、蛋白質のモジュールサイズが数 nmであることに着目し、蛋白質構造の中でモジュールの足場として利用されている領域を、有機・無機ナノ素材で代用したハイブリッド蛋白質の研究を行っている。セルラーゼに関しては、セルロソーム中にある触媒ドメインの足場となっている巨大蛋白質を無機ナノ素材で模倣し、そのナノ材を核としてCDとCBDを3次元的にヘテロクラスター化したハイブリッドナノセルロソームの開発を行っている。
現在研究を行っているハイブリッドナノセルロソームでは、CDとCBDを各々独立に調製し、ビオチン―アビジン相互作用を利用してナノ粒子表面にクラスター化させている (図2)。近年では、ビオチンリガーゼを用いることによって、特定アミノ酸配列中のリジン側鎖にのみビオチン分子を修飾することも可能になっており、CDとCBDの両C末端にビオチン化ペプチドを融合した組換え蛋白質を調製することによって、各々のドメインがストレプトアビジンもしくはストレプトアビジンを提示したナノ粒子を核として均一に配向したクラスターが形成される。
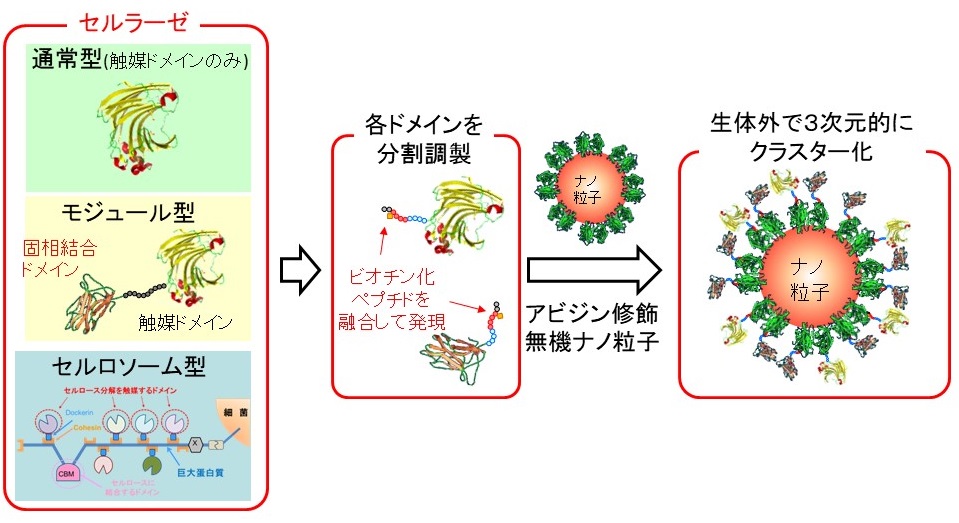
図2 ハイブリッドナノセルロソーム
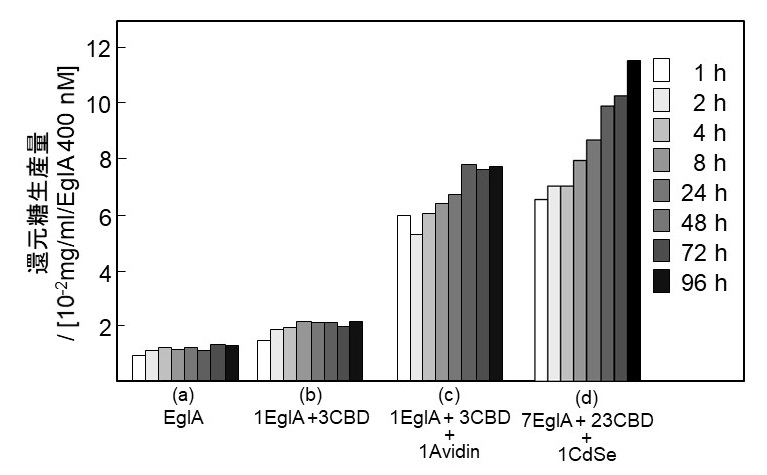
Aspergillus niger由来エンドグルカナーゼA (EglA) はCBDを持たないセルラーゼである5)。我々は、このEglAとCellulomonas fimi由来エンドグルカナーゼのCBD6,7)にビオチン化タグを融合した組換え蛋白質を大腸菌にて調製し、ストレプトアビジンと混合させてクラスター化させてナノセルロソームを形成させている8)。このナノセルロソームは、可溶性セルロースであるCMCに対してはほとんど糖化活性に変化を示さないが、リン酸膨潤セルロース (PSC) に対しては、クラスター中のCBD存在比が増加するにつれて酵素活性が向上し、クラスター中のCBD数が最大の時、遊離EglAと比較しEglA1分子換算で還元糖生産量が4.6倍に向上する (図3c)。この結果は、分子間相互作用を介してセルラーゼをクラスター化させた場合、CDだけでなくCBDもクラスター化させることによって、固相基質に対して飛躍的な活性向上を達成できる可能性を示している。さらに、ストレプトアビジンが表面に修飾されて30個のビオチン結合部位を持つセレン化カドニウム (CdSe) ナノ粒子 (粒子径20 nm) を核とした場合は、ストレプトアビジンを核とした場合と同様にナノセルロソーム中のCBD存在比がEglAの3倍になったとき、還元糖生産量は最大となり、還元糖生産量は9.6倍に向上する (図3d)。これは、ストレプトアビジンを核とした場合の1.6倍であり、クラスター規模の拡大は触媒ドメインの糖化活性を向上させることを示す。

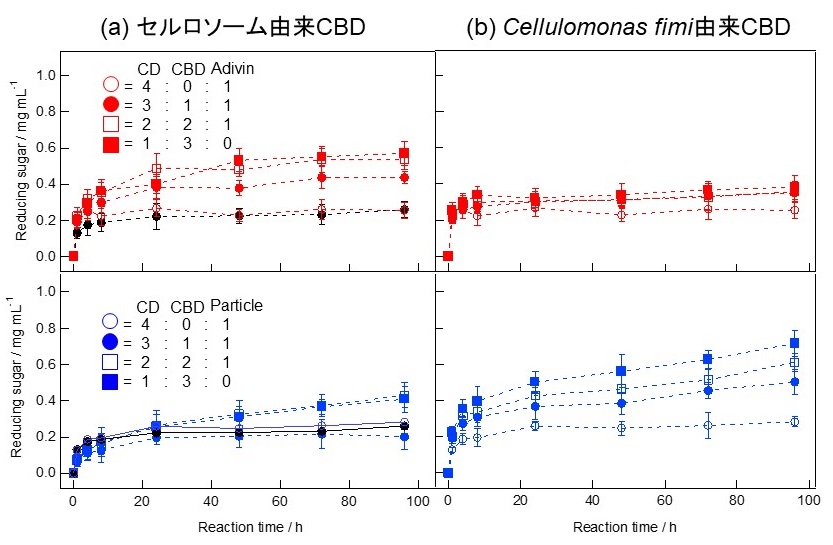
ここで、クラスター化による活性向上への3次元的なクラスター化設計の寄与を検証した結果を紹介する。Clostridium thermocellum由来のエンドグルカナーゼD (CelD)9)は、ドックリンを持つCDであり、ドックリンのコヘシンへの結合親和性によって、コヘシンを複数持つ巨大蛋白質へ集積しセルロソームを形成する。我々は、セルロソーム由来のCBDにコヘシンを融合した組換え体とCelDを相互作用させることによって直列連結型のCD-CBD複合体10)を作製し、我々のナノセルロソームと活性の比較を行った (図4a)。その結果、直列連結型の複合体ではPSCに対する酵素活性は2倍程度の増加にとどまり、CDとCBDの等量混合で作製したナノセルロソーム型を超えることはなかった11)。これより、CDとCBDの3次元的なクラスター化は直列連結型よりも活性向上を引き起こす構造フォーマットであると我々は考えている。しかし、このCelDのCDを使ったナノセルロソームはEglAの場合と異なり、ストレプトアビジンを核としたクラスターの方がナノ粒子を核としたものよりも酵素活性が向上していた。そこで、EglAの実験と同じCellulomonas fimi由来のCBDを用いてクラスター化したところ、CelDのCDの酵素活性は、EglAと同様にナノ粒子を核としたナノセルロソームで最も向上した (図4ab)。我々の3次元的クラスター設計は、用いるCBDによって構造フォーマットを検証する必要がある。

4.ハイブリッドナノセルロソームにおける共役効果の発現
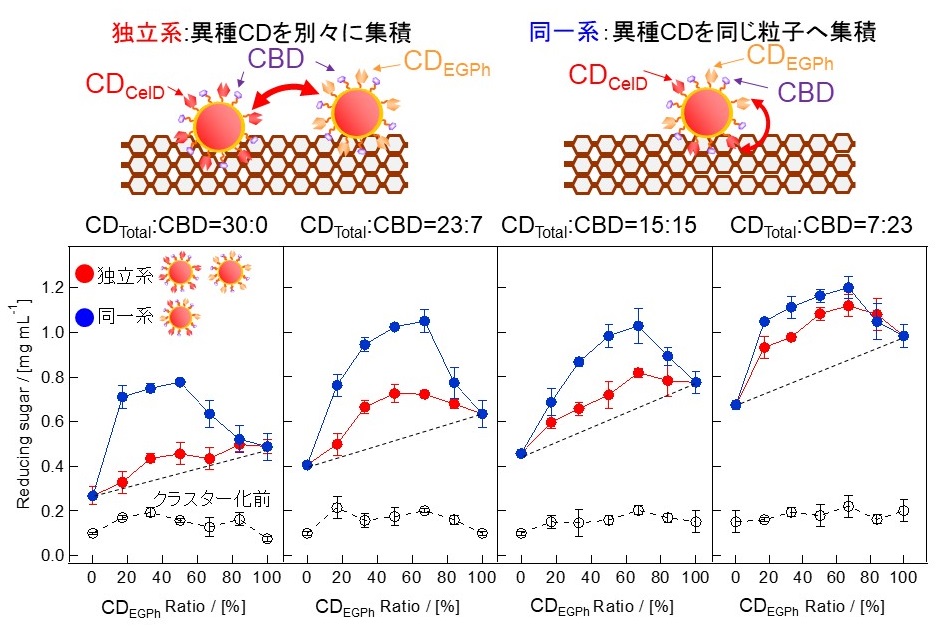
我々は、ナノセルロソームの構造フォーマットを利用して複数種のCDをクラスター化することによって、CDの共役効果を発現させることにも成功している12)。超好熱古細菌Pyrococcus horikoshii由来のエンドグルカナーゼEGPhはエンド型でありながらプロセッシブ機能を持つ酵素であり、CBDを持たない13,14)。我々は、CelDのCD (CDCelD) とEGPhのCD (CDEGPh) にビオチン化タグを融合した組換え体を別々なナノ粒子へクラスター化した後にナノ粒子を混合した場合と、同じナノ粒子上へ二つのCDを同時にクラスター化した場合でPSCに対する酵素活性を評価している(図5)。興味深いことに、両系ともCDの共役効果を示すが、その効果の発現にはCBDの存在比で大きく変化する。各々CDを独立にクラスター化した系では、CBDがない場合、CDEGPhをクラスター化した粒子の混合率の増加と共に還元糖生産量が直線的に増加するが、各クラスター中のCBDの存在比が増加していくと、全体として糖生産量が増加していくだけでなく、CDEGPhをクラスター化した粒子の混合比率が50%程度の条件で糖化が最も進んでいき、CD間の共役効果が発現してくる (図5中の青丸)。一方、同じ粒子上でCDCelDとCDEGPhをクラスター化した系では、CBDがない条件でも、CDEGPhの混合比率が50%程度で糖化が進む共役効果が発現されており、その効果はCBDとの混合比にほぼ依存しなかった (図5中の赤丸)。このように、我々のクラスター構造フォーマットは、各CDに対して別途ナノセルロソームを作製しても、同じ粒子上に異なったCD種を共存させても共役効果を発現し得るが、CBDによる共役効果の発現の違いは、CDが共役効果を発揮し得る距離情報を提供している。CBDを持たないナノセルロソームは、セルロースへの結合親和性は低いため、セルロース表面には低密度に吸着し、セルロース表面でのナノセルロソーム間の距離は大きい。そのため、各CDに対して別途ナノセルロソームを作製した系では、CDCelDとCDEGPhの距離間は大きく共役効果が発現されない。しかし、粒子中のCBD存在比が増加するにつれて、セルロース表面での粒子の吸着密度は増加しCDCelDとCDEGPhの距離間は小さくなり共役効果が発現される。この考察をもとに考えると、用いたナノ粒子のサイズが20 nmであることから、CD間の共役は数十 nm程度でも発現でき得ることを示している。

5.おわりに
組換え蛋白質技術は、変異導入やドメインスワッピングを可能にした一方、それらが持つ非天然性が構造の不安定化や発現量の低下を招き、実験室レベルの研究で終わってしまう例も多い。我々が進めている、モジュールを単位として発現調製し生体外で連結する手法は、天然が生み出した安定な3次元構造を活かした分子設計法であると考えている。また、近年のナノテクノロジーの発展により、様々な有機・無機材料がナノ化し、蛋白質のモジュールサイズと同程度のサイズを持つようになった。これら材料は、生産コストや構造安定性の面では蛋白質よりも利点を持つものが多い。高機能を利点とした蛋白質とコスト・安定性を利点としたナノ素材の利点構造同士をうまく融合することによって、ハイブリッド蛋白質という新規な分子フォーマットを提案できると我々は考えている。
今回は、セルラーゼの高機能化に利用した研究を紹介した。ハイブリッドナノセルロソームフォーマットの利点は、触媒ドメイン, 結合ドメイン, 骨格要素の組み合わせと混合比率を変化させるだけで、簡便に様々な人工セルロソームを作製できることにある。我々は現在、蛋白質データーベース中のセルラーゼ情報を「ライブラリー」として捉え、相同性の多様化, 基質特異性, 属性, 大腸菌発現実績を考慮して、有望なセルラーゼのモジュールライブラリーを作製し、それらを様々な比率でクラスター化させ活性を網羅的に評価することを行っている。今後、天然のセルロソームを超えるハイブリッドセルロソームの可能性を模索していきたい。
謝辞
本研究は、NEDO産業技術研究助成事業とJST戦略的創造研究推進事業先端的低炭素化技術開発の支援を受けて行った。
1) Schrödinger, E.: What is Life ?, Cambridge University Press, Cambridge (1944).
2) Ulmer, K. M.: Science, 219, 666 (1983).
3) Bayer, E. A., Belaich, J. P., Shoham, Y., R. Lamed, R.: Annu. Rev. Microbiol., 58, 512 (2004).
4) Gilbert, H. J.: Mol. Microbiol., 63, 568 (2007).
5) Khademi, S., Zhang, D., Swanson, S. M., Wartenberg, A., Witte, K., Meyer, E. F.: Acta Cryst., D58, 660 (2002).
6) Coutinho, J. B., Gilkes, N. R., Warren, R. A. J., Kilburn, D. G., Haynes, C. A.: Mol. Microbiol., 6, 1243 (1992).
7) Brun, E., Johnson, P. E., Creagh, A. L., Tomme, P., Webster, P., Haynes, C. A., McIntosh, L. P.: Biochemistry, 39, 2445 (2000).
8) Kim, D. M., Umetsu, M., Takai, K., Matsuyama, T., Ishida, N., Takahashi, H., Asano, R., Kumagai, I.: Small, 7, 656 (2011).
9) Joliff, G., Béguin, P., Aubert, J. P.: Nucleic Acids Res., 14, 8605 (1986).
10) Carrard, G., Koivula, A., Söderlund, H., Beguin, P.: Proc. Natl. Acad. Sci. U. S. A., 97, 10342 (2000).
11) Kim, D. M., Nakazawa, H., Umetsu, M., Matsuyama, T., Ishida, N., Takahashi, H., Asano, R., Kumagai, I.: Catal. Sci. Technol., 2, 499 (2012).
12) Nakazawa, H., Kim, D. M., Matsuyama, T., Ishida, N., Ikeuchi, A., Kumagai, I., Umetsu, M.: ACS Catal., 3, 1342 (2013).
13) Kim, H. W., Ishikawa, K.: Proteins, 78, 496 (2010).
14) Kado, Y., Inoue, T., Ishikawa, K.: Acta Crystallogr. Sect. F, 67, 1473 (2011).