【トピックス】
ヘテロ三量体タンパク質に集積して得られる自己充足型シトクロムP450
平川秀彦、長棟輝行
東大院・工、東大院・工
1.はじめに
シトクロムP450 (P450) はヘム含有一酸素原子添加酵素であり、常温・大気圧下で酸素分子を利用して立体選択的・位置選択的な水酸化、エポキシ化、脱ハロゲン化などの酸化反応を触媒する。生体内ではステロイド、脂肪酸、テルペノイド、フラボノイドなどの二次代謝産物の生合成や異物代謝などに関与しており、様々な酸化反応を触媒するP450種が報告されている。そのため、P450はキラル化合物や薬物代謝産物などの合成用触媒としての利用が期待されている。P450の触媒サイクルは外部からの電子供給 (伝達) を必要とし、in vitroでP450を利用するためには効率の良い電子供給システムの確立が重要となる。本稿では、筆者らが取り組んだタンパク質の複合体形成を利用したP450への電子伝達システムについて紹介したい。
2.動的なタンパク質間相互作用を必要とする電子伝達システム
P450ではヘム鉄の第五配位座にシステイン残基が配位しており、基質非存在下では第六配位座に水分子が配位した低スピン状態をとる。基質が結合すると水分子が離脱し、五配位型の高スピン状態に変化する。この高スピン状態に変化するとヘム鉄の一電子還元が可能となり、還元されたヘム鉄の第六配位座に酸素分子が配位することによりオキシ体となる。オキシ体がさらに一電子還元されると、いくつかの中間体を経てcompound I (オキソ鉄 (IV) ポルフィリンπ-カチオンラジカル) と呼ばれる活性種が生成し、一原子酸素添加反応が進行する (図1A)1)。このP450への逐次的な電子供給は電子伝達タンパク質 (ドメイン) を介して行われ、その電子の供給系によりP450はおおまかにクラス分けされている (表1)。また、真核生物由来P450が膜結合性であるのに対して、細菌・古細菌由来P450は水溶性であるという違いもある。
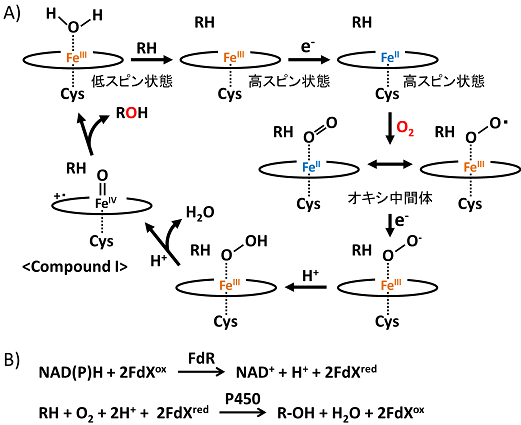
図1 P450の触媒サイクル (A) とFdRとの共役反応スキーム (B)
表1

細菌由来P450の多くはクラスIに属し、補酵素NAD(P)Hとフェレドキシン還元酵素 (FdR) によって還元されたフェレドキシン (FdX) からの電子伝達により触媒活性を発揮する。すなわち、細菌由来P450の一酸素原子添加反応はFdRによるFdXの還元反応と共役する。FdXのP450との結合部位とFdRとの結合部位は重複しているため、FdR-FdX-P450三者複合体の中で電子がFdRからP450へと伝達されるのではなく、FdRとの一時的な複合体の形成中にFdXの鉄-硫黄クラスターへ電子が伝達され、解離したFdXがP450と結合した後に鉄-硫黄クラスターからヘム鉄へと電子が伝達される。FdXは一電子還元されるため、P450の一反応サイクル当たりFdR及びP450と二回ずつ相互作用する必要がある。このようにFdXはFdR−P450間で電子を運ぶために往復するシャトル分子として機能する。
3.P450に電子供給システムを導入する試み
化学量論的にはFdR、FdX、P450が1:2:1のモル比で反応系に含まれていれば反応は十分に進行するはずである (図1B)。実際には、FdXとの親和性がP450への電子供給速度に大きな影響を及ぼすため、P450が触媒活性を発揮するためには少なくとも数µM以上のFdXが必要である。FdXを触媒の構成成分として見た場合に数µM以上という濃度は決して低くはなく、補酵素及びFdRが必要なことも加わって、P450は利用しにくい酵素となっている。
そこで、P450をFdR及びFdXと融合し、P450に対するFdX及びFdRの局所濃度を上げることにより、単独で機能する自己充足型P450の開発が試みられてきた2)。Ortiz de MontellanoのグループはPseudomonas putidaのD-カンファー水酸化反応系を構成するP450 (P450cam)、プチダレドキシン (PdX)、プチダレドキシン還元酵素 (PdR) をタンデムに遺伝子上で連結した融合タンパク質を報告している (図2A)3)。筆者らはStreptomyces mobaraensis由来トランスグルタミナーゼによるグルタミン側鎖−リジン側鎖間の架橋化反応を利用し、P450cam、PdX、PdRから成る分岐型融合タンパク質を報告している (図2B)4)。トランスグルタミナーゼの基質認識能が高くはないため、筆者らの方法は汎用性の高い方法ではなかったが、この分岐型融合P450camはタンデム型融合P450camと比べて10倍以上高い触媒活性を有していた。これは、i) ヘムなどの補因子を含むタンパク質を3つ以上遺伝子的に融合した場合、完全なホロ体を得るのが難しい、ii) 融合タンパク質において末端以外のタンパク質の可動域は大きく制限される、といったタンデム融合タンパク質の短所が分岐型融合P450camにはなかったためと考えられる。筆者らは以上の結果・考察に基づき、各タンパク質が一本のペプチドリンカーを介して選択的かつ非共有結合的に集積できれば、高活性な自己充足型P450を簡便に得られる、という発想に至った。
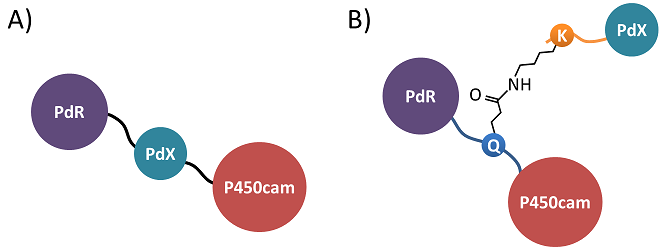
図2 タンデム型融合P450cam (A) と分岐型融合P450cam (B)
4.Sulfolobus solfataricus由来核内増殖抗原 (PCNA)
筆者らは、ヘテロオリゴマータンパク質を構成するサブユニットをP450、FdX、FdRと融合することにより、ヘテロオリゴマータンパク質を足場としてP450、FdX、FdRが集積した酵素複合体を構築することを目指した。そこで、次の条件を満たすヘテロオリゴマータンパク質を探した:i) 複合体のイメージをつかむために、結晶構造が解かれている、ii) 反応系に影響を与えるのを避けるために、触媒活性のあるタンパク質 (酵素) ではない、iii) サブユニット単独での発現が可能である。その結果、クレン古細菌Sulfolobus solfataricus由来の核内増殖抗原 (PCNA) が最有力候補として見つかった。
名前が示すようにPCNAは真核生物の核内に存在するリング状のホモ三量体タンパク質であり、リングの穴にDNAを通し、滑る留め金 (DNAスライディングクランプ) としてDNAポリメラーゼなどをDNA上に安定に保持する役割を担う5)。原核生物はホモ二量体タンパク質であるβクランプをDNAスライディングクランプとして有する。古細菌は核を持たないものの、細菌よりも真核生物に近縁であるためか、PCNAをDNAスライディングクランプとして有する。真核生物及び多くの古細菌が有するPCNAはホモ三量体タンパク質であるが、クレン古細菌の一部は三つのPCNA遺伝子を有しており、S. solfataricus由来PCNA (SsPCNA) は三つの異なるサブユニット (SsPCNA1、SsPCNA2、SsPCNA3) からなるヘテロ三量体タンパク質である。SsPCNAの各サブユニットの一次配列はサブユニット間で20%程度しか保存されていないものの、立体構造は良く似ており、三量体は他のホモ三量体PCNAと同様に対称性の高い立体構造をとる6)。SsPCNAは1) 各サブユニットが単独では単量体として存在する、2) 段階的にヘテロ三量体を形成する (SsPCNA1とSsPCNA2がまず安定なヘテロ二量体を形成し、そのヘテロ二量体に対してのみSsPCNA3が結合する (図3))、というユニークな特徴を有する7)。1) の特徴により、SsPCNAサブユニットとの融合タンパク質は単独で水溶性タンパク質として発現させることが可能であり、2) の特徴により、各サブユニットを等モル濃度で混合することにより三量体のみを形成させることができる。
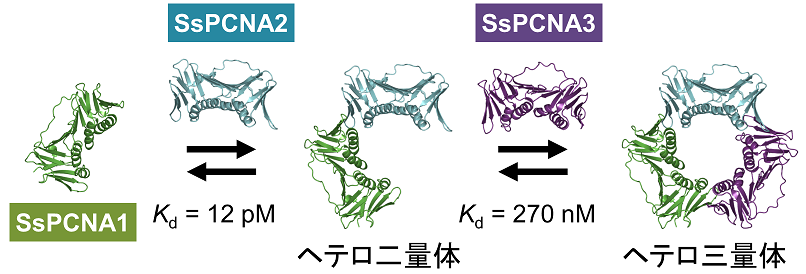
図3 段階的なSsPCNAのヘテロ三量化
5.S. solfataricus由来PCNAを利用した酵素複合体の形成
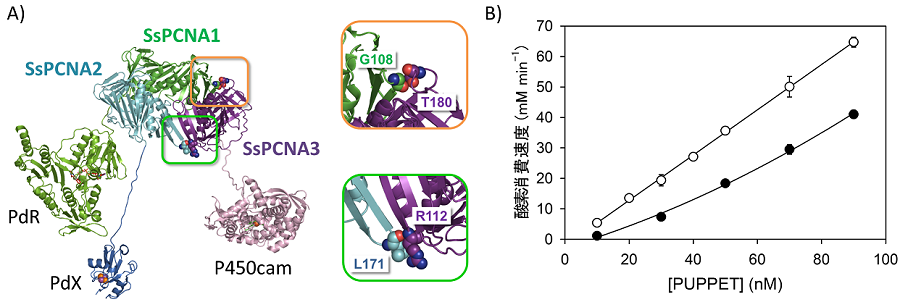
SsPCNAを利用した自己充足型P450の構築が可能であることを示すために、SsPCNAサブユニットのC末端とPdR、PdX、P450camのN末端を遺伝子的に連結した融合タンパク質SsPCNA1-PdR、SsPCNA2-PdX、SsPCNA3-P450camを構築した (図4A)。各融合タンパク質は水溶性タンパク質として個別に発現させることが可能であった。ところで、PCNAはDNAと結合して機能を発揮するタンパク質であるが、SsPCNAは酸性タンパク質 (等電点の計算値:4.3〜5.28)) であり、各融合タンパク質が陰イオン交換クロマトグラフィーで容易に精製できたのは研究を進める上では大きな利点であった。
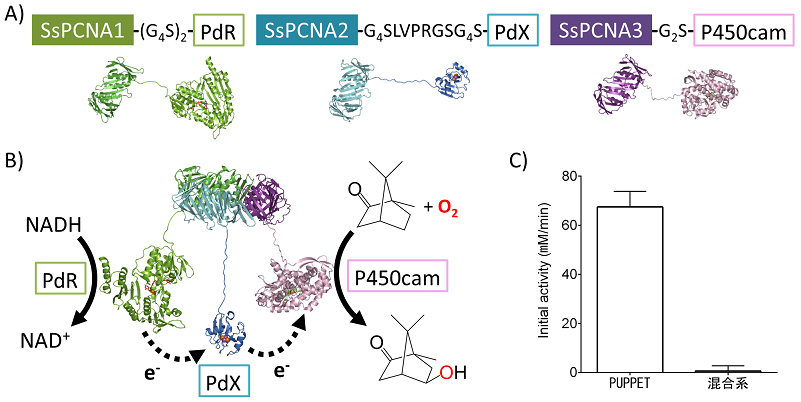

各融合タンパク質は単独でそれぞれPdR、PdX、P450camの機能を完全に保持しており、SsPCNAサブユニットとの融合は酵素・タンパク質の機能に影響を与えなかった。SsPCNA1-PdR、SsPCNA2-PdX、SsPCNA3-P450camを等モル濃度で混合した後、サイズ排除クロマトグラフィーを行うと、高分子量側にシングルピークが現れた。UV-visスペクトル測定により、そのピークはPdR、PdX、P450camを等モル比で含むことが分かった。すなわち、SsPCNAサブユニットを連結ユニットとして利用することによりPdR、PdX、P450camを一分子ずつ含む複合体 (図4B) を構築することができた。筆者らはこの複合体をPUPPET (PCNA-utilized protein complex of P450 and its electron transfer-related proteins) と名付けた。PdRによるPdXの還元、還元型PdXからP450camへの電子伝達がPUPPET内で行われるため、PUPPETは同じ濃度のPdR、PdX、P450camの混合溶液と比べて約50倍高い一酸素原子添加活性を示した (図4C)9)。
6.ジスルフィド結合の導入によるPCNAヘテロ三量体の安定化
PUPPETには三つの融合タンパク質を等モル濃度で混合するだけで得られるという利点がある一方、低濃度では解離により見かけの比活性が低下するという問題があった。そこで、SsPCNAはシステイン残基を含まないという特徴を生かし、各サブユニット間のインターフェース近傍のアミノ酸残基をシステイン残基に置換することによりサブユニット間にのみジスルフィド結合を導入し、解離を防ぐことを試みた10)。Protein Data BankからBhattacharyyaらが抽出した131のジスルフィド結合11)におけるα炭素間の距離を調べたところ、その80%以上は5 Åから6 Åの範囲にあった。SsPCNAヘテロ三量体の結晶構造を調べたところ、Pro186(SsPCNA1)−Glu105(SsPCNA2) 間、Leu171(SsPCNA2)−Arg112(SsPCNA3) 間、Thr180(SsPCNA3)−Gly108(SsPCNA1) 間がこの範囲にあったため、これらのアミノ酸残基をシステイン残基に置換した。これらのシステイン置換はSsPCNAのヘテロ三量化能には影響を与えなかった。また、意図したシステイン残基間でのジスルフィド結合の形成は酸化型グルタチオン存在下で促進された。SsPCNAヘテロ三量体の解離における第一段階はPCNA3の解離であるため、L171C(SsPCNA2)−R112C(SsPCNA3) 間あるいはT180C(SsPCNA3)−G108C(SsPCNA1) 間のどちらか一方でもジスルフィド結合が形成すれば良い、言い換えれば、SsPCNA3に全くジスルフィド結合が導入されていない状況を避けさえすれば良い。そこで、SsPCNA1にG108C変異、SsPCNA2にL171C変異、SsPCNA3にR112C/T180C変異を導入したものを利用することとした (図5A)。PCNA1G108C-PdR 、PCNA2L171C-PdX、PCNA3R112C/T180C-P450camから成るPUPPETはSsPCNAサブユニット間で選択的なジスルフィド結合を形成した。その結果、濃度依存的な見かけの比活性の低下を防ぐことに成功した (図5B)。

7.ペプチドリンカーの最適化
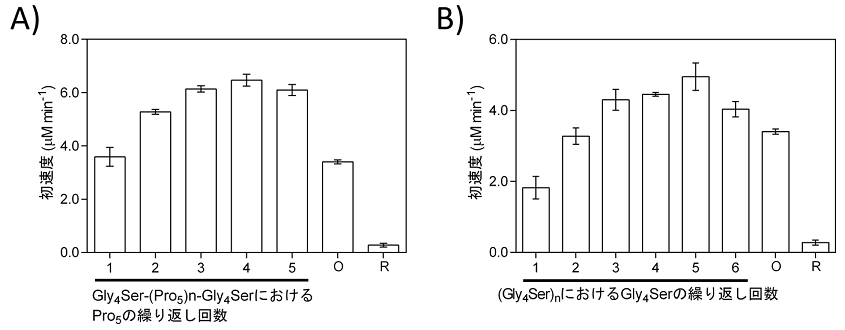
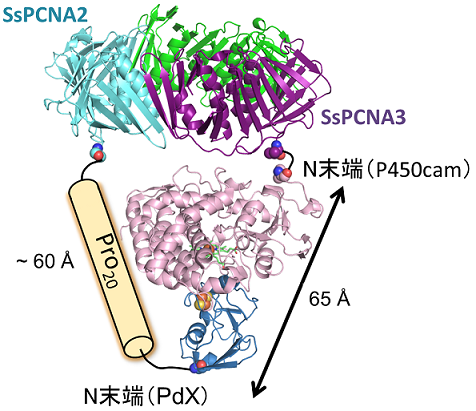
PUPPETではSsPCNA上に集積したP450cam、PdX、PdRが動的に相互作用するため、SsPCNAとそれらを連結しているペプチドリンカーはそれぞれの相互作用や全体の触媒活性に影響を与えるのではないかという当然の疑問があった。そこで、PdXはP450camとPdRの両方と相互作用することから、SsPCNA2とPdXを連結するペプチドリンカーの影響を調べることとした12)。ペプチドリンカーとしては、融合タンパク質の構築によく用いられる柔軟な(Gly4Ser)nリンカー (n=1-6) と末端間距離の制御が可能なPron配列を含むGly4Ser(Pro5)nGly4Serリンカー (n=1-5) を用いた。還元型PdXはシトクロムcを還元できるという性質を利用し、PdRによるPdXの還元反応を評価したところ、PCNA2-PdX間のペプチドリンカーはPdX還元速度に大きな影響を与えないことが分かった。一方、PUPPETの一酸素原子添加活性はリンカーの種類・長さに大きく影響を受けた (図6)。どちらのリンカーを用いた場合でも、リンカーが長くなるにつれ活性が上昇する傾向にあった。Gly4Ser(Pro5)nGly4SerリンカーではGly4Ser(Pro5)4Gly4Serリンカー、(Gly4Ser)nリンカーでは(Gly4Ser)5リンカーが最適なリンカーであることが分かった。興味深いことに(Gly4Ser)5リンカーを有するPUPPETの活性はGly4Ser(Pro5)2Gly4Serリンカーを有するPUPPETの活性にさえ及ばなかった。Pron配列では一残基当たり3 Åほど末端間の距離が伸びるのに対して13)、Gly-Serリッチな柔軟なペプチドリンカーでは30アミノ酸残基長くなっても末端間の距離は6 Åほどしか伸びない14)。このペプチドリンカーの末端間距離の違い、すなわち、PdXのSsPCNAに対する空間配置の違いがPUPPETにおけるPdXからP450camへの電子伝達に影響を与えたものと考えられる。PdXとP450camのドッキングモデル15)における両者のN末端間の距離は約65 Åである。P450camのN末端がヘムの遠位側にあり、PdXとの結合部位が近位側にあることを考えれば、PUPPETにおいてPdXのC末端がSsPCNAから60 Å程度離れることによりPdXがP450camと相互作用しやすい空間に配置されたと推測される (図7)。

![]()
8.亜リン酸の還元力を利用するP450
P450による一酸素原子添加反応に必要な電子 (還元力) が高価な補酵素NAD(P)Hに由来している点はP450を利用するためのボトルネックとなっている。そこで、安価な化合物の還元力を利用するために、亜リン酸からリン酸への酸化反応に伴いNAD+をNADHに還元する亜リン酸脱水素酵素 (PTDH) をPUPPETに組み込んだ16)(図8)。PTDHはリン酸による阻害を受けないという優れた性質を有している上に、亜リン酸の酸化によって生じるリン酸は反応系に悪影響を与えないという利点もある。PCNA2-PdXのN末端にPTDHを融合したPTDHPCNA2-PdX融合タンパク質を構築し、PCNA1-PdR及びPCNA3-P450camと複合体形成させることによりPUPPETにPTDHを組み込んだ。実際に、このPUPPETは20µM NAD+存在下で1 mMのD-カンファーを亜リン酸によって水酸化することができた。
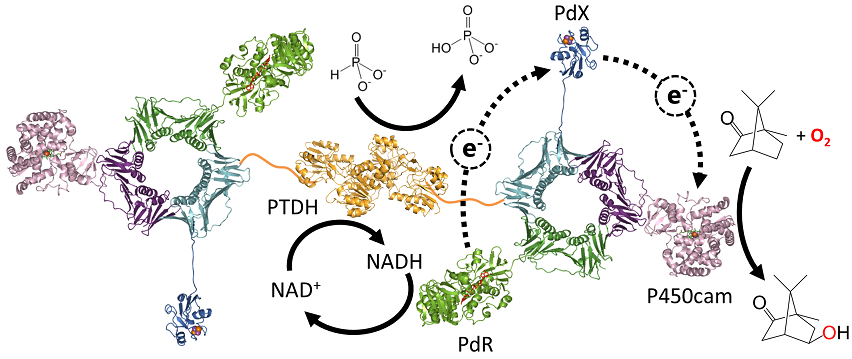
図8 亜リン酸の還元力を利用するためにPTDHを組み込んだPUPPET
9.おわりに
生体内で働く酵素の多くは逐次反応や共役反応などの多酵素反応系を構成している。本稿で紹介したように本来は複合体を形成せずに多酵素反応系を構成している酵素を人工的に複合体形成させることにより効率の高い反応が期待できる。S. solfataricus由来PCNAサブユニットが酵素複合体の連結ユニットとして利用できたのは二カ所の独立なタンパク質結合部位を有するためである。S. solfataricus由来PCNA以外にも複数の独立したタンパク質結合部位を有するタンパク質を連結ユニットとして利用することができるようになれば、ブロックを組み立てるかのように自在に酵素複合体を構築することが可能となるであろう。天然に存在する多酵素反応の再構成だけでなく、由来の異なる (発現条件が異なる) 酵素を組み合わせた人工的な多酵素反応系を構築することにより、多酵素反応を使いこなせるようになることを期待したい。
謝辞
本稿で紹介した研究は科研費 (21760633) 及びノボザイムズ ジャパン研究ファンドの助成を受けて行いました。研究を進めるにあたり、垣谷彩乃さん、芳賀智亮さん、渡辺浩志さんの尽力に感謝申し上げます。
文献
1) Ortiz de Montellano, P. R., Ed.: Cytochrome P450, Springer US, Boston, MA, 3rd edn. (2005).
2) Munro, A. W., Girvan, H. M., Mason, A. E., Dunford, A. J., McLean, K. J.: Trends Biochem. Sci., 38, 140 (2013).
3) Sibbesen, O., De Voss, J. J., Ortiz de Montellano, P. R.: J. Biol. Chem., 271, 22462 (1996).
4) Hirakawa, H., Kamiya, N., Tanaka, T., Nagamune, T.: Protein Eng. Des. Sel., 20, 453 (2007).
5) Moldovan, G.-L., Pfander, B., Jentsch, S.: Cell, 129, 665 (2007).
6) Hlinkova, V., Xing, G., Bauer, J., Shin, Y. J., Dionne, I., Rajashankar, K. R., Bell, S. D., Ling, H.: Acta Crystallogr. D. Biol. Crystallogr., 64, 941 (2008).
7) Dionne, I., Nookala, R. K., Jackson, S. P., Doherty, A. J., Bell, S. D.: Mol. Cell, 11, 275 (2003).
8) Xing, G., Hlinkova, V., Ling, H.: Cryst. Growth Des., 7, 2202 (2007).
9) Hirakawa, H., Nagamune, T.: Chembiochem, 11, 1517 (2010).
10) Hirakawa, H., Kakitani, A., Nagamune, T.: Biotechnol. Bioeng., 110, 1858 (2013).
11) Bhattacharyya, R., Pal, D., Chakrabarti, P.: Protein Eng. Des. Sel., 17, 795 (2004).
12) Haga, T., Hirakawa, H., Nagamune, T.: PLoS One, 8, e75114 (2013).
13) Stryer, L., Haugland, R. P.: Proc. Natl. Acad. Sci. USA, 58, 719 (1967).
14) Evers, T. H., van Dongen, E. M. W. M., Faesen, A. C., Meijer, E. W., Merkx, M.: Biochemistry, 45, 13183 (2006).
15) Kuznetsov, V. Y., Poulos, T. L., Sevrioukova, I. F.: Biochemistry, 45, 11934 (2006).
16) Watanabe, H., Hirakawa, H., Nagamune, T.: ChemCatChem, 5, 3835 (2013).