【トピックス】
植物フラボノイドグリコシルトランスフェラーゼ:分子系統学と特異性発現機構
中山 亨、小埜栄一郎、堀川 学
東北大院・工、サントリー・植物科学研、サントリー生科財団
1.はじめに
フラボノイドは、植物が生産するC6-C3-C6という基本構造をもつ二次代謝化合物群で、C3部分の構造の違いに基づいて10種類の主なカテゴリーが知られている (図1の化合物1-5はそのうちの5種類の構造である)。花や果実の多彩な色は、多くの場合、フラボノイドに由来する。フラボノイドは植物と昆虫あるいは植物と微生物の間の相互作用にさまざまなかたちで影響を与え、植物の生存・生殖戦略において重要な役割を果たしている1)。フラボノイドはまた、これを摂取したヒトに対してもさまざまな生理作用を発揮し、植物由来の食品のもつ三次機能 (生体調節機能) の一翼を担う。フラボノイドのこうした機能は産業的にも古くから注目を浴び、食用色素や機能性食品の有効成分としてその利用が検討されてきた1)。
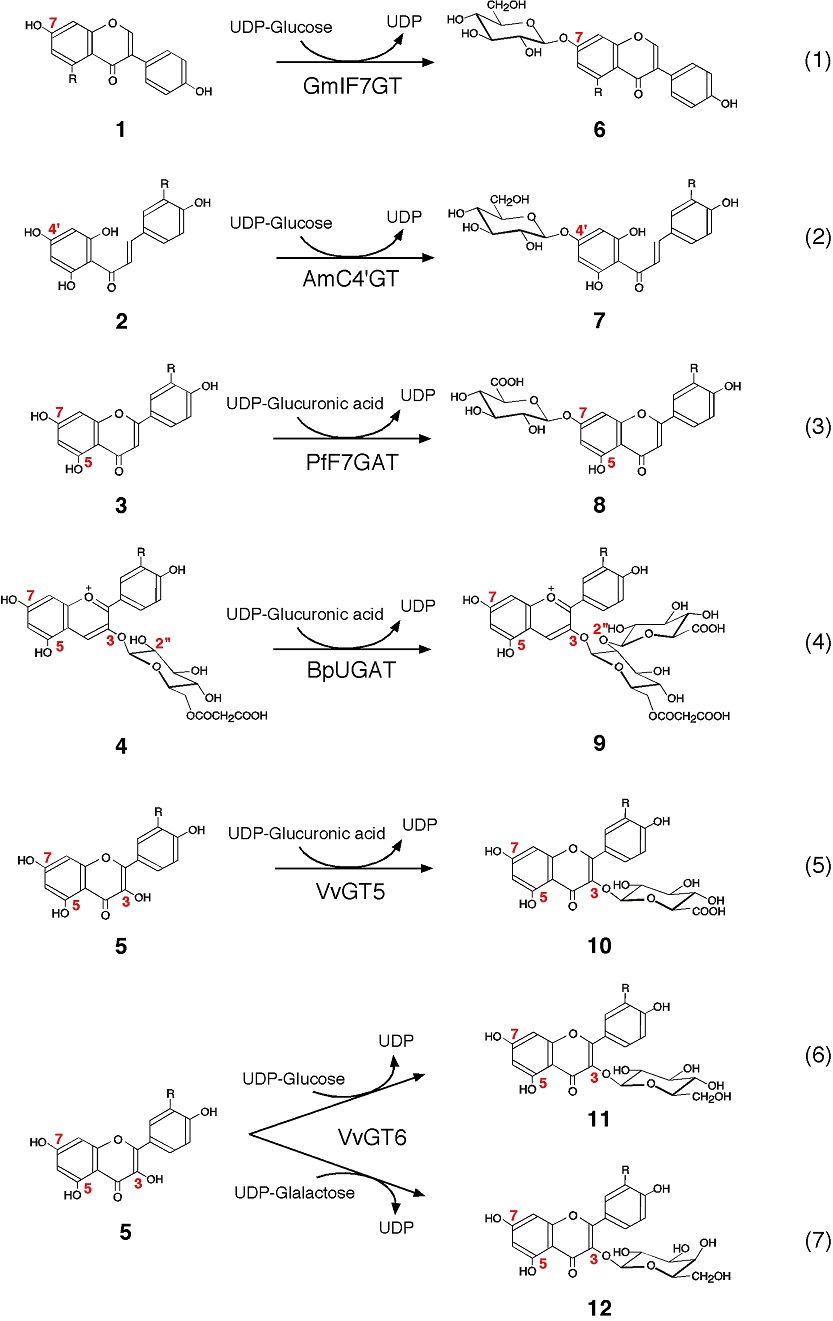
ほとんどのフラボノイドは複数のヒドロキシ基をもち、そこにグルコース、ガラクトース、ラムノース、グルクロン酸などを結合する配糖体として存在する (例図1の6-12)。糖部分にさらに脂肪族もしくは芳香族アシル基を結合するものも多い。このためフラボノイドの構造は多様性に富み、その種類は7000を優に超えると見積もられており1)、こうした構造的多様性はこの化合物群の生理活性の多様性にも密接に関係する。フラボノイドのグリコシル化は、植物体内では多くの場合、糖ヌクレオチド依存性のグリコシルトランスフェラーゼ (GT) によって達成される。グリコシル化はフラボノイドの構造的多様性の足場を提供するとともに、この化合物群の水溶性、安定性、呈味性、吸収性、生理活性の種類と強弱、体内動態等に影響を与える。したがって、フラボノイドのグリコシル化とその特異性は、この化合物群の産業的利用を考える上でもきわめて重要な要素となる。本トピックスではフラボノイドに特異的に作用する植物のGT群 (flavonoid glycosyltransferases, FGT) に焦点を当て、その分子系統学と特異性発現に関する研究の最近の進歩について紹介する。
2.FGTの特異性と酵素の分子系統関係
植物には、フラボノイドを含めた二次代謝産物や外来異物のグリコシル化を司るGT群が存在し、それらはPSPG (plant secondary product glycosyltransferases) と総称されている。PSPGは例外なく、その配列中にPSPGボックスと呼ばれる高度保存配列をもち、CAZyデータベース (http://www.cazy.org/) においてGTファミリー1に帰属される2,3)。一般に植物のゲノム中にはおびただしいPSPGがコードされ、その数はシロイヌナズナでは100以上、ブドウでは200以上にもおよぶ。本トピックスで取り上げるFGTは、PSPGのなかでもフラボノイドに特に高い特異性をもつ酵素群である。
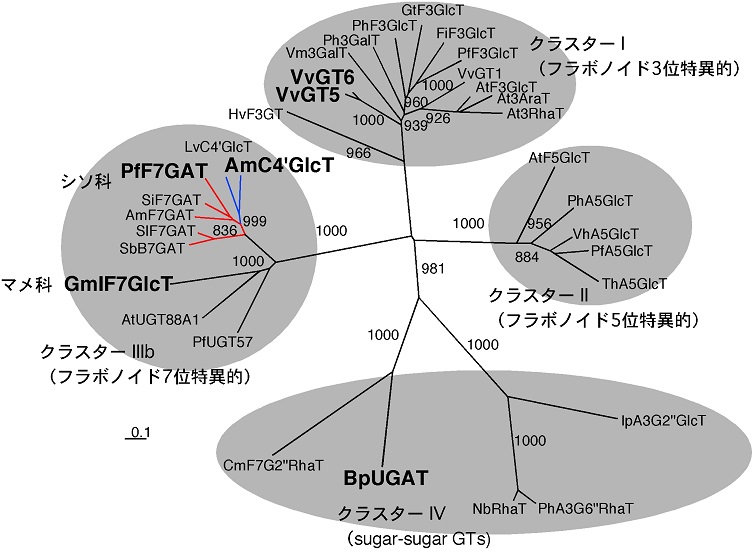
FGTの特異性は、冒頭で述べた10種類のフラボノイドのどれに好んで作用するのか (糖受容体特異性)、フラボノイドのどのヒドロキシ基をグリコシル化するのか (位置特異性)、どの糖を転移させるのか (糖供与体特異性) などの点から論じることができる。アミノ酸配列に基づいて近隣結合法で作成したFGTの分子系統樹を詳細に検討すると、こうした特異性の進化と酵素や植物の系統進化との関係が浮かび上がってくる4)。例えば、イソフラボン1の7位に特異的にグルコースを転移するダイズのGmIF7GT (図1、式1)5) や、カルコン2の4’位 (他のフラボノイドの7位に対応) に特異的にグルコースを転移するキンギョソウのAmC4’GT (図1、式2)6)、シソのフラボン7-グルクロナイド8の生合成に関わるPfF7GAT (図1、式3)7) は、フラボノイドの7位に糖を転移する他の植物のFGTとともにひとつのクラスター (クラスターIIIb) を形成する (図2)。同様に、フラボノイドの3位や5位に糖を転移するFGTは、それぞれ独立のクラスター (クラスター IおよびII) を形成する (図2)3,5)。われわれはまた2005年に、アントシアニン4の糖残基にグルクロン酸を転移するFGT (BpUGAT,図1、式4) を赤色デージー花弁から同定し、配糖体の糖部分にさらに糖を転移するGT (sugarsugarGT) が上記のクラスター (I, II, IIIb) とは異なるクラスター (IV) を形成する可能性を予言した (図2)4)。その後、さまざまなsugar-sugar GTが相次いで見いだされ、この新しいクラスターの存在が立証された。このようにFGTの系統は、まず第一に糖転移の位置特異性と良好な相関を示す。それぞれのクラスター内にはさまざまな植物系統が存在し、さらに同一の植物系統内で糖供与体特異性の異なるPSPGが派生している。したがって、FGTの糖転移の位置特異性は、植物種や糖供与体特異性が分化する以前にすでに確立されており、糖供与体特異性については植物種が分化した後に、個々の植物系統において独自に分化させていることが伺われる。また、系統樹の枝分かれの末端に近いところで異なる糖供与体特異性のGTが派生しているという事実は、比較的少ない数のアミノ酸置換によって糖供与体特異性に違いが生じうる可能性も示唆している。

3.糖供与体特異性の分散進化
ブドウ果皮にはフラボノール (ケルセチンやケンフェロール,5) の3位グルクロン酸配糖体10,グルコース配糖体11,ガラクトース配糖体12が蓄積している。これらのフラボノール配糖体は赤ワインの色調の発現に重要な役割を担うとされ、また抗うつ作用や動脈硬化予防効果なども有し、その生理活性の強弱は結合する糖の違いによって異なることが知られている8)。これらのフラボノール配糖体の生合成に関わるFGTの実体を明らかにするため、クラスターIにおける配列相同性に基づいてブドウゲノムをin silicoでサーチすることによって7つのクラスターIPSPG遺伝子を同定した8)。取得された遺伝子の機能解析の結果、これらのPSPGのひとつはフラボノール3-グルクロノシルトランスフェラーゼ (VvGT5;図1、式5) であり、別のひとつはグルコシルトランスフェラーゼ活性とガラクトシルトランスフェラーゼ活性を同程度に示すバイファンクショナルなFGT (フラボノール3-グルコシルトランスフェラーゼ/ガラクトシルトランスフェラーゼ、VvGT6;図1、式6,7) であることがわかった。
VvGT5とVvGT6は互いにきわめて高い配列同一性を示し (DNAレベルで91%、タンパク質レベルで88%)、また両酵素遺伝子は同じ染色体上にタンデムにコードされている。これらのことから両酵素は、祖先遺伝子の重複を経て分散的に進化して生じたものと推定された。興味深いことに、両酵素の糖供与体特異性は大きく異なっている。すなわちVvGT5はUDP-グルクロン酸にのみ作用し、UDP-グルコースやUDP-ガラクトースにはまったく作用しない。逆にvGT6は、UDP-グルコースやUDP-ガラクトースに作用し、UDP-グルクロン酸にはまったく作用しない。両酵素のこうした際立った糖供与体特異性の違いの原因となるアミノ酸残基が検索された結果、 VvGT5によるUDP-グルクロン酸の認識に140番目のArgが重要であることがわかった。同じクラスターに属するVvGT6や他のグルコシルトランスフェラーゼでは、VvGT5の140番目に対応する位置のアミノ酸は例外なくTrpである。実際に、VvGT5のArg140Trp点変異体は、UDP-グルコースに作用するもののUDP-グルクロン酸にはまったく作用せず、これはVvGT6と同様であった。また、この点変異による特異性の変化は、kcatの顕著な変化となって現れた。VvGT5とVvGT6の祖先タンパク質はグルコシルトランスフェラーゼであると考えられるので、遺伝重複によって生じた1対のPSPG遺伝子の一方にTrpからArgへの一塩基非同義置換 (TGG→AGG) が導入され、新たな糖供与体特異性が分散的に生じたものと推定された。
4.酵素触媒機能のON/OFFに基づく特異性発現
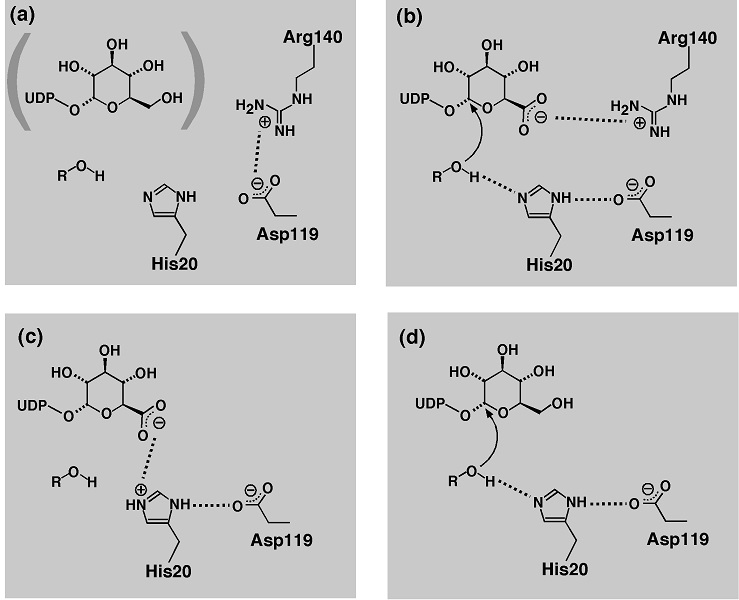
立体構造モデルによれば、VvGT5の糖供与体特異性決定基Arg140は、その側鎖を動かすことにより触媒重要残基Asp11 9と相互作用することができる。このAsp11 9はPSPGに高度に保存されており、糖受容体の活性化に関わる一般酸塩基触媒His20の役割を補助すると考えられている9)。酵素にUDP-グルコースが結合した状態や遊離の酵素の状態ではArg140はAsp11 9と相互作用できるため、Asp11 9のこうした触媒的役割が妨げられ、酵素は不活性な状態となると考えられた (図3a)。一方、VvGT5がUDP-グルクロン酸を結合した場合には、Arg140の側鎖が回転してUDP-グルクロン酸のカルボキシ基と相互作用するため、Asp11 9がArg140による束縛から解放されてその触媒的役割を遂行することが可能となると考えられた (図3b)8)。このモデルによれば、Arg140はいわばVvGT5の触媒装置の「分子錠」としての役割を果たし、遊離の酵素ではその触媒装置はArg140によって不活性な状態 (OFF) に「施錠」されていると言える。UDP-グルクロン酸はこれを解錠する「鍵」として作用し、酵素への結合によって触媒装置が作動可能な状態 (ON) となる。これに対してUDP-グルコースは分子錠との静電相互作用が不可能なため、VvGT5の触媒装置を解錠することはできない (図3a)。このように、VvGT5の糖受容体特異性発現の仕組みが酵素触媒機能のON/OFFに基づくという考えは、点変異に伴う上述の特異性変化がkcatの顕著な変化としてもたらされる事実と矛盾しない。またVvGT5のArg140Trp点変異体の糖供与体特異性についても立体構造モデルを用いて検証がなされた結果、この変異体ではUDP-グルクロン酸のカルボキシ基がHis20と相互作用してその触媒機能を阻害しうることが予測され (図3c)、これがUDP-グルクロン酸に対して同変異体が不活性である理由であると推測された。一方、UDP-グルコースが結合した場合にはHis20の機能は保たれるので (図3d)、同変異体はグルコシルトランスフェラーゼ活性を示すものと予想された8)。VvGT6や他の一般的な中性糖の転移酵素がUDP-グルクロン酸に対して不活性であることも同様の理由によると考えられる。

5.糖供与体特異性の収斂進化
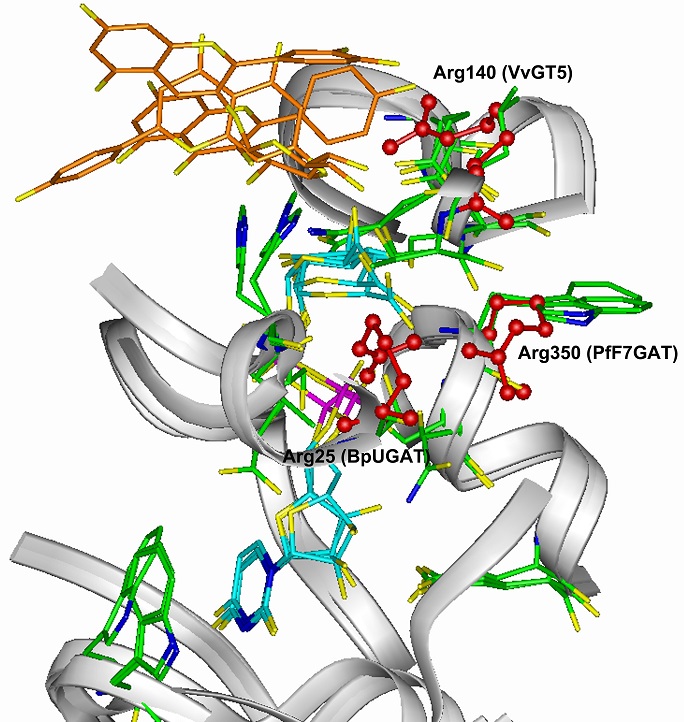
2.で述べたデージーのBpUGATやシソのPfF7GATは、VvGT5とは異なるクラスターに属するグルクロノシルトランスフェラーゼ (グルクロン酸転移酵素) である。これらの酵素についても同様に、UDP-グルクロン酸に対する特異性決定基の検索が行われている。その結果によれば、いずれの酵素でもUDP-グルクロン酸に対する特異性決定基はArg残基であるが、それらの1次構造上の所在はVvGT5の場合とは異なっており、BpUGATではArg2510)、PfF7GATではArg3507) であった (アミノ酸残基数:VvGT5, 459; BpUGAT, 438; PfF7GAT,453)。これらの酵素のミカエリス複合体の立体モデルを比較したところ、いずれの酵素においても、特異性決定基は複合体中のUDP-グルクロン酸のカルボキシ基と静電相互作用しうる位置に存在することがわかった (図4)8)。これは、系統的に異なるクラスターに属するFGTにおいて、それぞれ一次構造上異なる位置のArg残基の利用によりUDP-グルクロン酸認識という同一の機能が獲得されるに至った一種の収斂進化と見ることができる。なお、BpUGATやPfF7GATがVvGT5と同様な仕組みで糖供与体特異性を発現しているか否かは興味のあるところである。BpUGATの立体モデルでは、Arg25はその側鎖を動かすことによりAsp125 (VvGT5のAsp119に対応する) との静電相互作用が可能であり、VvGT5の場合と同様な仕組みで酵素のUDP-グルクロン酸選択性が発現される可能性が示唆された。一方、PfF7GATの立体モデルでは、Arg350の側鎖はAsp105 (VvGT5のAsp119に対応する) からかなり隔たったところに存在するため、PfF7GATは上で述べたのとは異なる仕組みによりUDP-グルクロン酸に対する特異性を発現していると考えている7)。

6.おわりに
フラボノイドの糖修飾を自在にコントロールすることが可能となれば、この興味ある植物二次代謝産物の構造機能相関に関する研究や産業的利用に拍車がかかることは疑いがない。そのためには、所望の特異性を持ったFGTを植物から自在に調達したりタンパク工学的手法で自在に創製したりすることを可能とするロジックを、基礎研究の積み重ねによって構築していかなければならない。本稿で述べた研究内容が、そうしたロジックの構築にいささかでも貢献できれば幸いである。
文献
1) Andersen, Ø. M., Markham, K. R. ed.: Flavonoids: Chemistry, Biochemistry and Applications, CRC Press, Boca Raton (2006).
2) Coutinho, P. M., Deleury, E., Davies, G. J., Henrissat, B.: J. Mol. Biol., 328, 307 (2003).
3) Vogt, T., Jones, P.: Trends Plant Sci., 5, 380 (2000).
4) Sawada, S., Suzuki, H., Ichimaida, F., Yamaguchi, M., Iwashita, T., Fukui, Y., Hemmi, H., Nishino, T., Nakayama, T.: J. Biol. Chem., 280, 899 (2005).
5) Noguchi, A., Saito, A., Homma, Y., Nakao, M., Sasaki, N., Nishino, T., Takahashi, S., Nakayama, T.: J. Biol. Chem., 282, 23581 (2007).
6) Ono, E., Fukuchi-Mizutani, M., Nakamura, N., Fukui, Y., Yonekura-Sakakibara, K., Yamaguchi, M., Nakayama, T., Tanaka, T., Kusumi, T., Tanaka, Y.: Proc. Natl. Acad. Sci. USA, 103, 11075 (2006).
7) Noguchi, A., Horikawa, M., Fukui, Y., Fukuchi-Mizutani, M., Iuchi-Okada, A., Ishiguro, M., Kiso, Y., Nakayama, T., Ono, E.: Plant Cell, 21, 1556 (2009).
8) Ono, E., Homma, Y., Horikawa, M., Kunikane-Doi, S., Imai, H., Takahashi, S., Kawai, Y., Ishiguro, M., Fukui, Y., Nakayama, T.: Plant Cell, 22, 2856 (2010).
9) 國兼 聡,中山 亨:生化学,80, 1033 (2008).
10) Osmani, S. A., Bak, S., Imberty, A., Olsen, C. E., Møller, B. L.: Plant Physiol., 148, 1295 (2008).