【トピックス】
非天然アミノ酸D-セリンの直接製造法
秀崎友則、安楽城正、進藤敦徳、田脇新一郎
三井化学
1.はじめに
D-アミノ酸を含有する化合物は特異な生理活性を有することが多く、医薬や農薬の中間体として近年注目を集めている。D-アミノ酸の一種であるD-セリンは抗結核薬D-シクロセリン (図1) の重要なキラルビルディングブロックであり、その需要は拡大を続けている1)。
アミノ酸のような光学活性化合物の一般的な合成方法としては、光学分割法と不斉合成法がある。光学分割法には、結晶化法やキラルな吸着体を用いたクロマトグラフィーによる分離方法、酵素の高い不斉認識能を利用してラセミ混合物の一方を特異的に反応させる方法などがある。しかしながら、光学分割法はラセミ体から一方のエナンチオマーのみを得る方法であるため、理論収率が50%を越えることはない。加えて、標的とするエナンチオマーの光学純度が十分に高くならない、生産プロセスにおいて工程数が多く操作が煩雑であるといった問題を抱えることも多い。一方、不斉合成法はアキラルな化合物を原料に一方のエナンチオマーを優先的に合成する方法であり、鍵となるのはその触媒である。触媒には立体選択性に優れた酵素が利用されることが多い。不斉合成法において、高立体選択性かつ高収率を実現することができれば、当然ながら極めて効率的な製造方法となり得る。
D-セリンは、L-アミノアシラーゼを用いた酵素的光学分割法により合成されていた2,3)。N-アセチル-DL-セリンを調製し、L-アミノアシラーゼでL体のみを特異的に脱アセチル化する。次に、N-アセチル-D-セリンを分離精製し、脱アセチル化することでD-セリンを得ている。この方法は前述の通り、理論収率が50%と低く、多工程となってしまうため、経済性に優れているとは言い難かった。
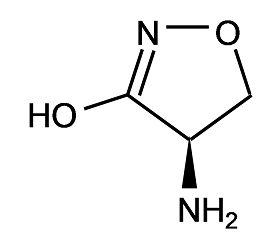
図1 D-シクロセリンの構造
このような状況下、筆者らのグループは、革新的な製造技術となるD-セリンの不斉合成法の開発に成功した。本稿ではまず、我々が見出したD-セリンを立体選択的に直接合成する酵素について紹介する。続いて、工業的生産プロセスにおいて効率を極限まで高めるための、遺伝子工学的および酵素学的アプローチを駆使した取り組みについても触れたい。
2.D-セリン直接合成酵素
D-アミノ酸を不斉合成する酵素は存在自体が稀であり、これまで見出されてきた酵素の種類も限られている。その中のひとつにD-スレオニンアルドラーゼ (以下D-TAと略す) がある。D-TAは、ピリドキサール-5-リン酸を補酵素とし、Mg2+、Mn2+のような2価の金属イオンを要求する酵素で、グリシンとアセトアルデヒドからD-スレオニンへのアルドール縮合反応を可逆的に触媒する4-8)。D-TAの立体制御は合成反応において、ヒドロキシル基を有するβ位に対して曖昧である一方、α位では厳密でd体に選択的である。既知のD-TAは基質特異性が比較的広く、グリシンと各種アルデヒドを基質に、対応するD-β-ヒドロキシアミノ酸を合成し、逆の分解反応も触媒することが知られている (図2)。このD-TAの広い基質特異性を活かし、入手が容易かつ安価な原料であるグリシンとホルムアルデヒドからD-セリンを直接合成することができれば、革新的な合成方法を開発することができる。しかしながら、D-TAは広い基質特異性を有することが知られているにもかかわらず、Arthrobactersp. DK-38由来のD-TAはD-セリンに作用しないことが示されており8)、D-セリンの合成反応を触媒するD-TAについてはこれまで報告がなかった。
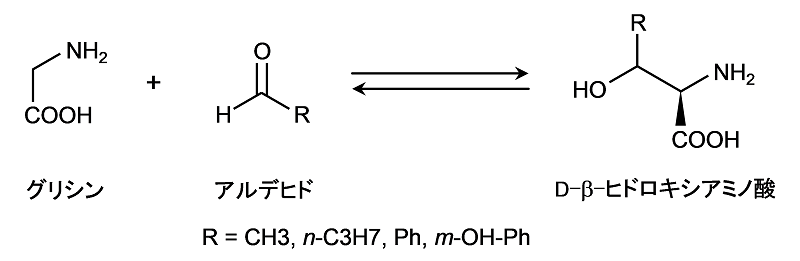
図2 D-TAによる反応例
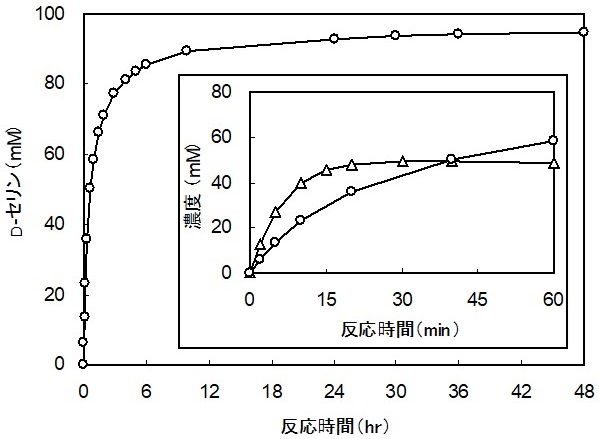
そこで、我々は、D-セリン合成活性を有するD-TAを見出すために、種々の細菌からスクリーニングを実施した。既知D-TA遺伝子のDNA配列のアライメントを作成し、保存配列に基づいてデザインしたプライマーを用いて、ゲノムPCR法によりD-TA遺伝子の探索を行った。その結果、Achromobacter ylosoxidans ATCC 9220 (以下Axと略す) から新規なD-TA遺伝子を取得することができた9)。本遺伝子のORFは1,140塩基で、379アミノ酸からなるタンパク質をコードしていると推定された。本酵素のアミノ酸配列は、D-セリンに作用しないことが報告されているA. sp. DK-38由来D-TAのアミノ酸配列に対して88%と高い相同性を示した。次に、我々が取得した新規D-TAが標的とするD-セリン合成活性を有するか評価するために、まずAx由来D-TA遺伝子を高発現する組換え大腸菌を作製した。続いて、大腸菌から組換えD-TA酵素を精製して、グリシンとホルムアルデヒドを基質とした合成反応を行った結果、生成物としてD-セリンが検出された。また、この合成反応では、L-セリンが全く検出されず、D-セリンの光学純度は99.9%ee以上であった。図3に示すように、Ax由来D-TAが極めて高い立体選択性を有するD-セリン直接合成酵素であることを見出した。本酵素はグリシンとアセトアルデヒドを基質としたD-スレオニンへの変換反応も触媒する。生成物のD-スレオニンは、スレオ体とエリスロ体のほぼ1:1のジアステレオマー混合体であり、既知のD-TA同様、その立体選択性はα位で厳密であるが、β位では極めて低かった。さらに、精製酵素を用いて、D-セリンとD-スレオニンの合成反応を行った。グリシンとアルデヒドの濃度をそれぞれ100 mMとして反応させたところ、初速はD-セリン合成の方が遅いという結果となった。しかしながら、反応収率を見てみるとD-スレオニン合成が50%程度に留まったのに対して、D-セリン合成では95%にまで達した (図4)。また、逆反応の試験ではAx由来D-TAがD-セリンの分解活性を示したことから、A. sp. DK-38由来のD-TAとは異なる基質特異性を有していることが明らかとなった。以上のように、新規Ax由来D-TAは高収率かつ高立体選択的にD-セリンを直接合成することから、 D-セリンの工業的生産に適した酵素であると言える。
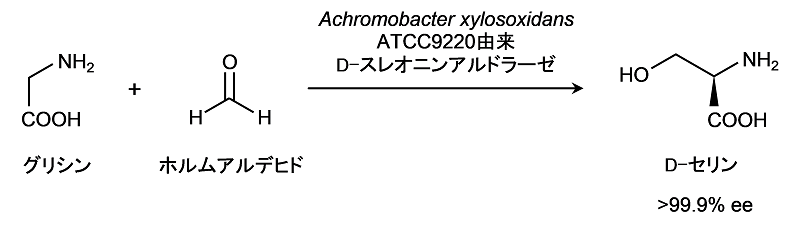
図3 Ax由来D-TAによるD-セリン合成反応

3.反応収率の向上
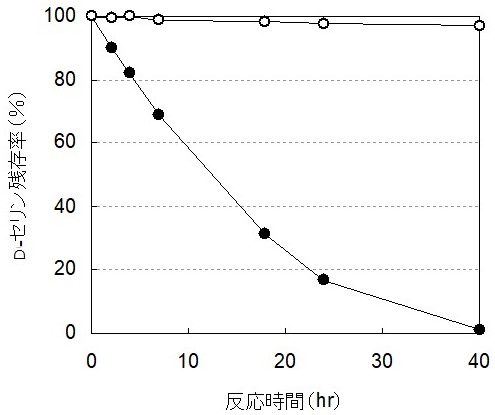
工業生産では、酵素の精製は操作が煩雑で経済面で不利である。したがって、触媒にはAx由来D-TA遺伝子を高発現する組換え大腸菌を細胞のまま用いることとした。本組換え大腸菌を触媒として実際にD-セリンの合成反応を行ったところ反応収率は90%となり、精製酵素を用いた場合の95%を下回った。収率低下の原因は、生命システム情報統合データベース (KEGG) の解析から、大腸菌が元々保有するD-セリン分解酵素、すなわちD-セリンデヒドラターゼにより生成したD-セリンがピルビン酸に分解してしまうためであると推測された。そこで、大腸菌触媒でより高い反応収率を達成するために、D-セリンを分解している可能性がある大腸菌内のD-セリンデヒドラターゼ遺伝子 (dsdA) を破壊することとした。相同組換えを利用した遺伝子破壊法10) を用いて、ゲノムからdsdAを取り除いた遺伝子破壊大腸菌を構築し、はじめにD-セリンの分解能を評価した。大腸菌の野生株とdsdA破壊株それぞれを50 mMのD-セリンに作用させたところ、野生型では40時間でほぼ完全にD-セリンが分解されたのに対し、dsdA破壊株ではほとんどのD-セリンが残存する結果なった (図5)。大腸菌の野生株はD-セリン分解活性を保有するが、dsdAを破壊することでその分解活性を抑制できることを明らかにした。dsdA破壊株をAx由来D-TA遺伝子で形質転換し、これを触媒としてD-セリン合成反応を行ったところ、反応収率は95%に達した。組換え大腸菌を細胞のまま触媒として用いても、精製酵素と同様の高収率を実現することに成功した。
![]()
4.光学純度の向上
D-セリンはその用途が医薬中間体であるため、品質として光学純度99.0%ee以上が要求される。触媒として精製酵素を用いた合成反応ではD-セリンの光学純度は99.9%ee以上であったが、組換え大腸菌では96.0%eeと光学純度の著しい低下が観察された。原因は大腸菌の内在性酵素がD-セリンの光学異性体であるL-セリンを生成しているためである。そこで、D-セリンの分解酵素を特定した方法と同様に、はじめにKEGGを解析したところ、セリンヒドロキシメチルトランスフェラーゼ (以下SHMTと略す) がL-セリンを合成している可能性があると推測された。SHMTはグリシンとホルムアルデヒドからL-セリンを生成する酵素である。L-セリンの生成を抑え、大腸菌触媒でも光学純度99.0%ee以上を実現するために、SHMT遺伝子 (glyA) およびdsdAの2重破壊大腸菌を作製し検証した。2重破壊株をAx由来D-TA遺伝子で形質転換してD-セリンの合成反応を行った結果、光学純度は97.0%eeとなりdsdA破壊株の96.0%eeを上回ったものの、医薬中間体の品質として必要な99.0%eeを超えるには至らなかった。これは、SHMTがL-セリンを合成する酵素の一部として関わっていることを示すと同時に、大腸菌が他にもグリシンとホルムアルデヒド、もしくはD-セリンを原料にL-セリンを生成する酵素 (あるいは酵素群) を保有していることを示唆している。
L-セリン合成活性のような不都合な活性を抑制する方法には、遺伝子工学的手法による遺伝子破壊の他に、古くから有効な手段として多くの研究例が知られている物理化学的作用による失活処理がある。Ax由来D-TAは有機溶媒に対する耐性が比較的高いことから、反応工程の前に大腸菌触媒を有機溶媒で処理することでL-セリン合成関連酵素を特異的に失活させることができるのではないかと考えた。このような特異的失活を可能とする有機溶媒を種々スクリーニングした結果、いくつかの有機溶媒でAx由来D-TA自体の失活を抑えつつ、大腸菌触媒のL-セリン合成活性を特異的に抑制できることがわかった。なかでもホルムアルデヒドは特異的な失活を可能とする上、次の反応工程でそのままD-セリンの基質となるため、その除去工程が不要である。このようなメリットから前処理の有機溶媒としてホルムアルデヒドを選定した。実際に、Ax由来D-TA遺伝子で形質転換したdsdA破壊株をホルムアルデヒドで前処理を施し、D-セリン合成反応を行った結果、99.9%eeという高い光学純度を達成することができた (図6)。このときの反応収率は前処理を施さない場合同様95%であった。
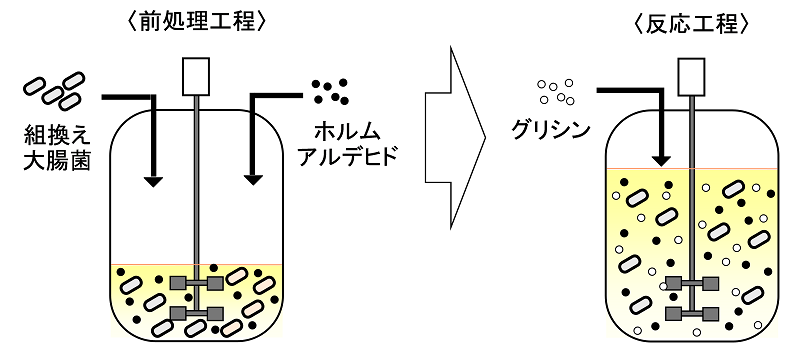
図6 前処理工程および反応工程の模式図
5.おわりに
我々は、D-TAの基質特異性が比較的広いことに着目し、D-セリンを直接合成する酵素、Ax由来D-TAを見出すことに成功し、その性質を明らかにした。続いて、本D-TA遺伝子の組換え大腸菌を用いたD-セリンの工業的生産プロセスの開発を試みたが反応収率、光学純度の低下を招いた。しかしながら、遺伝子破壊ならびに有機溶媒による前処理といった技術を駆使し、これら課題を解決することにより、組換え大腸菌触媒でも高収率かつ高光学純度を実現できる革新的な製造方法を開発するに至った。特に、反応工程で基質となるホルムアルデヒドをL-セリン合成関連酵素の失活剤として利用し、目的物のD-セリンへと変換させることで無駄なく効率の良いプロセスを実現したことは、本技術の優れた点の一つである。以上のように、工業生産では高性能な触媒に加え、合理的なプロセスを開発することが重要となってくる。本稿で紹介したような課題解決の概念や手法が、製造法の開発を検討される際の参考となれば幸いである。
文献
1) Michael, D., Iseman, M. D.: N. Engl. J. Med., 329, 784 (1993).
2) Chenault, H. K., Dahmer, J., Whitesides, G. M.: J. Am. Chem. Soc., 111, 6354 (1989).
3) Drauz, K., Eils, S., Schwarm, M.: Chimica Oggi, 20, 1/2, 15 (2002).
4) Liu, J.-Q., Dairi, T., Itoh, N., Kataoka, M., Shimizu, S., Yamada, H.: J. Biol. Chem., 273, 16678 (1998).
5) Kimura, T., Vassilev, V. P., Shen, G.-J., Wong, C.-H.: J. Am. Chem. Soc., 119, 11734 (1997).
6) Liu, J.-Q., Dairi, T., Itoh, N., Kataoka, M., Shimizu, S., Yamada, H.: J. Mol. Catal. B: Enzym., 10, 107 (2000).
7) Liu, J.-Q., Odani, M., Yasuoka, T., Dairi, T., Itoh, N., Kataoka, M., Shimizu, S., Yamada, H.: Appl. Microbiol. Biotechnol., 54, 44 (2000).
8) Kataoka, M., Ikemi, M., Morikawa, T., Miyoshi, T., Nishi, K., Wada, M., Yamada, H., Shimizu, S.: Eur. J. Biochem., 248, 385 (1997).
9) 安楽城正, 秀崎友則, 渡辺清一, 西田圭太, 長原清輝, 小糸光男: WO 2006/041143.
10) 徳田淳子, 和田光史, 阿部玲子, 及川利洋, 伊藤 潔: 特開2004-313174.