【トピックス】
コラーゲン結合性多機能SERPIN、色素上皮由来因子 (PEDF) の構造-機能相関
関谷敦志、小出隆規
早大院・先進理工
1.はじめに
Serine protease inhibitor (SERPIN) は大きなスーパーファミリーを構成する一群のタンパク質であり、ヒトでは36種類が知られている1)。アンチトロンビンやアンチトリプシンなどその名の通りプロテアーゼ阻害剤として働くタンパク質だけではなく、SERPINファミリーの中にはプロテアーゼ阻害活性を持たないnon-inhibitory SERPINと呼ばれるものも存在する。そのひとつが本稿で紹介する色素上皮由来因子 (Pigment epithelium-derived factor, PEDF ; SERPINF1) である。PEDFは50 kDaの分泌性糖タンパク質で、その名のとおり網膜色素上皮細胞の培養上清から同定された2)。その後、広範囲の組織・器官で発現が確認され、神経栄養/分化誘導能、血管新生阻害などさまざまな生理活性を有することがわかってきた。本稿ではPEDFの構造と機能について述べるとともに、細胞外マトリックス (ECM) の主要成分であるコラーゲンとの相互作用に着目したわれわれの最近の研究を紹介したい。
2.PEDFの機能
PEDFは網膜芽細胞腫Y79を神経様細胞に分化させる因子として同定された2)。発見当初PEDFの研究対象は主に眼について行われたが、のちに中枢および抹消神経に対しても保護作用を有することが示された3)。
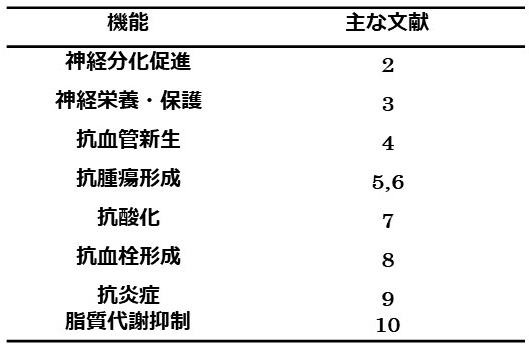
1999年にはBouckらによりPEDFが線維芽細胞増殖因子 (FGF) などの成長因子が誘導する血管新生を阻害することが報告され、その活性はエンドスタチンやトロンボスポンジン-1よりも強力であることが示された4)。PEDFの血管新生阻害能については次節で詳述する。その他、これまでに抗酸化活性、抗血液凝固活性、脂質代謝抑制などさまざまな機能が報告され (表1)、多機能SERPINとして認知されている。
表1 PEDFのさまざまな機能
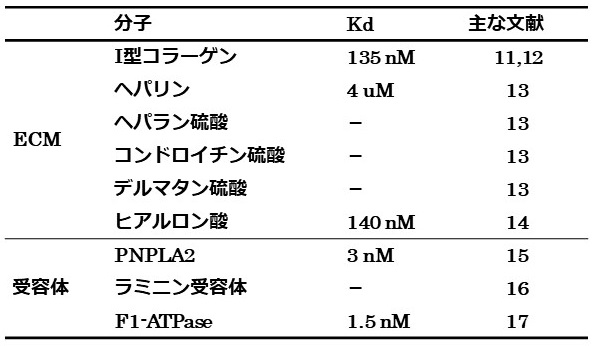
PEDFはさまざまな組織で発現が認められ、ECM成分であるⅠ型コラーゲンやヘパリン/へパラン硫酸およびヒアルロン酸などのグリコサミノグリカン鎖 (GAG) と結合する (表2)。PEDFは組織中にかなり多量に存在することが知られており、その濃度は眼ではインターフォトレセプターマトリックスで250 nM、ガラス体で30 nM、血中では約100 nM と見積もられている18,19)。またPEDFはすべてが可溶性因子として存在するわけではなく、コラーゲンなどのECM成分に結合して沈着していることから20)、PEDFがECMとの相互作用を通じて機能を発現するマトリクリン (matricrine) 因子として働く可能性が示唆されている。
表2 PEDFに結合する生体分子
3.血管新生阻害因子としてのPEDF
PEDFの血管新生阻害能は強力であり4)、その血管新生抑制を介して悪性腫瘍形成を阻害することが黒色腫や肝細胞癌などを用いた研究から明らかになっている5,6)。そのため、血管新生阻害の分子メカニズム解明がPEDFを利用した抗癌治療に向けて期待されている。近年、PEDF受容体として3つのタンパク質が報告された。リパーゼ連結型膜タンパク質 (PNPLA2)15)、37/67 kDaラミニン受容体16) およびF1-ATPase17)である (表2)。PNPLA2 はPEDFの神経栄養活性を担う受容体として酵母two-hybrid法で同定された15)。また、ごく最近、前立腺癌細胞において血管新生促進サイトカインであるインターロイキン-8の発現を抑制するシグナル伝達に関わることが報告された21)。37/67 kDaラミニン受容体は血管新生阻害・腫瘍抑制活性を担う受容体として同定された1回膜貫通タンパク質であるが、結合の特異性を含め詳細は不明である16)。最近F1-ATPaseもPEDFの血管新生阻害活性発現を担う受容体として報告されたが、ATP合成に干渉するという結果はあるものの、その意義の詳細は分かっていない17)。報告されたいずれのPEDF受容体についても、決定的なシグナル転換機構には迫れていないのが現状である。
われわれは上記のような「受容体探し」の研究とは別に、PEDFがECM相互作用を介したマトリクリン因子として機能発現するのではないかと考え、PEDF-ECM相互作用からPEDFの機能を調べている。PEDFはⅠ型コラーゲンやヒアルロン酸に高いアフィニティーで結合する (表2)。また、マトリックスメタロプロテイナーゼMMP-2およびMMP-9の基質となり、ECM中で分解されることにより量が調節される22)。
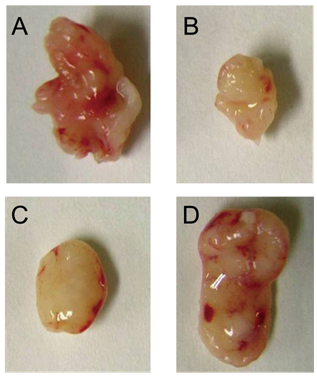
われわれは残基特異的変異体を多数作製し、PEDFのコラーゲン結合部位を形成する3つのアミノ酸Asp256、Asp258、Asp300、およびヘパリン/へパラン硫酸結合部位としてLys146、Lys147、Arg149を同定した23)。さらに、東京医科歯科大学森田育夫教授らと共同で、コラーゲン結合能を欠く変異体sp300→Asnおよびヘパラン硫酸結合能を欠く変異体Arg149→Alaを過剰発現するHeLa細胞を作製し、ヌードマウスに移植して腫瘍形成能を調べた。野生型のPEDFは血管新生の抑制を介して腫瘍の成長を阻害したが、興味深いことにコラーゲンに結合できない変異体では血管新生・腫瘍抑制効果はキャンセルされた (図1)。一方、ヘパラン硫酸結合能を欠く変異体では野生型同様に腫瘍抑制能を示した。この結果から、PEDFの血管新生阻害能の発現においてコラーゲンとの結合が重要であることが示唆された24)。Babaらは免疫組織染色化学的手法を用いてPEDFがコラーゲン線維上に沿って沈着し、その領域では新生微小血管がほとんど見られないこと観察しており、このことはコラーゲンに結合してPEDFが機能を発揮するという、われわれの知見と整合している20)。
![]()
4.PEDFの構造-機能相関
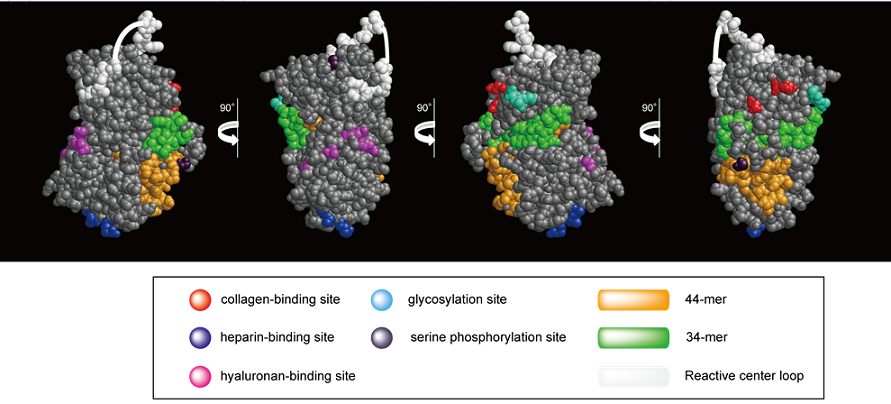
結晶構造によると、PEDFタンパク質は、片面に酸性アミノ酸、もう一方に塩基性アミノ酸が集合したユニークな構造をもつ25)。図2にはPEDFの立体構造に生体物質に対する結合部位、翻訳後修飾部位およびこれまでに提唱されている生理活性部位を示した。天然のPEDFはAsn285に複型糖鎖が付加されている19)。また、PEDFの翻訳後修飾は糖化のみならず、血中でプロテインキナーゼA およびカゼインキナーゼ2 によりSer24 、Ser114、Ser227がリン酸化される26)。Segerらはセリンのリン酸化が37/67 kDaラミニン受容体への結合能を向上させることを示すとともに、細胞遊走抑制能が向上することを示した27)。
![]()
図中の黄色 (44残基) 部位 (78-121a.a) は網膜芽細胞腫Y79の神経様細胞への分化を促すとされている28)。緑色 (34残基) 部位 (44-77a.a) は細胞遊走および腫瘍形成を抑制することが示されたペプチド断片の位置を示している29)。この配列は近年、37/67 kDaラミニン受容体への結合を担うことが報告された16)。そのため、この34残基配列 (緑) は受容体を介した血管新生阻害活性部位と考えるグループもあるが、実際にはその大部分がタンパク質中に埋もれており、この部位が分子表面に露出するためには立体構造の大きな変化が必要であると思われる。多くのSERPINはプロテアーゼによりReactive center loop (RCL) が切断されることでコンフォーメーション変化が誘導されるが1)、PEDFはRCLの切断でコンフォーメーションの変化は起こらない30)。また、尿素存在下あるいは熱変性状態でもPEDFの神経栄養活性は維持されるとの報告もある30,31)。そのため、PEDFが変性状態で、あるいはプロテアーゼで分解された後に機能する可能性も考えられる。これらの生理活性をもつPEDFの部分ペプチドについては、より精密な解析が必要である。
ECM成分との結合については、コラーゲン結合部位 (Asn256, Asn258, Asn300: 赤)、ヘパラン硫酸結合部位 (Lys146, Lys147, Arg149: 青) およびヒアルロン酸結合部位 (Lys189, Lys191, Arg194, Lys197: 赤紫) が同定されている14,23)。興味深いことに、コラーゲンとGAG (ヘパラン硫酸およびヒアルロン酸) の結合部位は分子の反対側に存在している。そのため、ECMにおいてPEDFはコラーゲンとGAGの両者に同時に結合できる可能性が示唆された。
5.ECM間相互作用調節因子としてのPEDF
3節でPEDFの血管新生阻害活性の発現にはコラーゲンとPEDFとの結合が重要であることを述べた。この知見を基にわれわれはPEDFによるコラーゲン認識の詳細について調べた。コラーゲンの部分構造を模倣する多数の3重らせん型合成コラーゲンモデルペプチドを用いてPEDFが結合する配列を探索したところ、図3に示すようにPEDFはⅠ型コラーゲンの2か所のKGHRGFSGLに結合することが明らかになった。引き続く構造活性相関の結果、結合モチーフは3重らせん構造をとったKGxRGFxGLであることが分かった。コラーゲンファミリーは計28の型から成り、高次構造から線維形成型 (Ⅰ、Ⅱ、Ⅲ型など)、ネットワーク型 (Ⅳ型など)、その他に分類されるが、PEDFの結合モチーフは線維形成型に特異的に保存されていた32)。実際にin vitroでPEDFが線維形成型であるI-Ⅲ型に結合し、ネットワーク型のⅣ型に結合しないことを確認している。これはPEDFが主に線維形成型コラーゲンで構成される間質で機能を果たし、基底膜では機能しない可能性を示している。
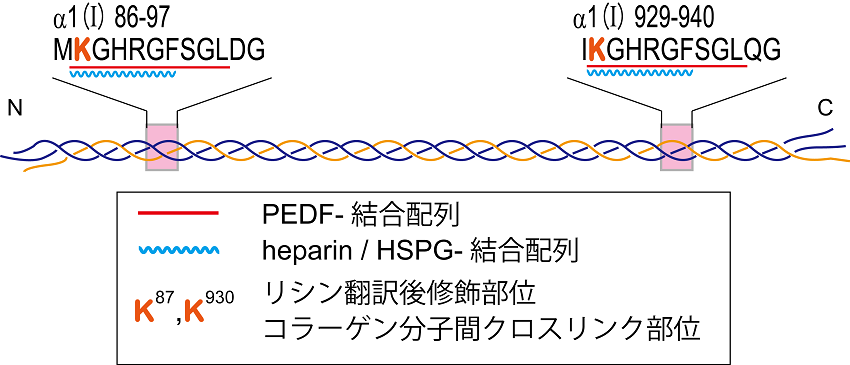
![]()
I型コラーゲン上の2か所のPEDF結合部位は線維形成型コラーゲンのリシン翻訳後修飾/分子間クロスリンク部位と重複していた (図3)。コラーゲンの翻訳後修飾としてはプロリンの水酸化が有名であるが、リシンもさまざまな修飾を受ける33)。小胞体内でのリシンの水酸化やECMでの酸化、それに続くコラーゲン分子間のクロスリンクが複数存在し、合成されてからの時間、組織、あるいは疾患によってそのレベルが変化することが知られている。リシンはPEDF認識に関わる責任アミノ酸の一つであるため、その翻訳後修飾はコラーゲン-PEDF結合に影響を与えることが予想される。コラーゲンの翻訳後修飾とPEDF結合能の相関研究は、PEDFのマトリクリン因子としてのキャパシティを決定するものであり、今後の課題である。
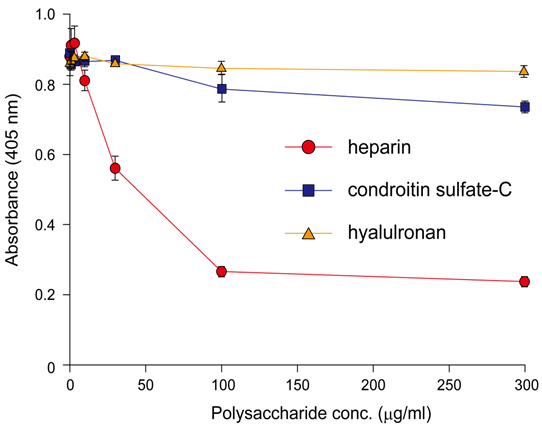
また、コラーゲン上でのPEDF結合部位がヘパリン/へパラン硫酸結合部位と重複していたことに着目して、われわれはELISAの競合系を用いて検討をおこない、PEDFとヘパリンが特異的に競合することを明らかにした (図4)32)。
GAGのひとつであるヘパラン硫酸は通常コアタンパク質に結合したプロテオグリカンの状態で存在する。コラーゲンとへパラン硫酸プロテオグリカンHSPG) の相互作用は次の1)、2) に示すように血管新生に深く関与していると考えられている。
![]()
1) シンデカンファミリーは主要な細胞膜貫通型の細胞表面HSPGで、コラーゲンと結合する34)。近年、シンデカン-コラーゲン相互作用はインテグリンα2β1を介した細胞の接着、遊走、浸潤に重要であることが報告された35,36)。インテグリンα2β1はコラーゲン受容体で血管新生において不可欠な存在である。また、in vivoでシンデカンを過剰発現した場合腫瘍形成・血管新生が亢進することが示されている37,38)。
2) 可溶性のHSPG成分であるパーレカンや酵素分解ヘパラン硫酸鎖断片はFGFやVEGFなどのヘパリン結合性成長因子の受容体への輸送に重要な役割を果たしている。特にFGFと受容体の結合にはヘパラン硫酸鎖が必要である39,40)。また、近年パーレカンはコラーゲンに結合することにより成長因子を細胞表面受容体に受け渡すことが報告されている41)。
われわれがin vitroで示したPEDFとヘパリン/HSPGのコラーゲンに対する競合は、1)、2) のような血管新生を制御するECM間相互作用にPEDFが干渉することによって機能を発現するという新たな可能性を示すものである。
6.おわりに
PEDFは血管新生阻害、神経栄養などさまざまな機能を有する多機能SERPINであることを述べた。PEDFのこれらの活性は、とくに欧米で注目され、抗癌剤および神経変性疾患への適用を目指した医薬品の開発に向けて応用研究が進められている。それに伴って、PEDFが発揮する新たな生理活性が、どんどん付け加えられていっている。
その一方、基礎研究に目を転じると、SERPINファミリーに属する、たかが分子量50 kDaの単一ドメインタンパク質としては、報告されている個別の生理活性を説明するための分子メカニズムは多様すぎるように感じられる。PEDFとECMの相互作用がPEDFの機能発現の最上流に存在し、その下流で起こる現象が多様な生理活性として表出されている可能性はないだろうか。ECM相互作用は血管新生、腫瘍形成、神経分化などさまざまな生理現象の要となるため、今回われわれが示したPEDFのECM間相互作用調節作用は、複雑なPEDFの機能発現機構をひもとくためのひとつの視点を提供するものであると考えている。
謝辞
本研究は科学研究費基盤研究 (B) 19390032および早稲田大学特定研究 (A) 2010A-044の支援により実施されました。本研究に関わった共同研究者の方々に感謝します。また、本稿執筆の機会を頂きました富山県立大学米田英伸先生に感謝いたします。図2は白黒印刷版ではわかりづらい点お詫びいたします。Pdfカラー版を参照いただければ幸いです。
文献
1) Law, R. H., Zhang, Q., McGowan, S., Bucnkle, A. M., Silverman, G. A., Wong, W., Rosado, C. J., Langendorf, C. G., Pike, R. N., Bird, P. I., Whisstock, J. C.: Genome Biol., 7, 216 (2006).
2) Tombran-Tink, J., Johnson, L. V.: Invest. Opthalmol. Vis. Sci., 30, 1700 (1989).
3) Taniwaki, T., Becerra, S. P., Chader, G. J,. Schwartz, J. P.: J. Neurochem., 64, 2509 (1995).
4) Dawson, D. W., Volpert, O. V., Gillis, P., Crawford, S. E., Xu, H., Benedict, W., Bouck, N. P.: Science, 285, 245 (1999).
5) Garcia, M., Fernandez-Garcia, N. I., Rivas, V., Carretero, M., Escamez, M. J., Gonzalez-Martin, A., Medrano, E. E., Volpert, O., Jorcano, J. L., Jiménez, B., Larcher, F., Del Rio, M.: Cancer Res., 64, 5632 (2004).
6) Matsumoto, K., Ishikawa, H., Nishimura, D., Hamasaki, K., Nakao, K., Eguchi, K.: Hepatology, 40, 252 (2004).
7) Yamagishi, S., Inagaki, Y., Nakamura, K.: J. Mol. Cell Cardol., 37, 497 (2002).
8) Takenaka, K., Yamagishi, S., Matsui, T.: Atherosclerosis, 197, 25 (2008).
9) Zamiri, P., Masli, S., Streilein, J. W.: Invest. Ophthalmol. Vis. Sci., 47, 3912 (2006).
10) Chung, C., Doll, J. A., Gattu, A. K., Shugrue, C., Cornwell, M., Fitchev, P., Crawford, S. E.: J. Hepatol., 48, 471 (2008).
11) Kozaki, K., Miyaishi, O., Koiwai, O., Yasui, Y., Kashiwai, A., Nishikawa, Y., Shimizu, S., Saga, S.: J. Biol. Chem., 273, 15125 (1998).
12) Meyer, C., Notari, L., Becerra, S. P.: J. Biol. Chem., 277, 45400 (2002).
13) Alberdi, E., Hyde, C. C., Becerra, S. P.: Biochemistry, 37, 10643 (1998).
14) Becerra, S. P., Perez-Mediavilla, L. A., Weldon, J. E., Locatelli-Hoops, S., Senanayake, P., Notari, L., Notario, V., Hollyfield, J. G.: J. Biol. Chem., 283, 33310 (2008).
15) Notari, L., Baladron, V., Aroca-Aguilar, J. D., Balko, N., Heredia, R., Meyer, C., Notario, P. M., Saravanamuthu, S., Nueda, M. L., Sanchez-Sanchez, F., Escribano, J., Laborda, J., Becerra, S. P.: J. Biol. Chem., 281, 38022 (2006).
16) Bernard, A., Gao-Li, J., Franco, C. A. , Bouceba, T., Huet, A., Li, Z.: J. Biol. Chem., 284, 10480 (2009).
17) Notari, L., Arakaki, N., Mueller, D., Meier, S., Amaral, J., Becerra, S. P.: FEBS J., 277, 2192 (2010).
18) Wu, Y. Q., Notario, V., Chader, G, J., Becerra, S. P.: Protein Expr Purif, 6, 447 (1995).
19) Petersen, S. V., Valnickova, Z., Enghild, J. J.: Biochem. J., 374, 199 (2003).
20) Baba, H., Yonemitsu, Y., Nakano, T., Onimaru, M., Miyazaki, M., Ikeda, Y., Sumiyoshi, S., Ueda, Y., Hasegawa, M., Yoshino, I., Maehara, Y., Sueishi, K.: Arterioscler. Thromb. Vasc. Biol., 25, 1938 (2005).
21) Hirsch, J., Johnson, C. L., Nelius, T., Kennedy, R., Riese, W.: Cytokine, 55, 202 (2011).
22) Notari, L., Miller, A., Marfinez, A., Amaral, J., Ju, M., Robinson, G., Smith, L. E. H., Becerra, S. P.: Opthamol. Vis. Sci.,46, 2736 (2005).
23) Yasui, N., Mori, T., Morito, D., Matsushita, O., Kourai, H., Nagata, K., Koide, T.: Biochemistry, 42, 3160 (2003).
24) Hosomichi, J., Yasui, N., Koide, T., Soma, K., Morita, I.: Biochem. Biophys. Res. Commun., 335, 756 (2005).
25) Simonovic, M., Gettins, P. G., Volz, K.: Proc. Natl. Acad. Sci. USA, 98, 11131 (2001).
26) Maik-Rachline, G., Shaltiel, S., Seger, R.: Blood, 105, 670 (2005).
27) Konson, A., Pradeep, S., D’Acunto, C. W., Seger, R.: J. Biol. Chem., 286, 3540 (2011).
28) Alberdi, E., Aymerich, M. S., Becerra, S. P.: J. Biol. Chem., 274, 31605 (1999).
29) Filleur, S., Volz, K., Nelius, T., Mirochnik, Y., Haung, H., Zaichuk, T. A., Aymerich, M. S., Beccerra, S. P., Yap, R., Veliceasa, D., Shroff, E. H., Volpert, O. V.: Cancer Res., 65, 5144 (2005).
30) Beccera, S. P., Sagasti, A., Spincella, P., Notario, V.: J. Biol. Chem., 270, 25992 (1995).
31) Becerra, S. P., Palmer, I., Kumar, A., Steel, F., Shiloach, J., Notario, V., Cgander, G. J.: J. Biol. Chem., 268, 23148 (1993).
32) Sekiya, A., Okano-Kosugi, H., Yamazaki, C. M., Koide, T.: J. Biol. Chem., 286, 26364 (2011).
33) Robins, S. P.: Biochem. Soc. Trans., 35, 849 (2007).
34) Xian, X., Gopal, S., Couchman, J. R.: Cell Tissue Res., 339, 31 (2010).
35) Vuoriluoto, K., Jokinen, J., Kallio, K., Salmivirta, M., Heino, J., Ivaska, J.: Exp. Cell Res., 314, 3369 (2008).
36) Ishikawa, T., Kramer, R. H.: Exp. Cell. Res., 316, 951 (2010).
37) Khotskaya, Y. B., Dai, Y., Ritchie, J. P., MacLeod, V., Yang, Y., Zinn, K., Sanderson, R. D.: J. Biol. Chem., 284, 26085 (2008).
38) Oh, J. H., Lee, H. S., Park, S. H., Ryu, H. S., Min, C. K.: Int. J. Gynecol. Cancer, 20, 751 (2010).
39) Schlessinger, J., Plotnikv, A. N., Ibrahimi, O. A., Eliseenkova A. V., Yeh, B. K., Yayon, A., Linhardt, R. J., Mohammadi, M.: Mol. Cell., 6, 743 (2000).
40) Pellegrini, L., Bruke, D. F., von Delft, F., Mulloy, B., Blundell, T. L.: Nature, 407, 1029 (2000).
41) Yang, W. D., Gomes, R. R. Jr., Alicknavitch, M., Franch-Carson, M. C., Carson, D. D.: Tissue Eng., 11, 76 (2005).