【トピックス】
アルドラーゼを用いた糖類合成の展開
杉山雅一
味の素・アミノサイエンス研
1.はじめに
アルドール反応は炭素-炭素結合を形成させる為に頻繁に用いられる重要な反応である。特にアルドール反応に伴い新たに生成する不斉炭素の立体化学をコントロールする不斉アルドール反応は有機合成化学者にとって非常に魅力的である。本稿ではアルドラーゼを用いた合成反応の開発に酵素工学の要素技術 (酵素改変、基質改変、新規酵素利用) を適応し、糖・糖アナログの簡便合成法を開発した事例について紹介したい。
2.アルドラーゼを用いた合成例と本研究の目的
アルドラーゼは、各々の酵素が用いるドナー基質に基づいて4つのタイプに分けられる (表1)。
表1 ドナー基質特異性によるアルドラーゼの分類
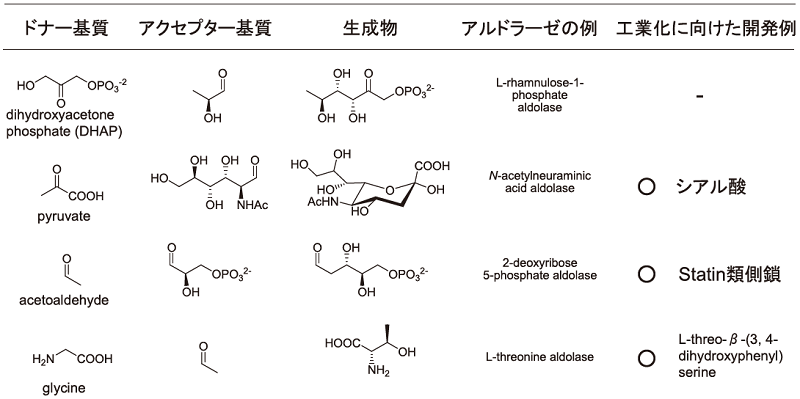
Dihydroxyacetone phosphate (DHAP)、pyruvate、acetoaldehyde、glycineの4種のタイプである1,2)。このうち後者の3タイプについては既に工業化に向けたプロセス開発例が報告されている。
一方で、DHAP アルドラーゼを用いた合成例として、アザ糖類の合成とL型糖などの希少糖の合成が挙げられる。糖アナログであるアザ糖はグリコシダーゼ阻害剤として作用し、抗がん剤、抗ウィルス剤、糖尿病などの医薬品開発ターゲットとなっている。アザ糖の合成スキーム例を図1に示す3)。アルドラーゼを用いてアジド基含有アルデヒドとDHAPをジアステレオ選択的にアルドール縮合させる。phosphatase処理によってリン酸基を除去し、還元的アミノ化によってアザ糖を得る。また、希少糖合成例としてL-rhamnulose 1-phosphate (RhaD) アルドラーゼを用いた低カロリー甘味料素材L-fructoseの合成例を挙げる4)。アルドラーゼがラセミ体glyceraldehydeのうちL体のみをエナンチオ選択的に利用し、且つアルドール縮合で生成する2つの不斉炭素の立体も制御するので、反応に伴って3ヶ所の不斉点を一度に制御することが出来る。
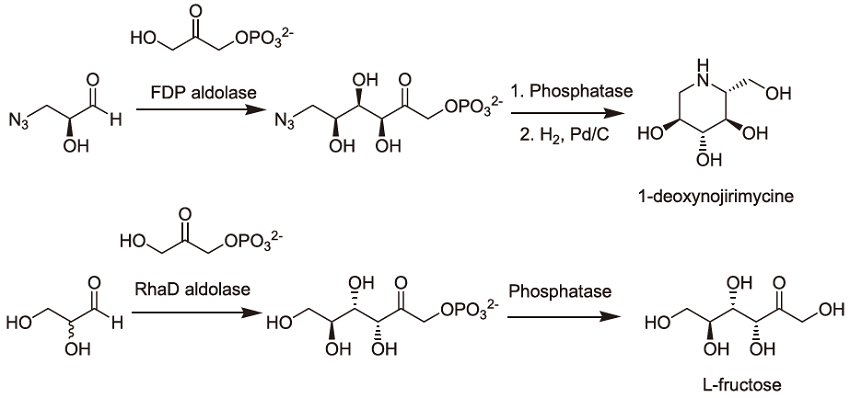
図1 DHAPアルドラーゼを用いた1-deoxynojirimycineおよびL-fructoseの合成
このようにDHAPアルドラーゼを用いた糖・糖アナログ合成は非常に有用であるにも関わらず、未だ工業化に向けた応用例はない。これはドナー基質であるDHAPの高コストと不安定性に起因している。これまでに数多くのDHAP製法が報告されているが、いずれも工業的なレベルを満足するものでは無い5)。ここでDHAPの代わりに、安価かつ安定で入手容易なdihydroxyacetone (DHA) を直接アルドラーゼ反応のドナー基質として用いることが出来れば、高価で不安定なDHAPを不要化し、さらにはphosphatase処理による脱リン酸化工程を省略することによる短工程化も可能とする。しかしながらDHAPアルドラーゼはDHAPに対する厳密なドナー特異性を有しており、DHAを全く認識しない。我々はDHAPアルドラーゼを用いたスケールアップ可能な糖・糖アナログ簡便合成法の開発に向け、DHAをドナー基質とするアルドラーゼ反応の開発を行った。
3.Directed evolutionによるDHA aldolase創出
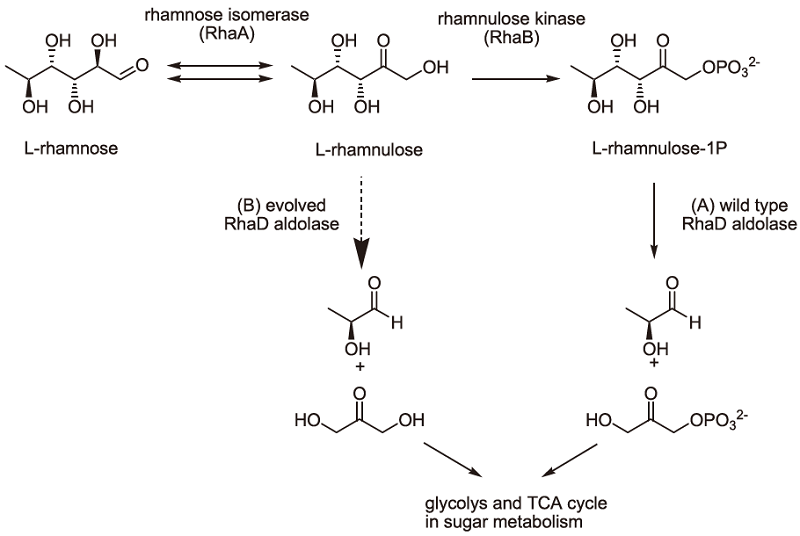
L-fructoseの1-step合成を目的とし、DHAアルドラーゼへの改変を試みた6)。目的酵素の選抜法としてE. coliのL-rhamnose代謝系の改変株を用いたin vivo selection系を構築した (図2)。L-rhamnoseはL-rhamnuloseに異性化された後にリン酸化され、L-rhamnulose-1Pとなる。これをRhaDがL-lactaldehydeとDHAPへとアルドール分解し、資化可能となる。我々は、まずラムノースオペロン欠損株E. coli BW25113 (DE3) ΔrhaDAB株を構築した。この菌株はL-rhamnose単一炭素源培地 (MMRha) で生育出来ない。L-rhamnuloseに作用できる変異型RhaD (図3B) を有する株はMMPha培地での生育株として選抜されると考えた。

![]()
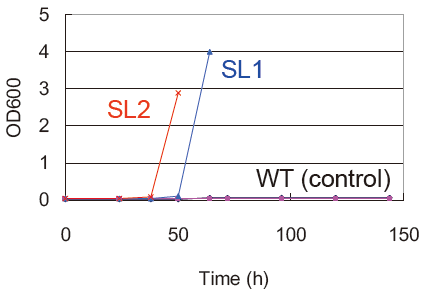
実際に1.4 × 106の変異型ライブラリを構築し、MMRha培地で30℃、3日間培養した。コントロール区である野生型遺伝子導入区では菌の生育が認められなかったのに対して、変異型ライブラリ導入区では、MMRha培地での生育が回復した。生育した株では目的とする変異型RhaDアルドラーゼ活性が濃縮されている可能性が考えられたため、生育株から抽出したプラスミドを再度E. coli BW25113 (DE3) ΔrhaDAB株に導入してMMRha培地で培養した (SL2)。その結果 (図3)、生育に必要なリードタイムの短縮が認められた。次にMMRhaプレートで生育可能となった変異型RhaDアルドラーゼ保有株を単離・選抜した。これらの株から調製したcell free extractを用いてL-rhamnuloseアルドラーゼ活性をスクリーニングし、L-rhamnuloseからDHAを生成する活性を示した株を数株単離した。例えば図4に示す2株はMMRhaプレートでの生育回復を示す。これらが有するRhaDアルドラーゼ遺伝子上には、共にCys142Tyr/Thr158Serという2重変異が導入されていた。得られた変異型酵素の諸性質検討と更なる変異導入・スクリーニングは現在、引き続き検討中である。
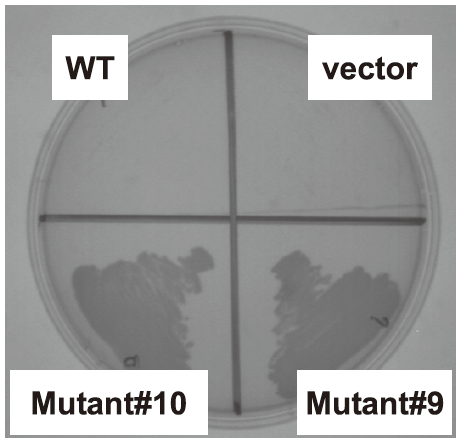
図4 L-rhamnose単一炭素源プレートでの選抜
4. リン酸エステルミミックとしてのホウ酸の利用 : L-fructoseおよびL-アザ糖類の合成
前述のDirected evolutionは酵素の基質特異性を改変する試みであるが、これと並行して基質側に細工を施すsubstrate engineeringも検討した。RhaDアルドラーゼのDHAPアナログとの複合体でのX線結晶構造において、基質のリン酸と酵素の基質結合部位の複数の残基との間で水素結合が形成されているが、リン酸基は触媒反応機構そのものへは直接的には関与していない。我々はDHAPより安価且つ安定なミミックを探索する過程で、RhaDアルドラーゼがホウ酸存在下でDHAを基質として認識出来ることを見出した7)。反応はシンプルで (図5)、DHAを基質とした酵素反応をホウ酸バッファー中で行うという、簡便かつ実用的な反応である。本反応はホウ酸依存的なアルドラーゼ反応であり、in situで可逆的に生成したDHA-borateエステルがRhaDアルドラーゼによって基質として認識され、L-glyceraldehydeとの酵素的不斉アルドール縮合が進行している可能性が考えられた。生成物のホウ酸エステルは反応後の精製過程で容易に加水分解を受け、単離収率92%でL-fructoseをグラムスケールで調製した。
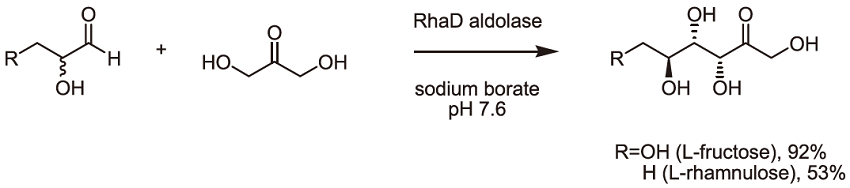
図5 RhaDアルドラーゼとホウ酸バッファーを用いたL-fructoseの1ステップ合成
次にホウ酸存在下でのアルドール縮合および分解の両面のRhaDアルドラーゼ活性を測定し、リン酸化基質に対する酵素活性と比較したところ、ホウ酸存在下でのL-fructoseに対するレトロアルドール活性は検出限界以下で、即ちRhaD/ホウ酸依存的L-fructose合成反応は見かけ上不可逆な反応であった。ホウ酸とfructoseの関係については11B, 13C NMRを用いた研究や熱力学的研究により、D-fructoseはホウ酸と比較的安定な1:1あるいは1:2のborate-β-D-fructofuranose複合体を形成することが示されている。反応により生成したL-fructoseはホウ酸と複合体を形成することによりトラップされ、レトロアルドール反応を受けることなく、結果的に反応平衡が生成物側に寄っていることが示唆された。
次に、RhaD/ホウ酸を用いたDHA基質でのアルドール縮合反応を、L-アザ糖の合成へと応用した (図6)。図に示すアジド基を有するアルデヒド基質をそれぞれ調製し、RhaD/ホウ酸反応によりDHAとアルドール縮合させた後に、還元的アミノ化によりジアステレオ選択的に環化してL-アザ糖を合成した。合成したL-アザ糖の種々グリコシダーゼに対する阻害活性を測定したところ、2はjack beans由来α-glucosidaseに、3はgreen coffee beans由来α-galactosidaseに、また4はhuman placenta由来β-N-acetylglucosaminidaseに対してそれぞれ特異的な阻害活性を示すことが明らかとなった。
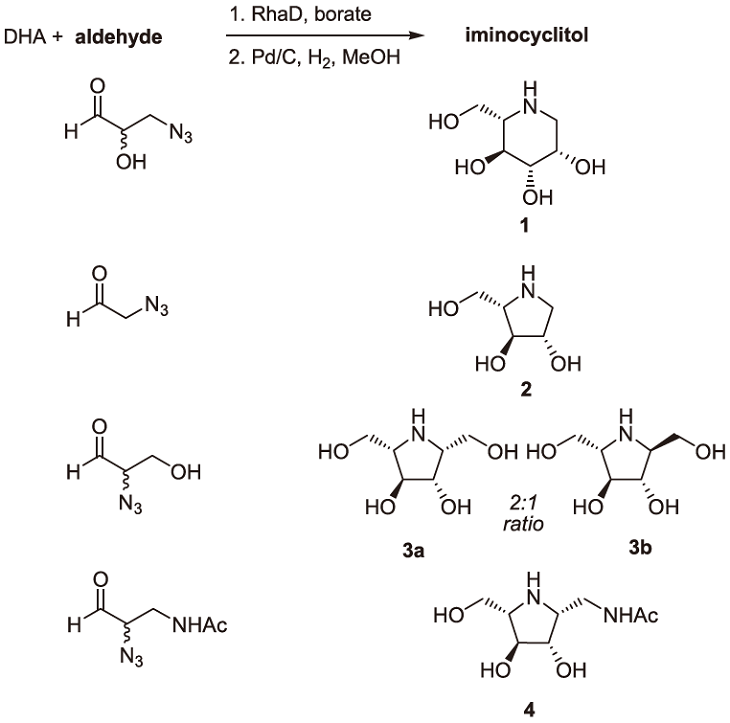
図6 RhaDアルドラーゼとホウ酸バッファーを用いたL-アザ糖の2ステップ合成
5. D-fructose-6-phosphate アルドラーゼを用いたD-アザ糖類のワンポット合成
D-アザ糖の製法として、近年見出された酵素であるD-fructose 6-phosphateアルドラーゼ (FSA) を用いた、実用的なD-アザ糖類のワンポット合成法を開発した8)。
本酵素は当初はE. coliゲノム解析によりtransaldolase相同遺伝子として見出された遺伝子である。ところが、2001年にSprengerらによってFSAアルドラーゼという新規酵素であることが報告された9)。FSAの生理機能は未知であり、また有機合成への応用例も無かった。FSAはDHAとglyceraldehyde 3-phosphateとのアルドール反応を触媒する。即ちDHAPの代わりにDHAをドナー基質とするアルドール反応を触媒する。我々は、FSAの有機合成への利用、とりわけD-iminocyclitol合成への応用を検討した。
FSAを用いたアザ糖合成として、まず1,4-dideoxy-1,4-imino-D-arabitol 5の合成を試みた (表2)。FSAはazidoacetaldehydeをアクセプター基質としてDHAとアルドール縮合し、単一のジアステレオマーのアルドール縮合物を与えた。還元的アミノ化反応によりアザ糖5へと誘導した後にNMRを報告値と比較することにより、FSAによるアルドール縮合における立体選択性はFDPアルドラーゼと同様に (3S, 4R) であることが判明した。
表2 Azidoaldehydesからのアザ糖合成
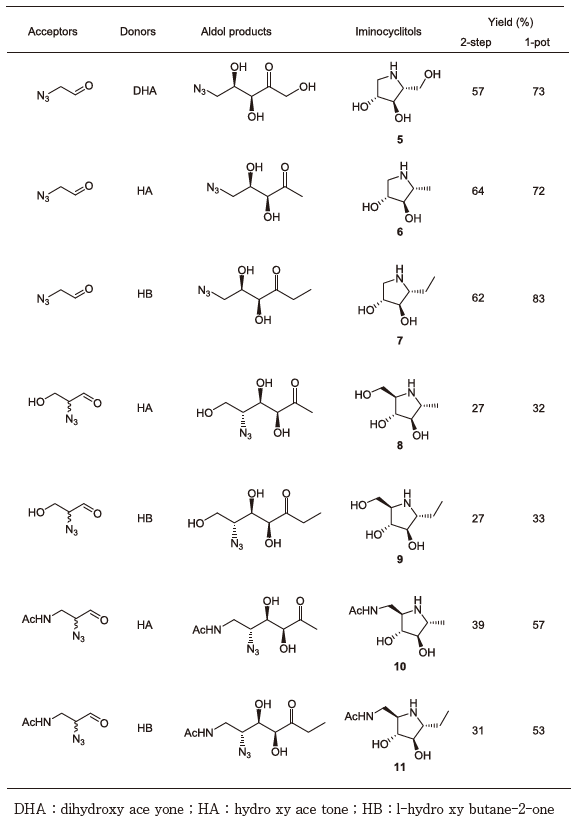
次に種々アザ糖合成に向けた基質特異性の検討を行った。先ずドナー基質について検討した (図7)。これまでにFSAはDHAの他にhydroxy acetone (HA) もドナー基質とするとの報告があったが、これに加えて1-hydroxybutane-2-one (HB) もドナー基質とすることを見出した。一般的にアルドラーゼは極めて狭いドナー特異性を示すため、FSAが3種類のドナー基質を認識しうることは、ユニーク且つ有用な特性と言えよう。次にアクセプター基質の特異性について検討した。各種2-azido aldehydeをアクセプター基質とした5員環のD-アザ糖の合成を表2に、N-Cbz 3-amino aldehydeをアクセプターとした6員環のD-アザ糖の合成を表3にそれぞれ示す。
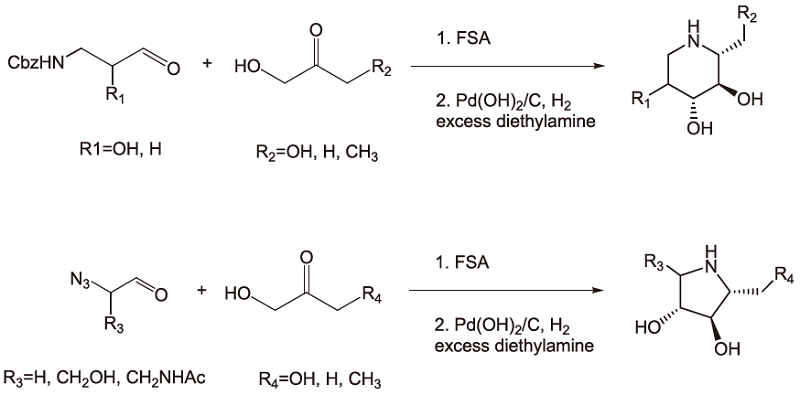
図7 D-fructose 6-phosphate aldolaesを用いたD-アザ糖のワンポット合成
表3 Cbz-保護 aminoaldehydesからのアザ糖合成
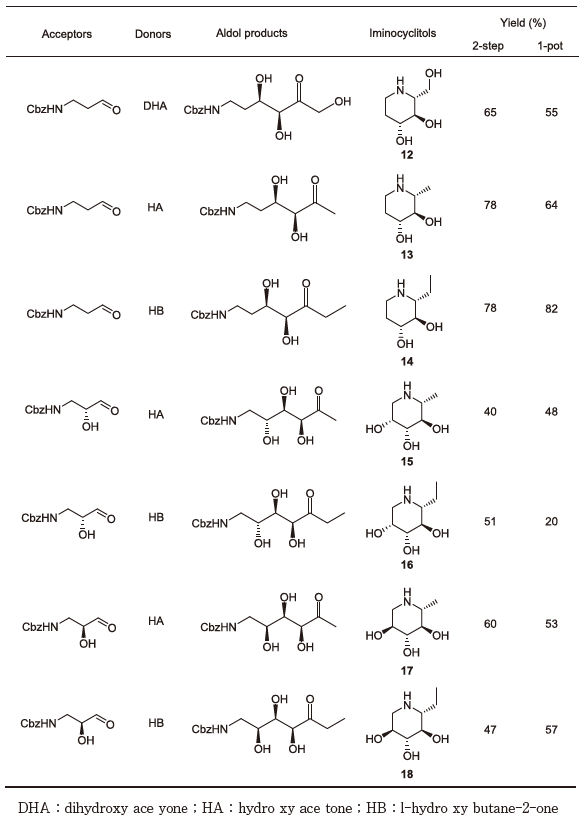
次にFSAを用いたアザ糖合成をさらに効率的なものとするために、反応のワンポット化を行った (図7)。鍵はアルドラーゼ反応に続く還元的アミノ化反応の際にアザ糖のイミノ基を保護する目的で過剰量のdiethylamineを添加することであった。表2および表3に2-step反応とワンポット反応でのそれぞれのアザ糖の単離収率を示す。
本研究において合成したアザ糖の中で、いくつかの化合物はこれまでに合成報告例が無いアザ糖類であるため、種々glycosidaseに対する阻害活性の測定を行った。特に10、11はhuman placenta由来β-N-acetylglucosaminidaseに対してKi値100 nMオーダーでの特異的阻害活性を示した。本研究により、これら化合物は合成が容易となったことから、更なる構造展開により変形性骨関節炎の治療薬への展開が期待された。
6.おわりに
本稿では有機合成にアルドラーゼを用いる際の課題解決に向けたアプローチとして、DHA (P) アルドラーゼを例として挙げた。RhaDアルドラーゼがホウ酸存在下でDHAを基質として認識し、アルドール縮合反応を進行させることを見出し、L-糖やL-アザ糖の合成へと応用した。DHAPと比較して極めて安価なDHA (試薬価格としては1万分の1) を原料とすることに加えて、酵素的脱リン酸化工程を省き、DHAPアルドラーゼを用いた合成をより実用的なものとしたと考えている。また、FSAを用いることによりワンポットでのD-アザ糖の合成法を初めて開発した。アザ糖の化学合成法は糖の水酸基の位置特異的保護・脱保護など複雑かつ煩雑な合成であるが、FSAを用いた簡便な合成法の確立によりアザ糖合成とその構造展開研究に貢献できるものと考えている。
本研究は筆者が米国サンディエゴにあるThe Scripps Research Institute化学科のChi-Huey Wong教授の研究室に留学中に行ったものである。共同研究者として日々の研究において大変お世話になったDr. William Greenberg, Dr. Zhangyong Hongを始めとするWong研の皆様に感謝したい。また留学の機会とご支援を頂いた、味の素㈱アミノサイエンス研究所の横関健三博士、渡部乙比古博士、鈴木俊一博士に紙面をお借りして感謝したい。
文献
1) Dean, S. M., Greenberg, W. A., Wong, C.-H.: Adv. Synth. Catal., 349, 1308 (2007).
2) Samland, A. K., Sprenger, G. A.: Appl. Microbiol. Biotechnol., 71, 253 (2006).
3) Whalen, L. J., Wong, C.-H.: Aldrichimica Acta, 39, 63 (2006).
4) Franke, D., Machajewski, T., Hue, C.-C., Wong, C.-H.: J. Org. Chem., 68, 6828 (2003).
5) Schumperli, M., Pellaux, R., Panke, S.: Appl. Microbial. Biotechnol., 75, 33 (2007).
6) Sugiyama, M., Hong, Z., Greenberg, W. A., Wong, C.-H.: Bioorg. Med. Chem., 15, 5905 (2007).
7) Sugiyama, M., Hong, Z., Whalen, L. J., Greenberg, W. A., Wong, C.-H.: Adv. Synth. Catal., 348, 2555 (2006).
8) Sugiyama, M., Hong, Z., Liang, P.-H., Dean, S. M., Whalen, L. J., Greenberg, W. A., Wong, C.-H.: J. Am.Chem. Soc., 129, 14811 (2007).
9) Schurmann, M., Sprenger, G. A.: J. Biol. Chem., 276, 11055 (2001).