【トピックス】
バクテリオファージは抗生物質に取って代われるか
丹治保典
東工大院・生命理工
1.はじめに
Twortフレデリックは1915年、バクテリアを溶かしてしまうウイルス (バクテリオファージ) を偶然発見した。その後多くの科学者がファージを抗菌剤として用いようと試みた。いわゆるファージセラピーの始まりである。しかしAlexanderフレミングがペニシリンを発見 (1929年) してから、その座は完全に抗生物質に奪われてしまった。多剤耐性菌の出現に代表される抗生物質の問題点がクローズアップされた昨今、アメリカを中心とする研究者のグループにより、再びファージにより病原菌をコントロールしようとする試みがなされている。
2.大腸菌O157:H7抑制の試み
研究対象としてよく用いられるT4ファージの構造を図1に示す1)。大きさは宿主である大腸菌の1/10に相当し、約200 nmある。月面着陸船のような本体はヘッド、テールおよびロングテールファイバーから構成される。ヘッドは正三角形のタンパク質シート20枚から成り、2本鎖のDNAを格納する。ゲノムのサイズは約160 kbpである。宿主に感染している時以外、テールファイバーはヘッド下部から延びるウィスカーとくっ付き、傘が強風で裏返されたような折り畳み構造をとる。機械的な障害を回避するためと考えられる。
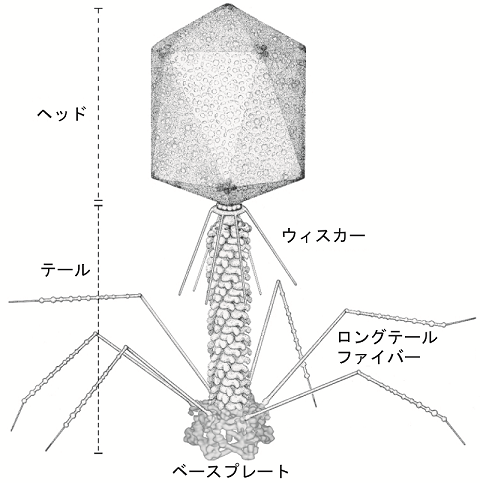
図1 T4ファージの構造
2004年~2005年の間、都市下水処理場流入水を毎月採取し、その中に含まれる大腸菌O157:H7関連遺伝子をMultiplex-PCR法により検出した。PCRの標的とした遺伝子は志賀毒素I,IIをコードするstx-I、stx-II、O抗原をコードするrfbE、鞭毛 (H抗原) をコードするfliC、そて菌体の腸管粘膜定着に必須のインチミンをコードするeaeの5種である。調査を行った期間において下水処理対象流域におけるO157の発症報告はなかった。しかし、関連遺伝子が高頻度で検出され、特に2005年3月の試料からは腸管出血性大腸菌O157:H7 (EDL933) と同様に明確な遺伝子増幅を認めた。健常者の中に、発症しない保菌者 (ヘルシーキャリア) が多くいることを示す結果である。同様に、健康牛の直腸便を用いてO157関連遺伝子の検出を試みた。ほとんどの個体から志賀毒素II遺伝子 (stxII) が検出された。しかし、rfbEとeaeは明確に検出できなかった。157以外のO抗原を有し、腸管定着能を欠失する病原性大腸菌の存在を示唆する。以上の結果はヘルシーキャリアと呼ばれるヒトと家畜が多く存在し、O157がごく身近な環境に存在することを示す。
健康な一頭のブタ糞便からスクリーニングされPP01と命名されたファージは大腸菌O157:H7に特異的に感染し、O157を溶菌する2)。電顕写真から、PP01はT4ファージと類縁であり、大腸菌O157:H7が増殖するシャーレにP字状に塗布すると、P字状の溶菌紋が生じる。ただし、PP01と大腸菌O157:H7を長時間接触させると、必ずPP01に耐性を持ったO157が出現する。耐性菌の多くがファージのレセプターに変異を持つ。耐性菌の変異箇所は、ファージによって異なる。複数のファージ混合液 (ファージカクテル) を投与すると、耐性菌の出現をある程度制御することができる3)。
3.大腸菌O157:H7の迅速検出
1996年夏、大阪府堺市で大腸菌O157:H7による集団食中毒が発生し、約8000人の患者と3名の死者が報告された。当初は原因食材としてカイワレ大根が疑われ、大きな風評被害をもたらしたが、結局発生源を特定するまでには至らなかった。患者に対する適切な治療と発生源を特定するためには、迅速な病原体の同定が必須である。しかし、培養を必要とする公定法は菌体の同定に3日以上を要する。そこで、PP01ファージをうまく利用し、O157を迅速に検出する方法を開発した。緑色蛍光タンパク質 (GFP) でファージを標識すると、ファージが感染した宿主を蛍光顕微鏡で検出することができる4)。ファージ頭殻にはSOC (Small capsid protein) と呼ばれる構造タンパク質が存在し、ファージ当たり870分子発現される。相同組換の原理を利用し、SOCをコードする遺伝子にGFPをコードする遺伝子を連結すると、組換ファージは頭殻にSOC-GFPの融合タンパク質を発現する (図2)。このようにして分子構築された蛍光標識ファージは、宿主表層に吸着した段階で可視化することができる。さらに、感染したファージが被感染細胞で増殖すると、さらにその蛍光強度は増し、検出を容易にする。しかし、ファージは感染後期に宿主を溶菌し、顕微鏡下での観察を難しくする。そこで、溶菌酵素をコードする遺伝子にアンバー終止コドンを導入し溶菌活性を阻害すると、長時間観察が可能となった5)。なお、アンバー変異を導入したファージはアンバーサプレッサー大腸菌を使用し、増殖させることができる。
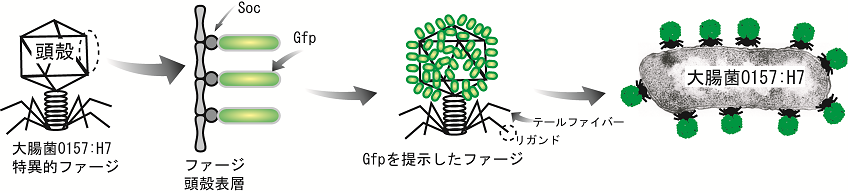
図2 蛍光性ファージによる大腸菌0157:H7の検出原理
4.黄色ブドウ球菌抑制の試み
図3に農林水産省消費・安全局 畜水産安全管理課がまとめた日本における抗生物質の使用状況を示す6)。抗生物質の使用総量は年間2210トン (2003年) であり、その内ヒト医薬用が520トン (24%)、家畜用1060トン (48%)、養殖魚用230トン (10%)、農業用400トン (18%) である。いかに大量の抗生物質が家畜に投入されているかが分かる。抗生物質の家畜への投与が始まったのは1960年代で、まもなく家畜病原菌が抗生物質に対し耐性を示す薬剤耐性菌が出現した。家畜感染症の多くは人畜共通の病原菌に起因する。日本では年間約2万人もの「抗生物質耐性菌」感染による死者が出ており、今後その数はさらに増えると思われる。このような背景から世界保健機構 (WHO) は家畜への抗生物質過剰使用を控えるよう警告している。一方で、抗生物質に代わる有効な治療法が無いのが現状である。
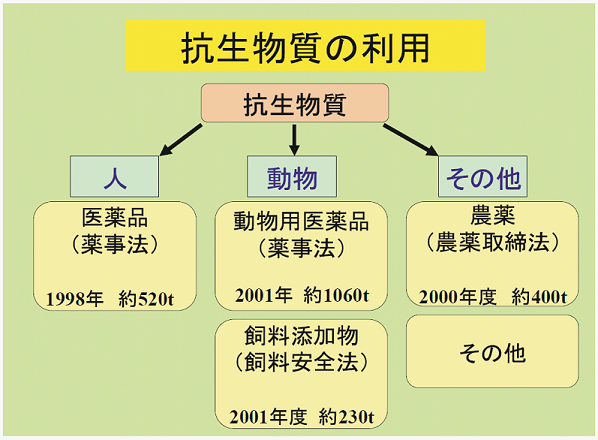
図3 日本における抗生物質の利用状況
酪農家にとって最も重要な家畜感染症に乳房炎がある。その被害額は酪農家一戸当たり年間約300万円にものぼり、日本における年間の被害総額は1000億円を超える。牛乳房炎は乳房に細菌が侵入し、乳量および乳質の低下が起こり、時には牛が死亡する病気である。搾乳時に搾乳機械や人の手から感染する伝染性乳房炎と、牛舎敷床から感染する環境性乳房炎に分けることができる。乳房炎は様々な細菌により起こるが、主に黄色ブドウ球菌と大腸菌が原因とされる。黄色ブドウ球菌は主に伝染性乳房炎の原因菌であり、大腸菌は環境性乳房炎の原因菌とされる。
そこで、黄色ブドウ球菌を対象としたファージセラピーに向け、2008年春から研究を開始した。はじめに、牛乳房炎起因黄色ブドウ球菌のスクリーニングから始めた。北海道にある酪農学園大学から乳房炎罹患牛の乳汁試料を提供して頂き、選択培地により50数種の黄色ブドウ球菌の単離を試みた。一般にはあまり知られていないが、牛乳汁には多くの細菌が存在する7,8)。多くの細菌の中から黄色ブドウ球菌を単離するにはマンニット食塩寒天培地を使用する。この培地には高濃度の食塩 (7.5%-10%) が含まれており、ほとんどの真正細菌を阻害してミクロコッカス属やスタフィロコッカス属の真正細菌を選択的に増殖させる。マンニット食塩寒天培地にはマンニトールとフェノールレッドが含まれる。黄色ブドウ球菌はマンニトール発酵を行い、酸を産生し、培地の色を赤色から黄色へと変化させる。さらに、コアグラーゼ (血漿凝固作用を有する菌体外毒素) 陽性、ヘモライシン (溶血毒素) 陽性の株を15種選び16S rRNAをコードするDNA-シーケンスにより、黄色ブドウ球菌であることを確認した。
スクリーニングした黄色ブドウ球菌を用いて、黄色ブドウ球菌に感染するファージのスクリーニングを行った。はじめは牛舎の敷きワラや牛糞、牛体表のぬぐい液などを用いたがファージを見いだすことはできなかった。一方、都市下水流入水を対象にスクリーニングを行ったところ50数種の溶菌性ファージを得ることができた。都市下水にはヒトの糞尿が流入する。スクリーニングされた黄色ブドウ球菌感染性ファージの多くはヒト由来であると思われる。スクリーニングされたファージと黄色ブドウ球菌を用いて、各ファージの感染宿主域を調べた。スクリーニングされたファージの中でφSA012およびφSA039と命名したファージは比較的感染宿主域が広く、黄色ブドウ球菌に対し高い溶菌活性を示した (図4)9)。φSA012およびφSA039はそれぞれ試験管の中で黄色ブドウ球菌に対し高い溶菌活性を示した。さらに両者を混ぜたカクテルは、耐性菌の出現を遅らせるか完全に押さえることができた。現在、酪農学園大学と共同で牛乳房炎の治療に向けたin vivoの実験を進めている。
5.おわりに
エイズや新型インフルエンザに代表されるように、動物ウイルスのコントロールは社会的関心が非常に高い。一方、ファージはその存在すらあまり知られていない。様々な環境から病原菌とファージをハンティングしたところ、家畜糞便と都市下水流入水から多くをスクリーニングすることができた。都市下水流入水に存在していた病原菌とそれらに感染するファージの多くは処理対象流域に住む人間の糞便に由来すると考えられる。この事実は健康な家畜とヒト糞便に病原菌とファージが共存していることを示す。見方を変えると、ファージが病原菌と共存したから病原菌の爆発的増殖を抑え、健康を維持しているとも解釈できる。この解釈がファージによる病原菌のコントロール、つまりファージセラピーに繋がる。生態系においてウイルスは一つの種が爆発的に増えることを押さえる働きをしている。もし衛生や医療の恩恵がなかったら、人口が今のように増えることはなく、インフルエンザやHIVの蔓延により適正規模に保たれていたのかもしれない。もっとも病気を治し健康に生活することは人間性の本質に関わることである。したがって、病気により人口を適正規模に維持すべきだという発想は無い。しかし、微生物生態系においてはファージにより病原菌の異常増殖を押さえる発想 (ファージセラピー) があってもよいように思う。
文献
1) Jim, D. K., Bacteriophage T4 (1994).
2) Morita, M., Tanji, Y., Mizoguchi, K., Akitsu, T., Kijima, N., Unno, H.: FEMS Microbiol. Letter, 211, 77 (2002).
3) Tanji, Y., Shimada, T., Yoichi, M., Miyanaga, K., Hori, K., Unno, H.: Appl. Microbiol. Biotechnol., 64, 270 (2004).
4) Oda, M., Morita, M., Unno, H., Tanji, Y.: Apple. Env. Microbiol., 70, 527 (2004).
5) Tanji, Y., Furukawa, C., Suk-Hyun, N., Hijikata, T., Miyanaga, K., Unno, H.: J. Biotechnol., 114, 11 (2004).
6) www.maff.go.jp/syoku_anzen/2003111 0/giji.pdf
7) Kuang, Y., Tani, K., Synnott, A. J., Ohshima, K., Higuchi, H., Nagahata, H., Tanji, Y.: Biochem. Eng. J., 45, 76 (2009).
8) Kuang, Y., Jia, H., Miyanaga, K., Tanji, Y.: Appl. Microbiol. Biotechnol., 84, 135 (2009).
9) Synnott, A. J., Kuang, Y., Kurimoto, M., Yamamichi, K., Iwano, H., Tanji, Y.: Apple. Env. Microbiol, 75, 4283 (2009).