【トピックス】
過渡的複合体結晶構造解析による蛋白質電子伝達機構の構造生物化学
野尻正樹、小手石泰康、鈴木晋一郎
阪大院・理
1.はじめに
私たちが身体を維持し、それを働かせるにはエネルギーが必要である。地球上の生物は数十億年もの進化の歴史を経て、生命維持に必要なエネルギーを効率よく獲得する方法を作り上げている。植物や光合成細菌などは太陽からの光エネルギーを取り込み、一方、動物は食物を摂取し消費することで、最終的に化学エネルギーを蓄積している。生体中で起こるエネルギー変換機構のことを総称して "生体エネルギー変換" といい1)、1961年にMitchell (1978年にノーベル化学賞受賞) により提案された「ATP合成の駆動力は生体膜を介したプロトンの濃度勾配による」という "化学浸透圧 (仮) 説"2) がその根幹にある。生体中でプロトン濃度勾配を作る (汲みだす) ためには、電子の方向性ある (ベクトル的な) 移動 (伝達) が必須であり、最近、その主要構成蛋白質である光合成反応中心、bc1複合体、b6f複合体、そしてチトクロムc酸化酵素等の巨大膜蛋白質の立体構造が次々と明らかにされ、そのメカニズムの構造的基盤を築いている3-7)。
生体中における様々な蛋白質電子伝達機構のうち特にその解析が困難とされているのが、電子伝達蛋白質として機能するチトクロムc、ブルー銅蛋白質 (キュプレドキシン)、フェレドキシン、フラボドキシン等といった比較的小さな蛋白質と各種酸化還元酵素の間で起こる "蛋白質分子間電子伝達反応" である。一般に、電子伝達パートナー分子同士によって形成される過渡的な複合体は弱く短寿命な一過性のものであり、それは生体中において分子間電子伝達反応を効率よく繰り返し行うために必要な物理化学的特性である。しかしながら、その不安定さからこれまでに複合体形成時の立体構造を高分解能で解析した例は非常に少なく (プロテイン・データ・バンク (PDB) にも十数例しかない)、その反応メカニズムを詳細に理解することは難しく且つ非常に興味深い研究対象とされている。
我々は、チトクロムc酸化酵素等の好気呼吸系に比べ比較的研究が遅れている嫌気呼吸系の "脱窒" に焦点をあて、その系内で起こる電子伝達蛋白質 (チトクロムc) と亜硝酸還元酵素の過渡的電子伝達複合体の立体構造をX線結晶構造解析により明らかにすることに成功したのでここに紹介する。
2.脱窒と亜硝酸還元酵素
生物にとって必須元素の1つである窒素は大気中に存在する分子状窒素をはじめ、硝酸塩、アンモニウム塩等のような低分子化合物から生体中の蛋白質や核酸等に至るまで、様々な形で自然界に存在し形を変えながら循環している。土壌や海水中の微生物において、硝酸、亜硝酸 (塩) 等の窒素酸化物を分子状窒素にまで段階的に還元してエネルギーを得るプロセスを「脱窒」と呼ぶ (嫌気呼吸系の1つであり硝酸塩呼吸または異化的硝酸還元ともいう、Scheme 1)8)。
NO3- → NO2- → NO → N2O → N2 ------ (Scheme 1)
脱窒の各段階は個々の酵素が働いており、そのうち、亜硝酸イオンを一酸化窒素へ1電子還元する反応を触媒するのが、亜硝酸還元酵素 (Nitrite Reductase, NIR) である8)。NIRによる亜硝酸イオンの1電子還元反応はScheme 2のような反応式で表すことができ、
NO2- + e- + 2H+ → NO + H2O ------ (Scheme 2)
NIRは一連の脱窒プロセスにおいて気体生成物 (NO、N2O、N2) を生じる最初のステップを触媒するため、脱窒の進行を司るキーエンザイムの1つとして広く認識されている。本酵素は活性中心に金属を持つ可溶性の金属蛋白質で、保有する金属ならびに補欠分子により大きく2種類に分類される。1つはヘムを持つタイプ (cd1NIR) であり、もう1つは銅原子を持つ銅含有NIR (CuNIR) である。興味深いことに、この両者は排他的であり同一菌体内で共存することはない。
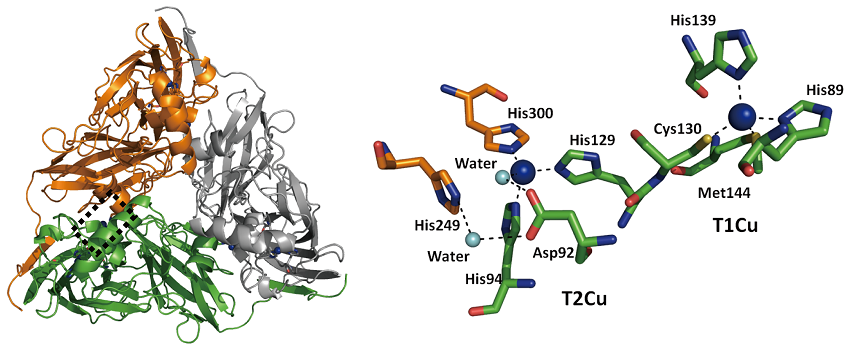
これまでに結晶構造が報告されている6 種類の CuNIR9-14) は、Hyphomicrobium種の六量体CuNIR13) を除くすべて、2種類の銅イオン (タイプ1銅とタイプ2銅) を1個ずつ結合したサブユニット3つからなる三量体構造 (分子量11 万で銅を合計6個含む) をとっている (図1)。分子量約3.7万のサブユニット単体は、約8本のβ鎖の束からなるβ-バレル構造 (キュプレドキシン-ホールドともいう) を2つ持った構造をしている。また、銅部位においてはいずれも歪んだ四面体四配位のタイプ1銅とタイプ2銅が、-ヒスチジン残基 (His129) -システイン残基 (Cys130) -のアミノ酸残基によって架橋され、約12.5Å離れて位置している。さらに、タイプ2銅の周りには[タイプ2銅配位水分子-アスパラギン酸残基 (Asp92) -水分子-ヒスチジン残基 (His249) ]の水素結合ネットワークがあり、基質 (NO2-) へのプロトン供給を担っている。本酵素はまず、タイプ1銅部位で電子供与 (伝達) 蛋白質から電子を受け取り、His-Cys架橋構造を経由した蛋白質内電子移動によりタイプ2銅に電子を送る。次に還元されたタイプ2銅部位でNO2-がNOに還元されて触媒反応が進行する。

CuNIRへ電子を供給する電子伝達蛋白質 (酸化還元パートナー) は何か?この問いに対する答えは、初めてCuNIRの結晶構造が解かれた1991年から現在に至るまで複数の研究グループにより様々な説が唱えられている。CuNIRを持つ脱窒菌株種によっても異なるが、最も研究が進んでいるものは、ブルー銅蛋白質のシュードアズリン (PAz) とアズリン (Az)、そしてヘム蛋白質のチトクロムcで (Cytc) である。特に、脱窒菌Achromobacter xylosoxidans (Axと略す) においては、Azを唱えているグループとCytc-551を主張している当グループとで長年の間、論争を繰り広げてきており、今回のAx由来のCuNIRとCytc-551の過渡的電子伝達複合体の結晶構造解析に成功したこと15) と、さらにAz、Cytc-551、そしてCuNIRを組み合わせた電子移動反応の速度論的解析16) から、その終止符を打つことができたと考えている。
3.CuNIRとCytc-551の複合体結晶構造
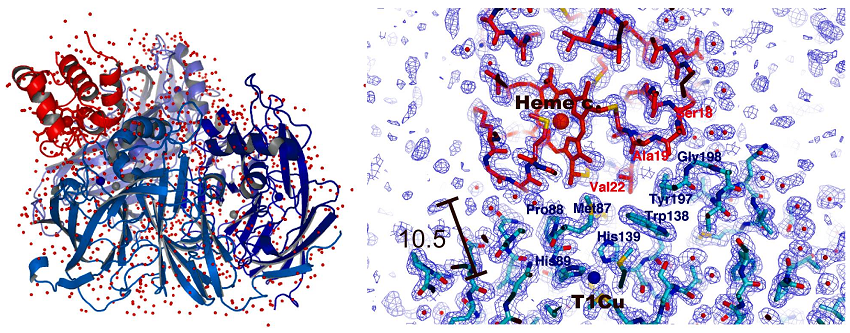
Cytc-551 (551は還元型c型ヘムのα吸収帯のピークトップ波長を意味する) は分子量約1万の弱塩基性蛋白質で、その立体構造はこれまでに様々な生物種に由来するものが数多く報告されている。またCytcに限らずPAz、Az等の立体構造も数多く報告されている。CuNIRについても上述のように現在6種の立体構造が報告されており、立体構造を基にした相互作用領域を明らかにする為の研究がさかんに進められてきた。生化学的には化学修飾、部位特異的変異導入等の手法により、主にPAzとCuNIR双方の相互作用領域が粗く同定されていた。また、構造生物学的には、PAzとCuNIRの立体構造上の静電ポテンシャルを基にした複合体モデルが1996年に提唱されており17)、つい最近 (2008年) オランダ・ライデン大学の研究グループがCuNIRとPAzの過渡的相互作用についてNMRで解析し、その解析から示唆された複合体構造モデルも提案されている18)。しかしながら、蛋白質間相互作用や分子間電子伝達のメカニズムをより直接的に研究する為には、電子供与蛋白質とCuNIR複合体の立体構造解析が必要不可欠であり、幾つかのグループで複合体の結晶化が試みられてきたが、成功には至っていなかった。そこで我々は、脱窒菌Ax由来のCuNIRとその電子供与体Cytc-551の複合体結晶化を試み、PEGを中心に結晶化条件の検索を進めたところ、19% (w/v) PEG3350を沈殿剤としたときに、薄紫色 (ヘムの赤色とタイプ1銅の青色の混在した色) の針状晶を得た。この結晶を用いてSPring-8 BL44XU (大阪大学蛋白質研究所: 生体超分子複合体構造解析ビームライン) においてX線回折強度データの収集を行い、その立体構造を1.7Åで決定することに成功した (図2)。

3-1 相互作用領域
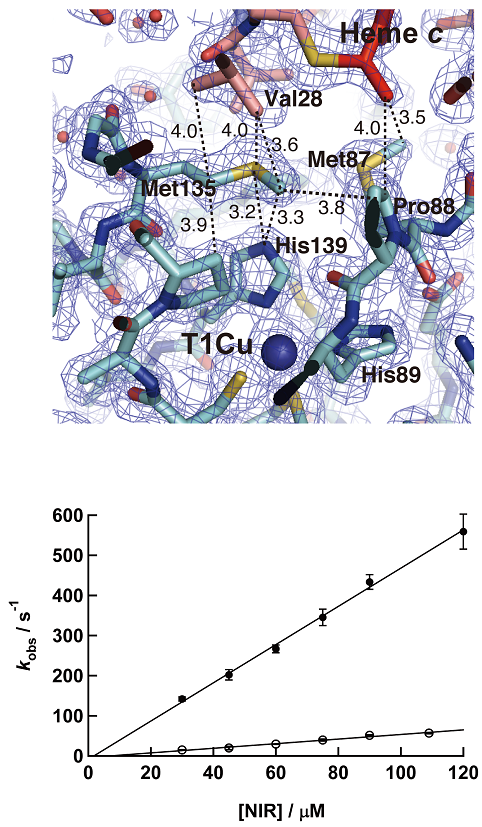
結晶中のCytc-551とCuNIRは1対1 (CuNIRは三量体) で複合体を形成していた。Cytc-551の酸化還元中心であるヘムcと、CuNIRの電子受容部位であるタイプ1銅原子は、複合体構造中で大変近い位置関係にあった。ヘムcのCBC炭素原子とタイプ1銅までの距離が10.5Å、ヘムcのCBC炭素原子とタイプ1銅周辺アミノ酸残基であるPro88のCd炭素ならびにMet87のCe炭素までの距離がそれぞれ4.0、3.5Åであった (図2)。これらの距離は量子力学的に電子伝達が行われると考えるのに十分な近さであった19)。Cytc-551およびCuNIR双方から合計21アミノ酸残基がCytc-551とCuNIRの分子境界にある会合領域に位置しており、その会合領域の面積は双方合計で約1000Å2であった。この面積値は、これまでに報告されている他の電子伝達蛋白質複合体構造でみられるものと同程度であり、複合体構造の安定性ならびに会合/解離のバランスを決める重要なファクターの1つとされている20)。境界面に存在する原子の半分以上は疎水性であり、Cytc-551の4残基 (Val22、Val28、Ala61、およびPro63) とCuNIRの3残基 (Ala86、Met87、およびTrp138) が双方の酸化還元中心近傍に疎水的な環境を過渡的に構成して、お互いの酸化還元中心間で直接電子伝達されるのに適した環境を作り出していると考えることができる。また、違う見方をすれば、お互いの酸化還元中心間に水分子が入り込む程に隙間が空かないくらい近づいて相互作用していることになる。
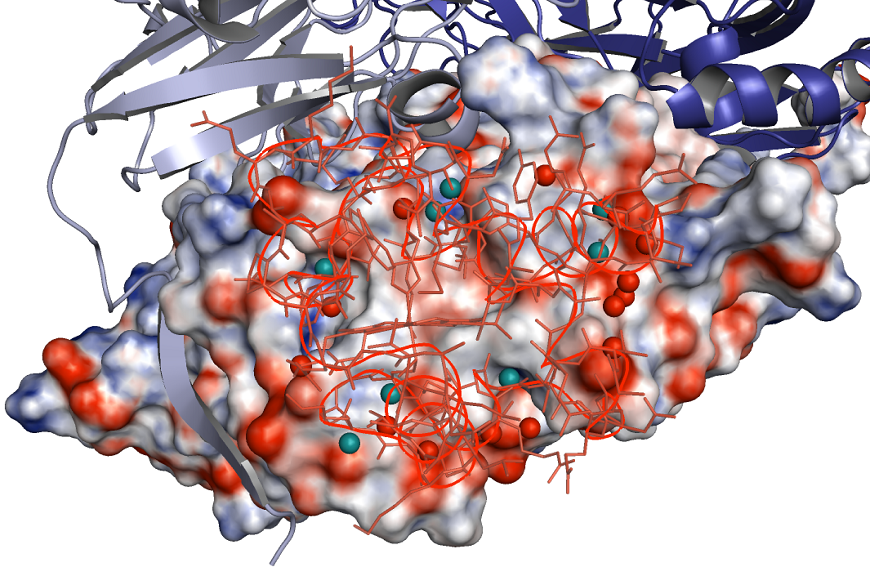
これまで単独の構造解析からCytc-551のヘム近傍表面とCuNIRのタイプ1銅近傍表面には小さな疎水性領域 (パッチ) があり水分子がまばらに点在することがわかっていたが、興味深いことに、それらの水分子は複合体を形成することで相互作用境界面の中心 (コア) から排除されていた (図3)。これは、お互いの相互作用部位に疎水的アミノ酸残基を多くすることでその部位表面での水分子の数を減らし、分子間相互作用時の水分子排除に係るエネルギーロスを最小限にしながらお互いの酸化還元中心を最も接近させるといった、生物が進化の歴史を経て獲得した分子間電子伝達反応機構における分子戦略なのかもしれない。

3-2 複合体形成に伴うCuNIRの構造変化
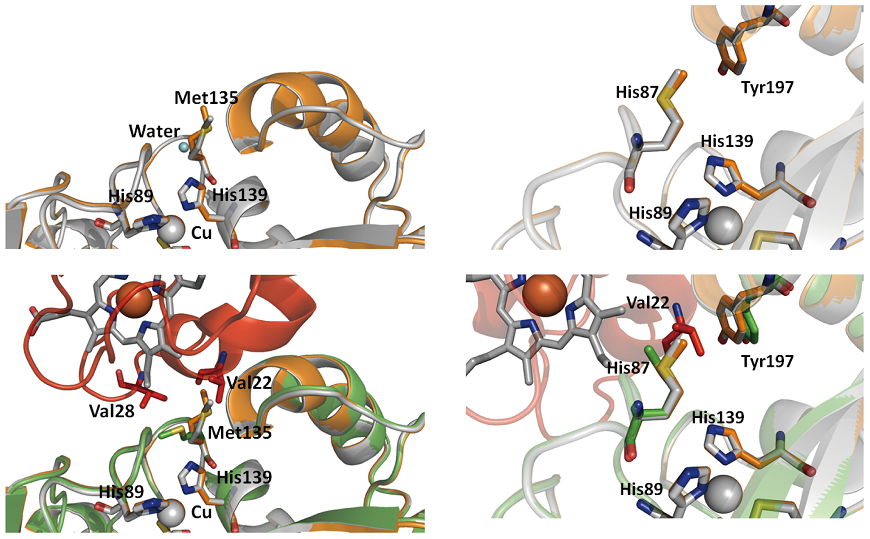
今回決定した複合体結晶構造では1対1で両分子が相互作用していた。すなわち、CuNIRはホモ三量体構造なので、残りの2つのサブユニットはフリーのままである。そこで、Cytc-551が結合していないサブユニットと結合したサブユニット構造を比較したところ、興味深い構造変化を確認することができた。両サブユニットの立体構造の重ね合わせ図からも明らかなように、Met87、Met135、Tyr197の側鎖構造に比較的大きな変化が見られた (図4)。特にMet135の側鎖構造は複合体形成時には、Cytc-551からのVal残基の接近によりタイプ1銅配位子の1つであるHis139の上部に覆いかぶさるような構造をとるが、結合していないサブユニットでは溶媒領域方向へ向いていた。その結果、Cytc-551が結合していないサブユニットでは、His139の上部には水分子が1つ水素結合距離内 (2.8Å) に存在している。すなわち、Cytc-551が結合するか否かで、タイプ1銅配位子のHis139周りの環境が変化していることになる。このHis139残基はタイプ1銅を含有する蛋白質特有の "溶媒露出His配位子" と呼ばれる残基で、その残基周辺の環境変化がドラスティックにタイプ1銅の酸化還元電位に影響を及ぼすことが知られている21)。すなわち、今回得られた複合体構造は、Cytc-551が相互作用することによりタイプ1銅配位His残基の環境が変化し、スムーズな分子間電子伝達が起こるようにタイプ1銅の酸化還元電位を調節していることを強く示唆させるものだった。そして、その役割を担う残基の1つがMet135残基である。その証拠の1つにMet135をSerに変異させるとCytc-551からCuNIRへの電子移動速度定数が約10分の1に低下する (図5)。これまで数多くCuNIRの変異体解析実験が報告されているが、このMet135残基を変異させた実験は本研究が初めてであり、これまで完全に見落とされていた重要な残基の1つを同定出来たことになる。今後、Met135Ser変異体とCytc-551の複合体やさらなる相互作用に関わる様々な残基の変異体を構築しその複合体結晶構造解析を行うことにより、より詳細な反応メカニズムの構造的基盤が構築されるであろう。


4.おわりに
本研究におけるCuNIRとCytc-551の電子伝達系は、地球上の窒素循環のバランスを保つために重要な役割を担う「脱窒」プロセスの一端をなす。本研究により、これまで解析が困難であった両蛋白質分子間の分子認識メカニズムと分子間電子伝達メカニズムをより正確に理解することができ、原子レベルで地球上の窒素レベルをコントロールするデバイス開発への可能性を広げることが出来ると考えられる。また、近年の地球温暖化への危惧から、二酸化炭素と肩を並べる温室効果ガスとして脱窒プロセスから発生する「亜酸化窒素 (N2O) ガス」が注目されており、地球上の窒素循環をコントロールする技術は二酸化炭素に続き期待される次世代技術と言っても過言ではない。そして、蛋白質-蛋白質の分子間相互作用は、地球上の生命 (細胞) 全てが持つ機能であり、その強さ、特異性、結合/解離バランスがその分子環境に応じて巧みにコントロールされている。この機能を発揮する1つの要因は "蛋白質ならでは" の「柔軟性」であり、本研究成果は、そういった柔軟性を取り入れた分子スイッチ等への開発技術へも大きく貢献し得ると期待される。
最後に、本研究のX線回折実験は大型放射光施設 (SPring-8) の大阪大学蛋白質研究所専用ビームライン・生体超分子構造解析ビームラインBL44XUを利用して行われました。関係諸先生方に深く感謝いたします。
また、本研究は科学研究費補助金と住友財団「基礎科学研究助成」の援助のもとに行われました。
文献
1) 垣谷俊昭、三室 守: 電子と生命, 共立出版 (2000).
2) Mitchell, P.: Nature, 191, 144 (1961).
3) Deisenhofer, J., Epp, O., Miki, K., Huber, R., Michel, H.: Nature, 318, 618 (1985).
4) Xia, D., Yu, C. -A., Kim, H., Xia, J. -Z., Kachurin, A. M., Zhang, L., Yu, L., Deisenhofer, J.: Science, 277, 60 (1997).
5) Kurisu, G., Zhang, H., Smith, J. L., Cramer, W. A.: Science, 302, 1009 (2003).
6) Iwata, S., Ostermeier, C., Ludwig, B., Michel, H.: Nature, 376, 660 (1995).
7) Tsukihara, T., Aoyama, H., Yamashita, E., Tomizaki, T., Yamaguchi, H., Shinzawa-Itoh, K., Nakashima, R., Yaono, R., Yoshikawa, S.: Science, 269, 1069 (1995).
8) Zumft, W. G.: Microbiol. Mol. Biol. Rev., 61, 533 (1997).
9) Godden, J. W., Turley, S., Teller, D. C., Adman, E. T., Liu, M. Y., Payne, W. J., LeGall, J.: Science, 253, 438 (1991).
10) Dodd, F. E., Beeumen, J. V., Eady, R. R., Hasnain, S. S.: J. Mol. Biol., 282, 369 (1998).
11) Murphy, M. E. P., Turley, S., Kukimoto, M., Nishiyama, M., Horinouchi, S., Sasaki, H., Tanokura, M., Adman, E. T.: Biochemistry, 34, 12107 (1995).
12) Jacobson, F., Guo, H., Olesen, K., Okvist, M., Neutzea, R., Sjolin, L.: Acta Crystallogr., D61, 1190 (2005).
13) Nojiri, M., Xie, Y., Inoue, T., Yamamoto, T., Matsumura, H., Kataoka, K., Deligeer, Yamaguchi, K., Kai, Y., Suzuki, S.: Proc. Natl. Acad. Sci. USA, 104, 4315 (2007).
14) Boulanger, M. J., Murphy, M. E. P.: J. Mol. Biol., 315, 1111 (2002).
15) Nojiri, M., Koteishi, H., Nakagami, T., Kobayashi, K., Inoue, T., Yamaguchi, K., Suzuki, S.: Nature, 462, 117 (2009).
16) Koteishi, H., Nojiri, M., Nakagami, T., Yamaguchi, K., Suzuki, S.: Bull. Chem. Soc. Jpn., 82, 1003 (2009).
17) Kukimoto, M., Nishiyama, M., Tanokura, M., Adman, E. T., Horinouchi, S.: J. Biol. Chem., 271, 13680 (1996).
18) Vlasie, M. D., Fernandez-Busnadiego, R., Prudencio, M., Ubbink, M.: J. Mol. Biol., 375, 1405 (2008).
19) Page, C. C., Moser, C. C., Chen, X., Dutton, P. L.: Nature, 402, 47 (1999).
20) Janin, J., Bahadur, R. P., Chakrabarti, P.: Q. Rev. Biophys., 41, 133 (2008).
21) Canters, G. W., Kolczak, U., Armstrong, F., Jeuken, L. J., Camba, R., Sola, M.: Faraday Discuss., 116, 205 (2000).