【トピックス】
インフルエンザ
深田勝彦、来海和彦
化血研
1.はじめに
今年3月に始まった豚由来の新型インフルエンザウイルス (H1N1型) のヒトへの感染は、WHOの警戒水準が4月末にフェーズ3から4へ、更に5へと相次いで引き上げられ、6月には最も高いフェーズ6が宣言された。1968年の香港型インフルエンザ以来、約40年ぶりにパンデミックインフルエンザが発生した。日本では当初、国際空港での水際対策がとられたものの、7月下旬には5000人を超える感染者となっている1)。ウイルスの病原性は季節性インフルエンザ程度であるが、今後ヒト間での感染を繰り返すうちにウイルスが変異して病原性が強くなり、深刻な新型インフルエンザへと変化することが懸念されている。
その一方で、1997年に香港で初めて発生した鳥由来の高病原性インフルエンザウイルス (H5N1型) のヒトへの感染は、2003年以降東南アジア、中国を中心に中東、アフリカ大陸へと広がりを見せている。ヒトでの病原性は非常に強く、2003年以降現在までに感染者の約60%が死亡している2)。今のところヒト間での感染力が弱くて感染拡大が起こってないが、今後も予断を許さない状況と考えた方がよい。次のパンデミックインフルエンザはこのウイルスではないかと危惧され、今般の豚インフルエンザウイルス (H1N1型) に先行して、各国でワクチン開発を中心とした多方面からの感染対策が進められた。
インフルエンザウイルスに関して酵素工学的手法を用いた研究は少ないが、インフルエンザウイルスと酵素との関わりは非常に深く、ウイルス自身が持つ酵素だけでなく感染宿主の酵素との関わりも重要である。ウイルスのもつ酵素が1アミノ酸変異するだけで、感染性、宿主域が変化することもわかっている3-5)。このような観点から、インフルエンザと酵素との関わりについても触れていきたい。
インフルエンザは、インフルエンザウイルスが引き起こす呼吸器の急性感染症である。ヒトでの主要な症状は、急速な発熱、悪寒、頭痛、全身倦怠感、筋肉痛であり、咽頭痛、鼻汁、咳などの呼吸器症状を伴う。腹痛、嘔吐、下痢といった胃腸症状を伴う場合もある。小児、高齢者、基礎疾患を有するハイリスクグループで肺炎などの重篤化することが大きな問題となっている。インフルエンザウイルスは、自然宿主であるマガモやアヒルなどの野生水禽、鶏や七面鳥などの家禽、豚や鳥や馬、実験動物として用いられるマウスやモルモットやフェレットなど、ヒト以外にも多くの動物種に感染する人獣共通感染症でもある。ただし、野生水禽や豚などに対しては強い病原性を示すことはない。
インフルエンザウイルスには、ウイルス内部蛋白質の抗原性の違いによりA・B・Cの3型があり、このうち主にA型とB型が毎年冬季に発生しているヒトの季節性インフルエンザの原因になっている。
2.インフルエンザウイルスと酵素の役割
インフルエンザウイルスはオルソミクソウイルス科に属するウイルスで、直径が約80~120 nmのエンベロープを持つマイナス鎖の1本鎖RNAウイルスである (図1A)。エンベロープの表面にはヘムアグルチニン (HA) とノイラミニダーゼ (NA) の2種類のスパイク蛋白を持っている。その内側にはマトリックス蛋白 (M1、M2) があり、M1はエンベロープを裏打ちするように、M2はエンベロープ上にイオンチャンネルを形成している。エンベロープ内部には8本の分節に分かれた1本鎖ウイルスRNAがヌクレオカプシドとして存在する特徴的な構造をしている (図1B)。それぞれのウイルスRNAはヌクレオプロテイン (NP) に巻き付いており、それぞれのヌクレオカプシドにはRNA依存性RNAポリメラーゼ複合体が結合する (図1C)。
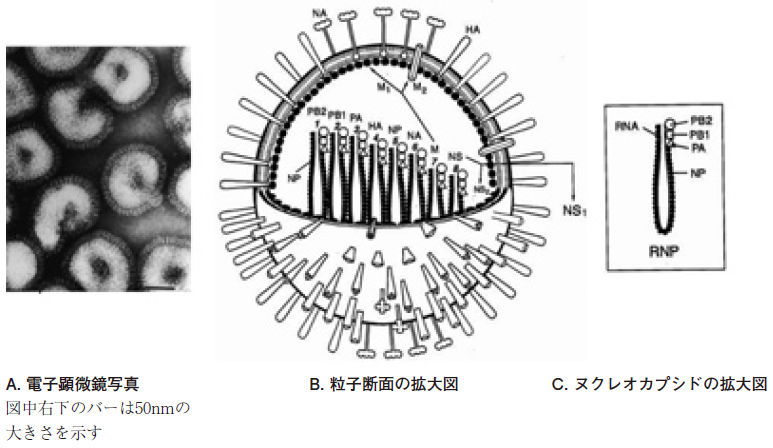
図1 インフルエンザウイルスの模式図 文献8)より一部改変
インフルエンザウイルスは変異し易い。エンベロープ表面のHAとNAの変異が特に多く、A型ウイルスでは抗原性の違う16種のHA (H1~H16) と9種のNA (N1~N9) がある。ウイルスRNAが8本の分節に分かれている構造上、1つの細胞に異なるウイルスが共感染した時にはウイルスRNAがシャッフルされ、新しいHAとNAの組み合わせを持つウイルスが生まれることが可能である。理論的には16×9=144の亜型が考えられるが、自然界から分離された亜型は半数にも満たない6)。近年冬季に発生しているヒトの季節性A型インフルエンザは、H1N1亜型及びH3N2亜型である。B型、C型インフルエンザウイルスは変異が比較的少なく、亜型は存在しない。
インフルエンザウイルスの酵素は、計4種である。1つはノイラミニダーゼ活性 (シアリダーゼ活性) をもつNA、残りはPB1、PB2、PAである。このうちPB1、PB2、PA (分子量約96、87、85kDa7) ) は、RNA依存性RNAポリメラーゼ複合体を形成している (図1C)。PB2は宿主細胞由来のCap構造をもつRNAを認識し、PB1は宿主細胞RNAのCap構造下流部をそのendonuclease活性により切断してウイルスmRNA合成のプライマーとして利用する役割をもつ。PAはRNA依存性RNAポリメラーゼの制御に寄与していることが明らかになっている。インフルエンザウイルス自身がもつ酵素は宿主細胞中には存在しない限られた酵素のみであり、ウイルスが複製・増殖するために必要なその他の酵素は宿主細胞に依存している。
インフルエンザウイルスの感染は、宿主細胞由来のトリプシン様セリンプロテアーゼによるHAの開裂によって可能になる。HAは、前駆体のHA0 (分子量約76kDa) として発現される。トリプシン様セリンプロテアーゼは、HA0のコンセンサス配列Q(E)-T/X-R-Gを認識して切断し、HA1とHA2 (分子量約47、29kDa) に開裂させる。これによりHAの構造変化が可能になり、HA1の細胞膜融合領域が露出する。膜融合領域が細胞表面のシアル酸に吸着してウイルスと細胞が融合すると、感染が成立する。細胞内でRNA依存性RNAポリメラーゼ活性を利用して合成されたウイルス蛋白とウイルスRNAは、細胞の脂質二重膜を利用してウイルス粒子を形成し、細胞外へと放出される。その際NAのノイラミニダーゼ活性 (シアリダーゼ活性) により、ウイルスが細胞表面のシアル酸に吸着するのを防ぎ、細胞から遊離することが可能となる。
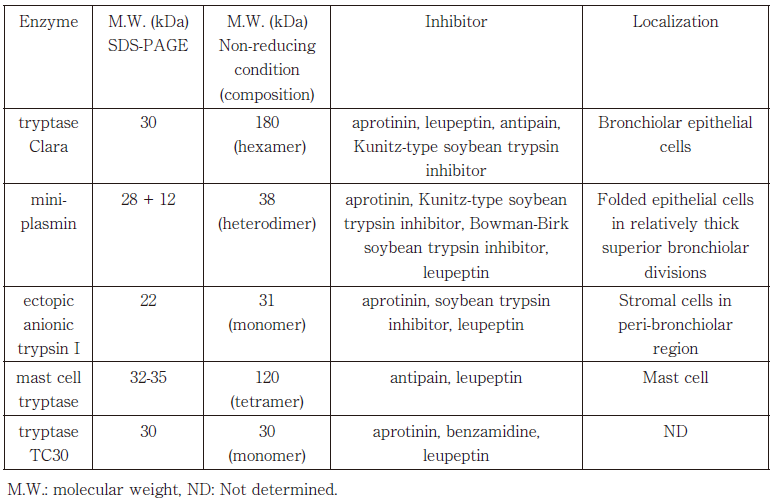
ヒトの季節性インフルエンザウイルスは、まず鼻腔や上気道で感染が起こる。上気道では、上皮系細胞から分泌されるtryptase ClaraやminiplasminによりHA0の開裂が起こり、ウイルス感染が可能になる。肺胞上皮では、異所性トリプシンがHA0開裂酵素としてはたらく。インフルエンザウイルスに作用できる宿主細胞由来のトリプシン様セリンプロテアーゼは、表1に示す通り5種同定されている9)。
表1 インフルエンザウイルスに作用できるトリプシン様セリンプロテアーゼ
文献9)より一部改変
3.季節性インフルエンザワクチン
日本では、1957年のアジア型インフルエンザの流行以降に本格的に季節性インフルエンザワクチンが導入された。当時は、精製したインフルエンザウイルスをホルマリン等で処理して感染性を失い不活化された、全粒子ワクチンと呼ばれるものであった。この全粒子ワクチンは、接種したときの局所反応がやや高いという難点があった。
現在日本で使用されているワクチンは「インフルエンザHAワクチン」である。これは、精製したインフルエンザウイルスをエーテル等で処理することにより脂質二重膜のエンベロープが溶解し、ウイルスが分解され不活化された、スプリットワクチンと呼ばれるものである。免疫原性は保ちつつ安全性を高めている。インフルエンザウイルス粒子は表面にHAやNAが見られる球形粒子であるが、エーテル処理を行うとワクチンの有効成分であるHAやNAが凝集したロゼットを形成し、花びら様の形状となる (図2)。
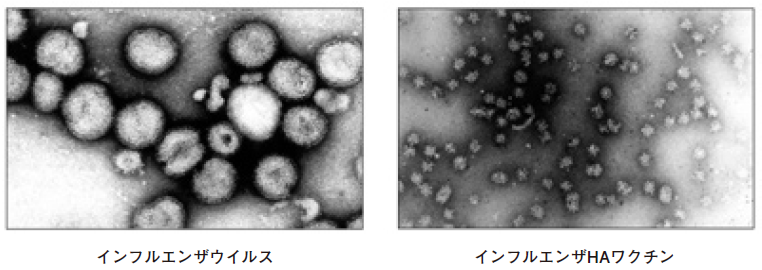
図2 インフルエンザHAワクチンの電子顕微鏡写真
ワクチン製造用インフルエンザウイルスの培養には、10~12日間孵化した孵化鶏卵 (有精卵) を用いる。有精卵はワクチン専用卵生産場で生産される。ワクチン製造開始6カ月前に雛を導入して成鶏群を育成し、ワクチン製造用の有精卵を準備する。鶏卵からひよこが孵化する日数は21日であるが、約11日間孵化した孵化鶏卵が最もインフルエンザウイルスの増殖がよく、良質のワクチン原液の原料となる。この時期の孵化鶏卵は、ウイルスが増殖可能な酵素群が十分に発現しているものと考えられる。
近年、孵化鶏卵に変えて細胞培養技術を用いた季節性インフルエンザワクチンの開発が進められている。高品質な孵化鶏卵は、ワクチン製造量を決定してから時間をかけて計画的に生産しなければならず、緊急な需要には対応できない。インフルエンザウイルスを孵化鶏卵で培養するとワクチンの有効成分であるHAが変化し、実際の流行株と抗原性にずれが生じる可能性も否定できない。これに対して細胞培養技術を用いた場合は、大規模のタンク培養で培養回数を増やすことで比較的容易に増産可能である。HAの抗原性変化も生じないことが示されている10)。すでに海外では、MDCK細胞やVero細胞を用いたインフルエンザワクチンの製造販売が認可されている。また、PER.C6細胞やEB細胞を用いた開発も進んでいる。日本においても、国主導で本格的な開発が始められたところである。これら全ての細胞培養技術によるウイルス培養時には、ウイルス株による至適濃度の違いはあるものの、培地へのトリプシン添加が必須であり、その活性を阻害する物質を含む血清培地は使用できない。
4.新型インフルエンザとワクチン
新型インフルンザなどのある特定の感染症が世界的に流行することをパンデミックと呼ぶ。インフルエンザの場合、20世紀以降3回の世界的流行があり、1918年のスペインインフルエンザ、1957年のアジア型インフルエンザ、1968年の香港型インフルエンザがそれで、それぞれA型ウイルスのH1N1亜型、H2N2亜型及びH3N2亜型によって引き起こされた。
今年6月にパンデミックとなった豚インフルエンザウイルス (H1N1型) は、90歳以上の高齢者には免疫があることがわかってきている11)。よってこの新型ウイルスは、免疫原性が季節性A型インフルエンザウイルスと同程度であると期待され、現行の「インフルエンザHAワクチン」と同じスプリットワクチンの剤型が選ばれた。すでに7月下旬から新型インフルエンザワクチンの製造が行われている。
高病原性鳥インフルエンザウイルス (H5N1型) は、これとは状況が異なる。もっとも大きな違いは、免疫原性が低いこと、及び病原性が非常に強いことの2点である。前者の問題を解決するために、より強い免疫原性とワクチン抗原量の低減をコンセプトとして、アルミゲルアジュバントを配合した全粒子ワクチンの剤型が選ばれた。アルミアジュバントは、小児用ワクチンにも含まれ安全性が高いことも選ばれた理由である。後者に関しては、ヒトでの病原性に加え、ワクチン製造においても孵化鶏卵 (有精卵) を殺してしまい製造できない問題があった。この問題を解決するために、リバースジェネティクス技術12) を用いた遺伝子組換えウイルスの作出が行われた。
鳥インフルエンザウイルス (H5N1型) の非常に強い病原性は、HA0の開裂部位における連続した塩基性アミノ酸配列に起因する。塩基性アミノ酸が連続したHA0のコンセンサス配列R-K/R-K/R/X-Rを認識して切断可能な細胞由来の酵素は、多くの臓器に普遍的に発現しているfurinやpro-protein convertase 5/6などである9)。したがって、一度感染すると呼吸器系だけでなく全身の臓器でウイルスが感染・増殖できるようになる。低病原性の鳥インフルエンザウイルス (H5N1型) ではこのような連続した塩基性アミノ酸配列はみられない (図3)。
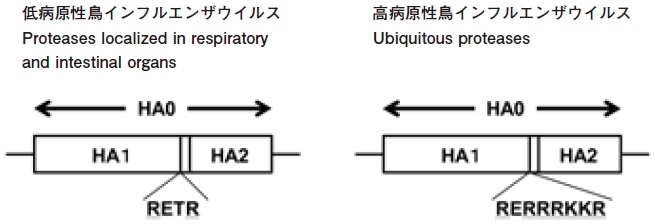
図3 高病原性と低病原性の鳥インフルエンザウイルス (H5N1型) のHA0開裂部位
ワクチン製造株の元となったウイルス株の1つであるA/Viet Nam/1194/2004株のHA0開裂部位付近のアミノ酸配列は、SQRERRRKKRGLである。この連続した塩基性アミノ酸領域の4塩基RRRKを欠失させ、かつ免疫原性は保持させたHAの遺伝子改変が行われた。この改変HAとNAの遺伝子をコードする2本のウイルスRNA分節、及びA/PR/8/34株由来のその他6本のウイルスRNA分節をもつ遺伝子組換えウイルスA/Viet Nam/1194/2004 NIBRG-14株が作出され、ワクチン製造株となった。
この遺伝子組換えウイルスを用いて製造された新型インフルエンザワクチン (H5N1型) は、国内のワクチンメーカー4所社 (デンカ生研、北里研究所、阪大微生物病研究会、化学及血清療法研究所) 共通のプロトコルで臨床試験が行われた。先に製造販売承認を受けた2つの新型インフルエンザワクチンの有効性評価によると、約3週間間隔で2回接種した3週間後の中和抗体価を指標とした陽転率 (抗体価4倍以上上昇率) は、いずれも70%以上であった。一方、安全性の評価は、現行のインフルエンザHAワクチンに比較すると、副反応の発生頻度はやや高いことが示されている13)。しかしながら、少なくとも重篤な副反応は観察されておらず、H5N1株の高い病原性や新型インフルエンザの蔓延を防止することを考慮すると、リスクベネフィットの観点からは認容されうるものと判断されている。
5.おわりに
これまで述べてきたように、インフルエンザウイルスと酵素の関係は非常に深く、ウイルスの感染は宿主細胞由来のトリプシン様セリンプロテアーゼがないと成立しない。鳥インフルエンザウイルス (H5N1型) の高病原性の原因とワクチン開発過程での病原性の除去においては、宿主細胞由来の酵素の役割解明とリバースジェネティクス技術が大きく貢献していると言える。
他方で、インフルエンザはワクチンだけでなく治療薬の開発も盛んである。すでにNA阻害剤が市販され広く使用されているが、最近になり薬剤耐性ウイルスの出現が大きな問題となっており14)、NA阻害剤とは違った作用機序による治療薬が望まれる。富山化学工業が開発中のインフルエンザ治療薬「T-705」は、ウイルス由来RNA依存性RNAポリメラーゼを標的とした阻害剤であり、ウイルスの遺伝子複製時に作用を示し、その増殖を防ぐ効果がある。新たな治療上の選択肢となる可能性がある。
今般のパンデミックインフルエンザだけでなく季節性インフルエンザにおいても、これらの蓄積された知見に基づいたより効果的なワクチンや治療薬の開発が進んでいくことが期待される。
謝辞
本原稿の執筆の機会を与えていただいた財団法人化学及血清療法研究所第一研究部部長中島敏博氏に、この場を借りて深く感謝申し上げます。
文献
1) 国立感染症研究所感染症情報センターのウェブサイト,http://idsc.nih.go.jp/disease/swine_influenza/index.html
2) WHOのウェブサイト,http://www.who.int/csr/disease/avian_influenza/en/
3) Subbarao, E. K., London, W., Murphy, B. R.: J. Virol., 67, 1761 (1993).
4) Hatta, M., Gao, P., Halfmann, P., Kawaoka, Y.: Science, 293, 1840 (2001).
5) Steel, J., Lowen, A. C., Mubareka, S., Palese, P.: ProS. Pathog., 5, e1000252. doi:10.1371 (2009).
6) Kida, H., Sakoda, Y.: Dev. Biol. (Basel)., 124, 69 (2006).
7) Lamb, R. A., Choppin, P. W.: Virology, 74, 504 (1976).
8) Wright, P. F., Webster, R. G.: In Fields Virology, Knipe, D. M. and Howley, P. M. (ed), Lippincott-Raven, Philadelphia, USA, 4th edition, 1533 (2001).
9) Kido, H., Okumura, Y., Yamada, H., Le, T. Q., Yano, M.: Curr. Pharm. Des., 13, 405 (2007).
10) Makizumi, K., Kimachi, K., Fukada, K., Nishimura, T., Kudo, Y., Goto, S., Odagiri, T., Tashiro, M., Kino, Y.: Vaccine, 26, 6852 (2008).
11) Itoh, Y., Shinya, K., Kiso, M., Watanabe, T., Sakoda, Y., Hatta, M., Muramoto, Y., Tamura, D., Sakai-Tagawa, Y., Noda, T., Sakabe, S., Imai, M., Hatta, Y., Watanabe, S., Li, C., Yamada, S., Fujii, K., Murakami, S., Imai, H., Kakugawa, S., Ito, M., Takano, R., Iwatsuki-Horimoto, K., Shimojima, M., Horimoto, T., Goto, H., Takahashi, K., Makino, A., Ishigaki, H., Nakayama, M., Okamatsu, M., Takahashi, K., Warshauer, D., Shult, P. A., Saito, R., Suzuki, H., Furuta, Y., Yamashita, M., Mitamura, K., Nakano, K., Nakamura, M., Brockman-Schneider, R., Mitamura, H., Yamazaki, M., Sugaya, N., Suresh, M., Ozawa, M., Neumann, G., Gern, J., Kida, H., Ogasawara, K., Kawaoka, Y.: Nature, 460, 1021 (2009).
12) Neumann, G., Watanabe, T., Ito, H., Watanabe, S., Goto, H., Gao, P., Hughes, M., Perez, D. R., Donis, R., Hoffmann, E., Hobom, G., Kawaoka, Y.: Proc. Natl. Acad. Sci. USA, 96, 9345 (1999).
13) 庵原俊昭: 臨床とウイルス, 36, 276 (2008).
14) Tamura, D., Mitamura, K., Yamazaki, M., Fujino, M., Nirasawa, M., Kimura, K., Kiso, M., Shimizu, H., Kawakami, C., Hiroi, S., Takahashi, K., Hata, M., Minagawa, H., Kimura, Y., Kaneda, S., Sugita, S., Horimoto, T., Sugaya, N., Kawaoka, Y.: J. Clin. Microbiol., 47, 1424 (2009).