【トピックス】
ヒドロキシニトリルリアーゼを用いた光学活性シアノヒドリンの合成
仙波 尚、土橋幸生、市毛栄太
(株) 日本触媒
1.はじめに
光学活性シアノヒドリンは、ヒドロキシニトリルリアーゼ (hydroxynitrile lyase, HNL) により、アルデヒドまたはケトンに青酸を付加させることによって合成される化合物である。本化合物は比較的簡単な有機合成を組み合わせることによって多岐にわたる光学活性化合物へ誘導体化できるため、光学活性医農薬合成用の中間体としての応用が期待されている (図1、図2)。
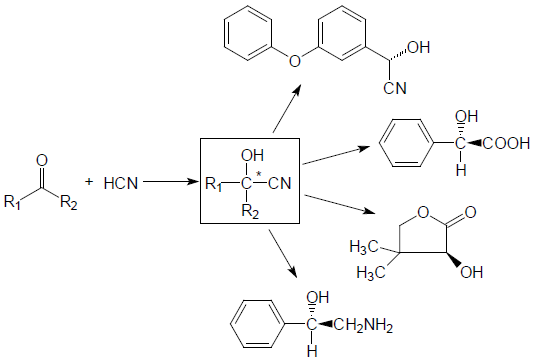
図1 光学活性シアノヒドリンおよび誘導体
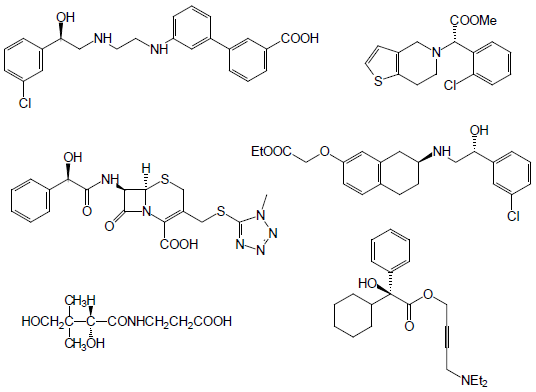
図2 光学活性シアノヒドリン誘導体から合成される光学活性医薬品
HNLは、青酸配糖体を含む植物由来のものが知られ、バラ科植物由来の (R)-ヒドロキシニトリルリアーゼとトウダイグサ科植物由来の (S)-ヒドロキシニトリルリアーゼがよく研究されている1-3)。これらHNLは、高い立体選択性を示すだけでなく、さまざまなアルデヒドやケトンに対して活性を有するという特徴がある。
本稿では、 (S)-ヒドロキシニトリルリアーゼの一つである、トウダイグサ科キャッサバ (Manihot esculenta) 由来のMeHNLを用いて実施した、 (S)-シアノヒドリンの実用的な生産プロセスの開発について紹介したい。
2.ヒドロキシニトリルリアーゼの大量生産
S-体のシアノヒドリンを合成する酵素としてトウダイグサ科のキャッサバやパラゴムノキ (Hevea brasilliensis) 由来の (S)-HNLが知られているが、いずれも植物組織中の含量が少なく、工業利用するためには組換え系を使った大量生産法の開発が必要であった4,5)。筆者らは、キャッサバ由来のMeHNLを組換え大腸菌を用いて大量生産する方法の開発を行った6)。キャッサバからクローニングした天然型のMeHNL配列を大腸菌pETシステムで発現を行ったところ、発現量はごくわずかであった。そこで、レアコドンの改変を行い、コドン使用頻度を大腸菌型に改変した結果、酵素発現量を増大させることができた。しかし、活性を示す可溶型MeHNLの量は、生産されたMeHNLのうちごくわずかであり、ほとんどが活性の無いインクルージョンボディとして生産されていたことがわかった。そこで、インクルージョンボディ形成を抑制するための手段として、低温培養を試みた。
一般に、インクルージョンボディ形成を抑制するための方法として、一旦菌体を増殖させてから培養温度を下げて誘導基質を添加してさらに培養を継続する方法が知られている。しかし、この方法は、フラスコレベルなら短時間で温度シフトが可能であるが、大型培養装置では、伝熱面積が小さくなるため容易な作業ではない。そこで、培養開始時点から誘導基質を添加し、温度をシフトさせるのではなく、培養初期から低温で培養を行い、MeHNLの生産を試みた。本検討の結果、至適培養温度の37℃での培養に比べ、培養温度を低下させるほど可溶型のMeHNLの割合が増加し、活性型MeHNLの生産量は大幅に増加した (図3)。低温培養条件では、代謝がゆっくりと進むため、タンパク質合成速度とフォールディング速度とのバランスが取れてきたため、正常なフォールディングが起こり易くなったからではないかと思われる。
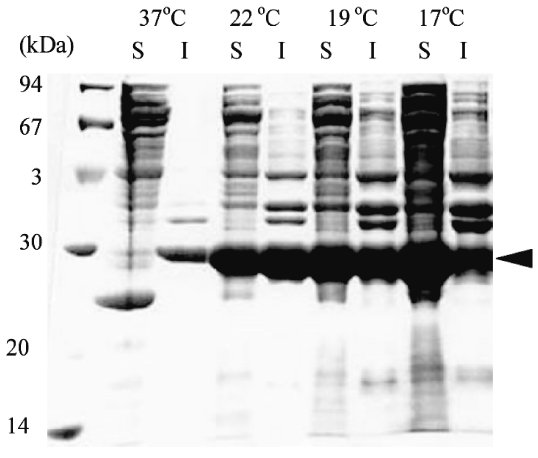
![]()
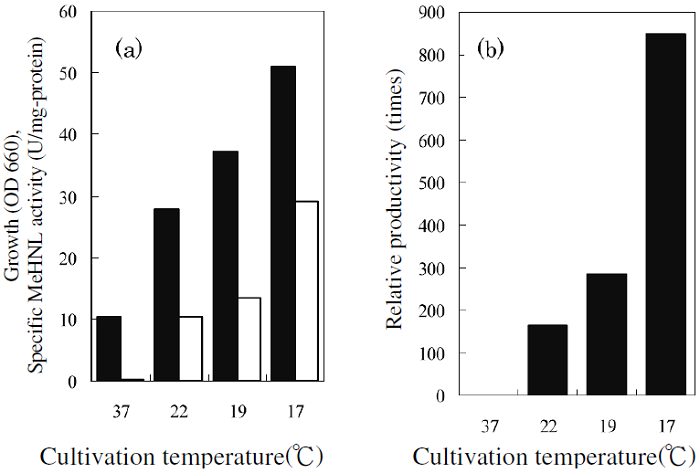
さらに、低温培養では、菌体収量も大幅に増加した。至適培養温度である37℃における培養では、短期間に溶存酸素が枯渇してしまうが、低温培養では、代謝が遅くなり、酸素消費速度が遅くなるために溶存酸素の枯渇が起こり難くなることがわかった。特に17℃で培養を行った場合には、37℃の培養に比べ、約5倍の菌体収量が得られた。低温培養下では、培養系内が好気的に維持されたため、基質が好気的に消費されたことでより多くのエネルギーが獲得できた結果、菌体量が増加したと考えられる。17℃の低温培養法によって、菌体収量は5倍増加し、単位菌体量当たりの酵素活性が170倍に増加したため、単位培養液当たりのMeHNL生産性を850倍に向上させることができた (図4)。

3. 固定化MeHNLによる光学活性シアノヒドリン合成反応
光学活性シアノヒドリン合成反応系として、セルロース系担体などを用いた固定化酵素反応系や水-有機溶媒二相系による反応方法などが報告されている7-9)。基質のアルデヒドおよび生産物のシアノヒドリンの水溶性が低いため、高濃度反応のためには有機溶媒系での反応が有利であること、そして、シアン化水素がシアナイドイオン (CN-) に解離する必要があるため、水の存在が不可欠であることから、このような反応系が採用されている。しかしながら、セルロース系担体は酵素の担持量が少ない上、水を含ませた場合に反応系中での均一分散が困難であるという問題があり、水-有機溶媒二相系では、エマルションを形成するような強い攪拌を行わなければ十分な反応速度を得られないという問題があった。
筆者らは、MeHNLを簡便に固定化することができ、強い攪拌を行わなくとも容易に均一分散でき、しかも、回分反応ばかりではなく、大量生産に適したカラム充填型連続反応への適用が可能な固定化MeHNLの開発を行った。固定化担体の探索の結果、シリカゲルなどの多孔性無機微粒子がMeHNLの固定化担体として最適であることを見出した (表1)10)。
表1 MeHNL固定化担体の探索

多孔性シリカゲル担体は自重とほぼ同重量の水を含むことができるため、有機溶媒系であってもシアノヒドリン化反応に必要な水分を保持することができる。また、緩やかな攪拌でも反応系中で均一に分散でき、濾過または、反応液との比重差を利用して容易に反応液と分離が可能であった。
固定化MeHNLを用いた (S)-マンデロニトリルの繰返し回分反応の結果を図5に示した。本固定化酵素は反応速度および光学純度の低下なしに20回以上の回分反応が実施できた。
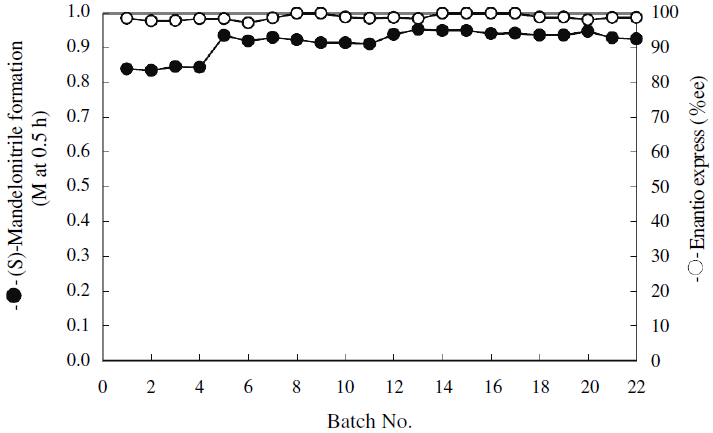
図5 固定化MeHNLを用いた繰返し回分反応による (S)-マンデロニトリル合成
4.酵素機能の改変による高性能化
MeHNLによる (S)-シアノヒドリン合成反応系では、非酵素的なラセミ体生成反応が同時に起こる。したがって、光学純度の高いシアノヒドリンを得るためには、非酵素的なラセミ体生成反応を抑制できる弱酸性領域での反応が有効である。しかしながら、pHを下げることは、酵素の安定性を損なうことになる。また、基質であるアルデヒドの種類によっても酵素の安定性に大きな差があることが見出された。そこで、工業生産に耐えうる耐久性の高いMeHNLの開発として、酵素分子の改変を行い、高耐久性改変酵素の開発を行った。
MeHNL遺伝子にerror-prone PCR法によってランダム変異を導入し、ランダム変異ライブラリーを構築した。このライブラリーから、加熱処理または低pH処理を行い、処理後も活性を有している変異酵素を、ピクリン酸呈色反応を利用したハイスループットスクリーニングにより選抜した。
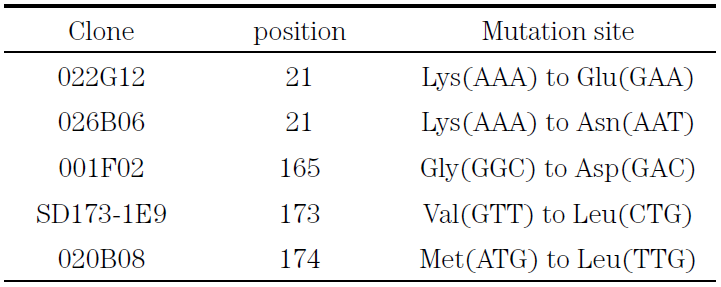
スクリーニングの結果、複数の耐熱性変異酵素を取得できた (表2)。MeHNLは、サブユニット2つが会合してなる、ホモダイマー酵素である。得られた変異酵素の変異部位を解析したところ、耐熱性および耐酸性変異酵素は、サブユニットの会合部位付近に変異を生じており、他方のサブユニットのアミノ酸残基とのイオン結合が強化された結果、耐久性が向上していると考えられた。
表2 変異型MeHNLの変異部位
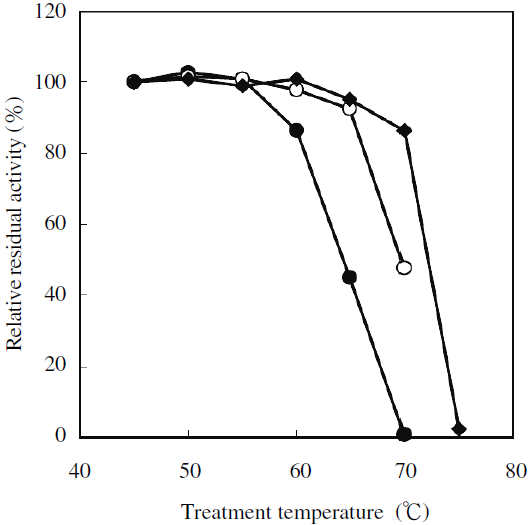
変異酵素の耐熱性を比較したところ、野生型酵素に比べ約5℃の耐熱性の向上が見られた。さらに変異部位を複合したところ、耐熱性は相加的に向上し、耐熱性変異2箇所を複合したものでは約10℃の耐熱性向上が見られた (図6)。また、耐熱変異MeHNLは有機溶媒に対する安定性も向上していることがわかった。MeHNLによる光学活性シアノヒドリン合成反応は、基質および生成物が水に難溶な場合が多く、高濃度反応のためには、有機溶媒系での反応が必須である。有機溶媒に対する安定性が向上したことは、実用上大変好ましい結果であった11,12)。
![]()
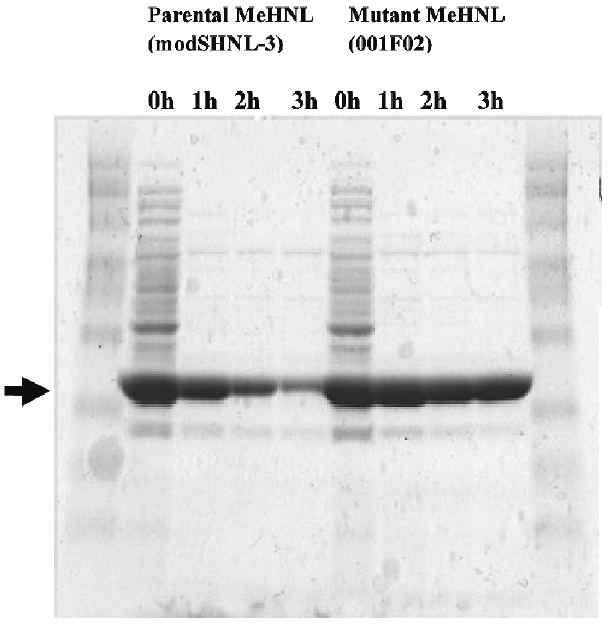
図7には、組換え大腸菌破砕液を加熱処理した際の上清のタンパク質組成変化を示した。天然型MeHNLの場合は、大腸菌由来の共雑タンパク質とともにMeHNLが熱変性し不溶化しているが、耐熱MeHNLでは、共雑タンパク質を選択的に変性除去することができ、加熱処理だけでMeHNLを精製できることが示唆され、工業規模での酵素精製がより簡便に実施できるようになった。
![]()
5.おわりに
不斉シアノヒドリン化は、有機合成的手法では困難な反応であり、高い光学純度で光学活性なシアノヒドリンを合成できるHNLは、工業的に実施できる唯一の触媒であるといってよいと思われる。本稿で述べた固定化酵素による光学活性シアノヒドリン合成反応は、MeHNLばかりではなく、アーモンド由来の (R)-HNLを用いても同様に実施でき、いずれかの酵素を選択することによって所望の光学活性シアノヒドリンを合成することが可能である。
本稿で紹介した改変MeHNLは低温培養によって大量生産できることをトンスケールの培養装置を用いて確認しており、固定化MeHNLを用いた (S)-シアノヒドリン合成反応もトンスケールでの生産が実施されている。
今後はMeHNLの基質特性の改変を行い、個々の基質に最適なMeHNLを開発するとともに、光学活性シアノヒドリンの誘導体化技術を発展させ、有用な光学活性中間体の幅を広げて行きたいと考えている。
謝辞
本稿におけるヒドロキシニトリルリアーゼの大量生産は、“平成14年度 産学官連携型産業技術実用化開発費助成金事業”の一環として、新エネルギー・産業技術総合開発機構 (NEDO) からの助成を受けた、京都大学今中忠行教授 (現立命館大学) と跡見晴幸准教授との共同研究の成果であり、改変型MeHNLの開発は“生物遺伝資源の産業利用促進に係る共同研究事業”の一環として、製品評価技術基盤機構 (NITE) の原山部門長 (現立教大学) と四十九俊彰博士 (現東北大学) との共同研究として実施しました。ここに感謝の意を表します。
文献
1) Becker, W., Pfeil, E.: Biochemishche Zeitschrift, 346, 301 (1966).
2) Selmer, D., Lieberei, R., Biehl, B., Conn, E. E.: Physiol. Plant., 75, 97 (1989).
3) Wajant, H., Forster, S., Bottinger, H., Effenberger, F., Pfizenmaier, K.: Plant Sci., 108, 1 (1995).
4) Hughes, J., Lakey, J. H., Hughes, M. A.: Biotechnol. Bioeng., 53, 332 (1997).
5) Hasslacher, M., Schall, M., Hayn, M., Bona, R., Rumbold, K., Luckl, J., Griengl, H., Kohlwein, S. D., Schwab, H.: Protein Expr. Purif., 11, 61 (1997).
6) Semba, H., Ichige, E., Imanaka, T., Atomi, H., Aoyagi, H.: Appl. Microbiol. Biotechnol., 79, 563 (2008).
7) Effenberger, V. F., Ziegler, T., Förster, S.: Angew. Chem., 99, 491 (1987).
8) Loos, W. T., Geluk, H. W., Ruijken, M. M. A., Kruse, C. G., Brussee, J., Van Der Gen, A.: Biocatal. Biotrans., 12, 255 (1995).
9) Bauer, M., Griengl, H., Steiner, W.: Enzyme Microbiol. Technol., 24, 514 (1999).
10) Semba, H., Dobashi, Y., Matsui, T.: Biosci. Biochem. Biotechnol., 72, 1457 (2008).
11) 特開2005-312431 株式会社日本触媒
12) 特開2007-89513 株式会社日本触媒