【トピックス】
大麻の幻覚活性を制御する酵素
森元 聡
九州大学大学院・薬学研究院
1.はじめに
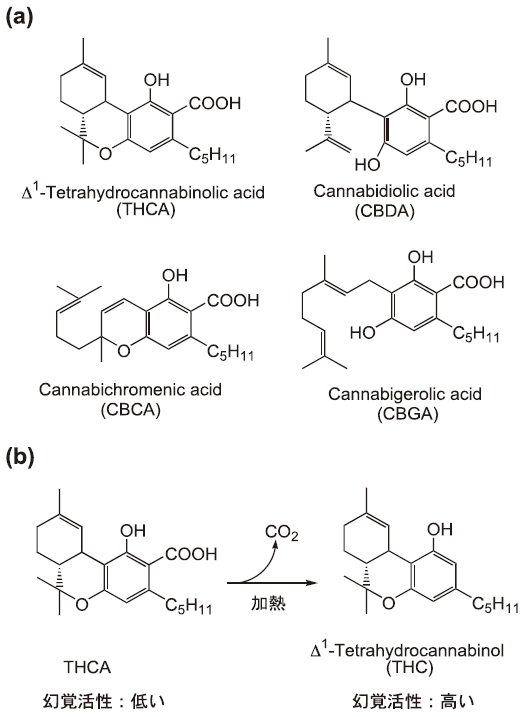
アサ (C. sativa) はアサ科に属する一年生草本で、代表的な繊維作物の一つである。本植物の未熟果穂や葉などを乾燥したものが、いわゆる大麻 (マリファナ) であり、古くから幻覚剤として使用されている。大麻の幻覚成分に関する本格的な研究は、20世紀半ばより開始され、カンナビノイドと称される多数の二次代謝産物が単離・構造決定されている (図1a)1)。カンナビノイドはモノテルペンとフェノールカルボン酸がカップリングした構造を持つ化合物で、アサのみに含まれているとされていたが、最近の研究によりアカザ科植物にも少量のカンナビノイドが含まれていることが報告されている2)。
図1 代表的なカンナビノイドの構造 (a) と大麻喫煙による幻覚活性の増強メカニズム (b)
カンナビノイドの中で、幻覚活性を示すのは Δ1-tetrahydrocannabinol (THC) やその類縁物質に限られている3)。ところが新鮮なアサにはTHCはほとんど含まれておらず、Δ1-tetrahydrocannabinolic acid (THCA) の形で生合成され、蓄積している4)。THCAは弱い幻覚活性しか示さないが、大麻を喫煙する際に加熱による脱炭酸を受けて、定量的にTHCに変換され、幻覚活性が著しく増強する (図1b)4)。アサにはTHCAが大量に蓄積する“メキシコ種”や低THCA含量の“とちぎしろ”などが知られており、後者のアサを基原とする大麻はほとんど幻覚活性を持たない5)。
したがって、大麻の幻覚活性は、アサのTHCAの生合成能力に大きく依存していると考えられる。THCAは数段階のステップを経て、生合成されることが報告されていたが、1990年代に入っても、各ステップを触媒する酵素に関しては、まったく研究が行われてなかった。筆者の研究室では、THCAをはじめとする各種カンナビノイドの生合成研究を行っている。本稿ではTHCAの生成を触媒する生合成酵素、すなわち大麻の幻覚活性を決定する酵素の特徴について紹介する。
2.酵素研究によるカンナビノイドの生合成経路の解明
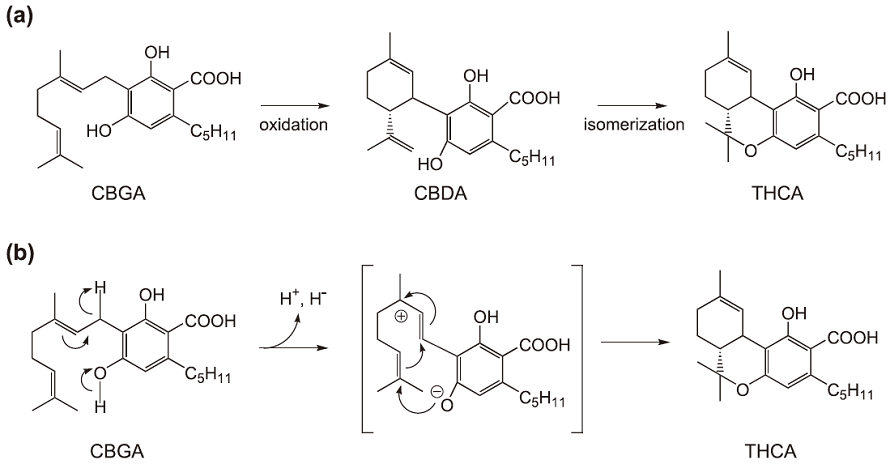
THCAの生合成経路に関しては、1970年にヘブライ大学のMechoulamが推定経路を提唱している6)。すなわち、cannabigerolic acid (CBGA) のテルペン部の酸化的な閉環によってcannabidiol (CBDA) が生成し、CBDAが異性化することによりTHCAが生合成されると推定している (図2a)。この仮説をもとに筆者らは、CBDAからTHCAの異性化反応を触媒する生合成酵素の活性の検出を試みた。

酵素の原料としてTHCAを大量に生産しているアサ (メキシコ種) を使用し、様々な条件を用いて検討したが、本酵素活性を検出することができなかった。そこで、Mechoulamの仮説とは異なる経路でTHCAが生合成されると考え、別の基質を用いて酵素活性を測定した。この結果、意外なことにCBGAを基質とした場合に、THCAの生成を触媒する酵素 (THCA合成酵素) の活性が観察された。したがって、THCAはCBDAを経由せずに直接CBGAから生合成されることが明らかとなった (図2b)7)。さらに、CBDAの生合成を触媒する酵素 (CBDA合成酵素) についても検討したところ、CBDA大量生産種のアサ (とちぎしろ) において、CBGAからCBDAへ変換する酵素活性が認められ8)、この生合成ステップに関しては、Mechoulamの仮説が正しいことが明らかとなった。CBGA からTHCAへの生合成ステップは、モノテルペン部の酸化的な閉環を伴うことから、本反応を触媒するTHCA合成酵素はoxidoreducatase の一種である。一方、CBDA合成酵素も、CBGAのテルペン部の酸化閉環反応を触媒することから、両合成酵素は同じ酵素群に属するものと考えられる。イソプレン (テルペンの構成ユニット) やテルペンの酸化閉環によって生成する二次代謝産物は、カンナビノイド以外にも高等植物から同定されているが、それらの生合成酵素に関しては精製や遺伝子クローニングもされておらず、研究が非常に遅れている。
3.THCA合成酵素の特徴
筆者らはアサからTHCA合成酵素とCBDA合成酵素の遺伝子をクローニングし、昆虫細胞による発現系を確立している。この系を利用して両合成酵素の特徴について様々な角度から解析を進めているが、本稿ではより研究が進展しているTHCA合成酵素について紹介する。
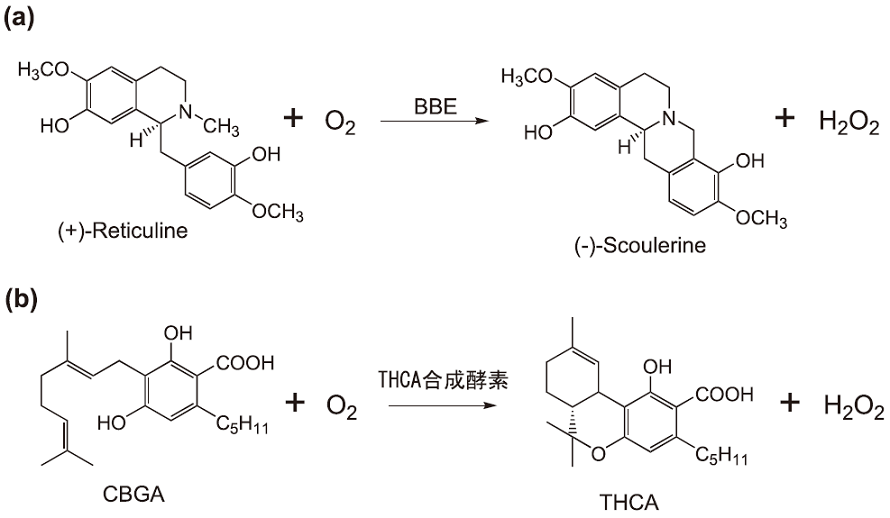
まず、THCA合成酵素の一次構造を解析したところ、1箇所のflavin結合部位と7箇所の糖結合部位が観察された9)。さらに、FASTAプログラムを用いて他のタンパク質とホモロジー検索を行った。この結果、THCA合成酵素はnicotine oxidase、 glucooligosacchride oxidase (GOOX)、berberine bridge enzyme (BBE) などのflavoproteinと20~40%程度のホモロジーを示した。これらの中で、高等植物に確認されている酵素はBBEであり、この酵素は (+) -reticuline (ベンジルイソキノリン型アルカロイド) を酸化閉環して (-) -scoulerine (プロトベルベリン型アルカロイド) を生成する (図3a)10)。BBEは基質を酸化する際に溶存酸素を要求し、生成物として過酸化水素を与えるが、THCA合成酵素も溶存酸素の存在下でCBGAを酸化し、THCAとともに過酸化水素を生成することを確認している (図3b)9)。アルカロイドとカンナビノイドはまったく異なる化合物群であるが、それらの生合成酵素の性質は互いに酷似していた。
図3 BBE (a) とTHCA合成酵素 (b) の反応スキーム
4.THCA合成酵素の活性部位
THCA合成酵素に、flavin結合部位が認められたことから、flavinが酵素活性に関与している可能性が推察された。この仮説を証明するためにflavinの結合部と推定されるHis114に変異を導入し、得られた変異体の性質を調べた。この結果、野生株で認められたFDAに特徴的な吸収スペクトルが、変化株では認められず且つ酵素活性もまったく観察されなかった9)。したがって、FADがTHCA合成酵素の活性部位の一部を構成していると考えられた。しかしながら、一次構造の解析のみでは、CBGAからプロトンを引き抜くアミノ酸 (すなわちbase として機能するアミノ酸) やテルペン部の閉環を制御するアミノ酸を明らかにすることは、不可能であった。
5.THCA合成酵素のX線結晶構造解析
THCA合成酵素の活性部位を明確にし、反応メカニズムを詳細に明らかにするために、X線結晶構造解析を試みた。まず、THCA合成酵素を昆虫細胞で大量に発現させた後、各種クロマトグラフィーに付すことにより、電気泳動上単一バンドを示すまで精製した。得られたサンプルを用いて、結晶化スクリーニングを行い、一辺が0.1 mm程度の結晶を得ることに成功した11)。本結晶を用いて、X線回折実験を行った結果、2.8 Åを超える分解能の回折像を得ることができた。ついで位相を決定するために、重原子同型置換や多波長異常分散法を試みたが、いずれも良好な結果を得るに至らなかった。
そこで、分子置換法による位相の決定を検討した。既に公開されているタンパク質立体構造データベースを用いて、THCA合成酵素の一次構造から立体構造が類似していると予想されるタンパク質を検索した。この結果、THCA合成酵素と23%の相同性を有するGOOXを見出した。分子置換法はプログラムPHASERによって行い、検索モデルとしてGOOXの構造座標を利用した。得られた初期モデルを立体構造の精密化を行った結果、R値は19.6%、Rfree値は24.2%に収束するまで精密化し、THCA合成酵素の立体構造を決定することに成功した。
6.THCA合成酵素の立体構造
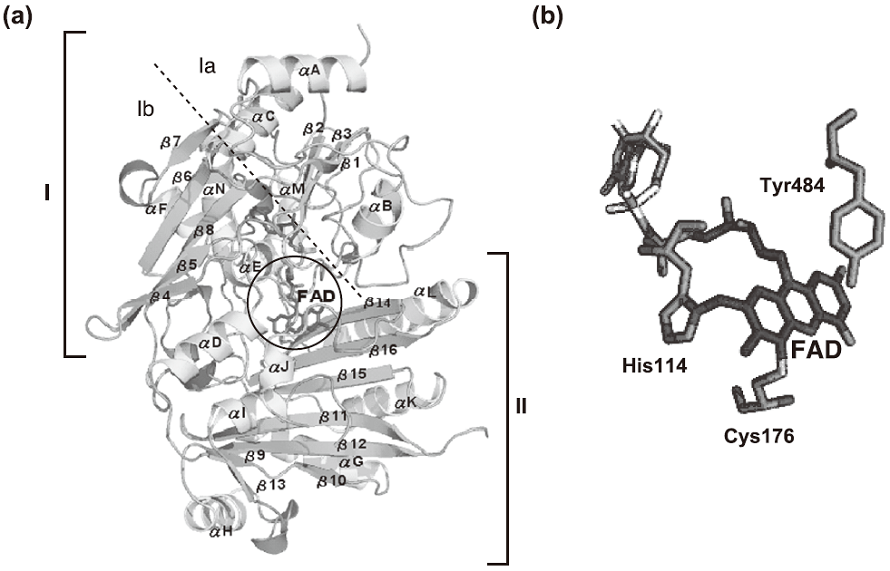
THCA合成酵素の全体構造を図4aに示す。TACA合成酵素は、FADの結合ポケットを境界にして大きく二つのドメインに分けることができる。FADが共有結合しているドメインIは、それぞれ8個のαへリックス(αA-F、αM、N) とβストランド (β1-8) で構成されており、さらに2つのサブドメイン (IaおよびIb) が存在している。ドメインIb中の5つのβストランド (β4、β5、β8、β6、β7) は逆平行シートを形成している。ドメインIIは6個のαへリックス (αG-L) と8個のβストランド (β9-16) で構成されており、5つのβ ストランド (β12、β11、β15、β16、β14) が逆平行シート構造を形成している。これらの立体構造の特徴は、初期モデルに用いたGOOXのそれとよく一致している12)。このようにTHCA合成酵素の立体構造はGOOXと類似しているが、GOOX (glucoseやそのoligomerを酸化する酵素) とは異なる酸化反応を触媒するのは極めて興味深い。

7.THCA合成酵素の活性部位の特徴
変異実験によってFADがTHCA合成酵素活性に関与していること確認しているので、この補酵素の結合様式やその周辺の構造を詳細に解析した。Flavoproteinは、FADが共有結合によってタンパク質と結合するものと共有結合を持たないものに大別される。前者のタイプとしてこれまで1つの共有結合を有するタンパク質のみが知られていたが、2005年にGOOXのFADが2つのアミノ酸残基と共有結合を有することがX線結晶構造解析により明らかにされている12)。THCA合成酵素のFAD結合部位を解析した結果、FADはHis114のN原子、Cys176のS原子と2つの共有結合を形成していることが判明した (図4b)。
また、FADのイソアロキサジン環周辺にポケットが存在しており、このポケットが活性部位であることが予想された。THCA合成酵素の触媒機能の一つとして、基質のプロトンの引き抜きが考えられ、この反応には解離性のアミノ酸残基が関与していると推察された。そこで、前述のポケット内表面に存在するアミノ酸残基のなかで、活性残基となりうるものを検索したところ、5種のアミノ酸残基が該当することが判明した。さらにGOOXの活性アミノ酸残基との比較により、Tyr484がTHCA合成酵素反応に関与する可能性が示唆された (図4b)。この仮説を証明するために、Tyr484をPhe484に変換した変異体を調製し、酵素活性を測定したところ、この変異体にはまったく酵素活性が検出されなかった。したがって、THCA合成酵素のTyr484は、基質の酸化に関与するアミノ酸残基と結論した。
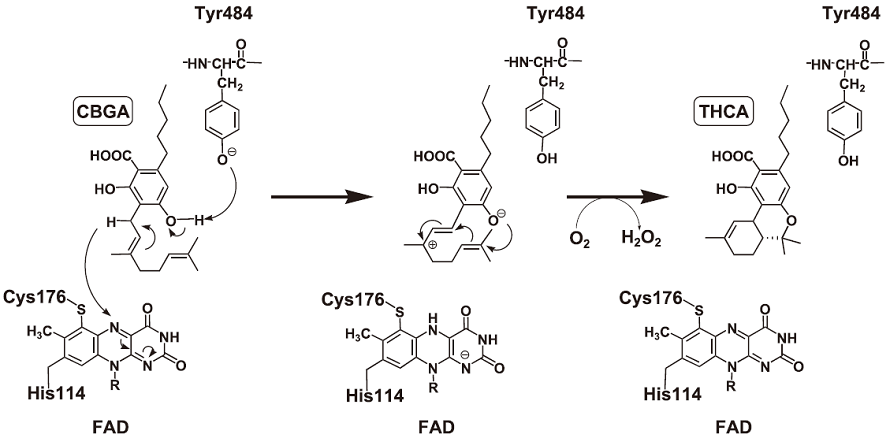
8.THCA合成酵素の酵素反応機構
以上の結果を基にして、THCA合成酵素の反応機構を考察した。すなわち、解離したTyr484が基質のCBGAのフェノール性水酸基のプロトンを引き抜き、さらに活性メチレンの一方の水素原子がヒドリドとしてFADのイソアロキサジン環のNに移行することで、CBGAが脱水素化され、THCAが生成すると考えられる (図5)。このように、基質の酸化のかかわるメカニズムに関しては、明らかにすることができたが、テルペン部の閉環を制御する機構に関しては、依然として不明である。現在、この機構を解明するために、基質とTHCA合成酵素の複合体のX線結晶構造の解析を進めている。
図5 THCA合成酵素の反応メカニズム
9.おわりに
本稿では、大麻の幻覚活性に大きな影響を与えるTHCAの生合成酵素について述べた。前述したように筆者の研究室では、THCA合成酵素と類似した反応を触媒するCBDA合成酵素に関しても、遺伝子クローニングや発現系の確立に成功している13)。CBDA合成酵素とTHCA合成酵素の一次構造を比較したところ、両酵素は84%と高い相同性を示すことが判明した。現在、CBDA合成酵素のX線結晶構造の解明を検討している。両酵素の立体構造を詳細に比較することによって、カンナビノイドの環化メカニズムをさらに正確に解明できると期待している。
また、THCA合成酵素は、BBEと呼ばれるアルカロイドの生合成酵素と多くの点で類似していた。BBEはベンジルイソキノリン型アルカロイドを酸化閉環しプロトベルベリン型アルカロイドを生成するflavoproteinである。このように基質の構造が全く異なるにもかかわらず、THCA合成酵素やBBEは一次構造や酵素反応が類似していることは興味深い。基質の酸化閉環を伴って生合成される二次代謝は、これら以外にも、高等植物から多数同定されているので、THCA合成酵素と同じファミリーに属する酵素群が植物に広く分布していると思われる。
植物二次代謝産物の生合成酵素は極めて多様な反応を触媒することが知られており、それらの反応メカニズムを正確に明らかにすることは、重要な知見が得られるものと考えられる。このためには、酵素の立体構造を明らかにすることが必須であるが、植物成分の生合成酵素のX線結晶構造が明確にされた報告は、ポリケチド合成酵素などを除くと非常に少ない。この分野にも、構造生物学を取り入れた研究が望まれる。
謝辞
THCA合成酵素のX線結晶構造解析は黒木良太博士、玉田太郎博士 (日本原子力研究開発機構) の多大なご支援とご協力を頂いて行われたものであります。ここに改めて感謝の意を表します。
文献
1) Turner, C. E., Elsohly, M. A., Boeren, E. G.: J. Nat. Prod., 43, 169 (1980).
2) 牧野三津子、古川めぐみ、飯田 隆、藤本康雄、労 愛娜: 日本生薬学会第54回年会 (2007).
3) Gaoni, R., Mechoulam, R.: J. Am. Chem, Soc., 86, 1946 (1964).
4) Yamauchi, T., Shoyama, Y., Aramaki, H., Azuma, T., Nishioka, I.: Chem. Pharm. Bull., 15, 1075 (1967).
5) Shoyama, Y., Yagi, M., Nishioka, I., Yamauchi, T.: Phytochemistry, 14, 2189 (1975).
6) Mechoulam, R.: Science, 168, 1159 (1970).
7) Taura, F., Morimoto, S., Shoyama, Y., Mechoulam, R.: J. Am. Chem, Soc., 117, 9766 (1995).
8) Taura, F., Morimoto, S., Shoyama, Y.: J. Biol. Chem., 271, 17411 (1996).
9) Sirikantaramas, S., Morimoto, S., Shoyama, Y., Ishikawa, Y., Wada, Y., Shoyama, Y., Taura, F.: J. Biol. Chem., 279, 39767 (2004).
10) Dittrich, H., Kutchan, T. M.: Proc. Natl. Acad. USA, 88, 9969 (1991).
11) Shoyama, Y., Takeuchi, A., Taura, F., Tamada, T., Adachi, M., Kuroki, R., Shoyama, Y., Morimoto, S.: Acta Chrystallogr., F61, 799 (2005).
12) Huang, C. H., Lai, W. L., Lee, M. H., Chen, C. J., Vasella, A., Tsai, Y. C., Liaw, S. H.: J. Biol. Chem., 280, 38831 (2005).
13) Taura, F., Sirikantaramas, S., Shoyama, Y., Yoshikai, K., Shoyama, Y., Morimoto, S.: FEBS Letters, 581, 2929 (2007).