【トピックス】
酵素触媒の極性有機溶媒耐性と不斉還元バイオプロセスへの応用
伊藤伸哉、牧野祥嗣
富山県大・工
1.はじめに
有機溶媒中での酵素反応は、その工業的応用範囲を拡大するという見地からさまざまな試みがなされてきた。特に、1984年のZaksとKlivanovによる乾燥ブタすい臓lipaseを使用した有機溶媒中 (heptanolなどは基質でもある) での酵素反応の報告1)をきっかけに多くの研究者の耳目を集めることになった。しかしながら、lipaseを含む各種esteraseやsubtilisinで代表される一部のproteaseを除けば、その応用例はさほど多くない。有機溶媒を生体触媒反応やバイオプロセスに用いる利点は、1) 多くの脂溶性基質の溶解度を上げることができる;2) 非水系溶媒では、加水分解反応を逆の合成反応に利用できる; 3) 基質や生成物阻害を含めた副反応の低減が可能となる; 4) 生成物の分離・精製などのダウンストリームが容易となる; 5)環境に優しいグリーンケミストリーの観点から水-極性有機溶媒系での触媒反応の推進につながる、などが挙げられる。酵素触媒の有機溶媒中での反応は古くて新しいテーマと言えるであろう。確かに、リパーゼが多数の有機合成反応に利用されている理由は、その広い基質特異性のみならず有機溶媒中で活性を示す点にあるのは言うまでもない。しかし、大多数の酵素は本質的に各種有機溶媒に感受性であり、とてもリパーゼのようなまねはできない。ところで、こうした研究にブレークスルーはあるだろうか。今のところは個々の成功例を踏まえ色々と工夫するしかない。特に、有機溶媒を使用する反応は化学合成プロセスでの反応が中心になり、酵素触媒を積極的に合成反応に応用しようと考えるときに初めてその必要性に遭遇することになる。以下に、その必要に迫られた筆者らが、水-2-propanol中での酵素活性を向上させ、不斉還元プロセスの生産性の向上に成功した例を示す。筆者らの例を含め酵素触媒の極性有機溶媒中での反応について考えてみたい。
2.有機溶媒耐性について
「有機溶媒耐性」という言葉については、専門家でも幾らか誤解があるようである。実は、酵素触媒の水-極性有機溶媒中での安定性 (有機溶媒中での蛋白質としての安定性) の指標である半減期τ (時間) と有機溶媒中での酵素触媒の活性 (kcat) とは時に別物であり、これらを分けて考える必要がある。
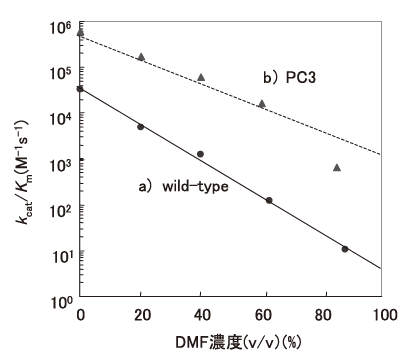
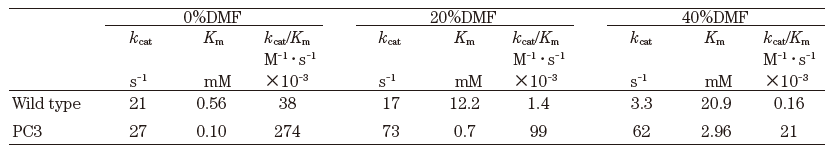
一般に多くの酵素蛋白質水溶液にアルコールのような極性溶媒を添加していくと、酵素蛋白質は結合水を失うか結合水に影響を受け、α-ヘリックス構造の誘発によるコンフォメーション変化を起こし、容易に活性を消失するとともに変性するか凝集して沈澱する。水と任意に混合するDMF中でのsubtilisin の活性低下の例を図1のaに示した。kcat/Km値は、DMFが0%の時、38×103(M-1・s-1)、20%では1.4×103、40%では0.16×103と激減する。DMF濃度とkcat/Kmの対数はほぼ比例関係となる。subtilisinの場合DMFが存在するとKm値が増大することから、kcat値で比較しても、それぞれ、21 (s-1)、17、3.3 と減少する。また、40%DMF中での酵素活性の半減期は6時間でしかない2)。おそらく、一般的な酵素では、これよりも悪い傾向を示すものと推定される。しかし、かなりの酵素蛋白質は、例えばアルコール沈澱後に緩衝液に再溶解させると酵素活性を回復するように、この変性は可逆のものもあり、極性溶媒の存在下で比活性は著しく低下するものの、こうした処理に比較的耐性な酵素も存在する。特に、こうした極性溶媒の存在下で、長期間安定性を維持するproteaseが近年報告されている3)。多くの研究者が望んでいる有機溶媒耐性酵素は、水-極性有機溶媒中で高安定性 (長い半減期) かつ高活性 (高いkcatまたはkcat/Km) を同時に、またはどちらかを実現する酵素と思われる。酵素触媒の生産性は、おおまかに言えば活性と反応時間 (安定性) との積分値となることから、酵素触媒を合成反応に応用する場合は、各種有機溶媒中での活性と安定性を十分に見極める必要がある。

3.酵素反応に使用する有機溶媒について
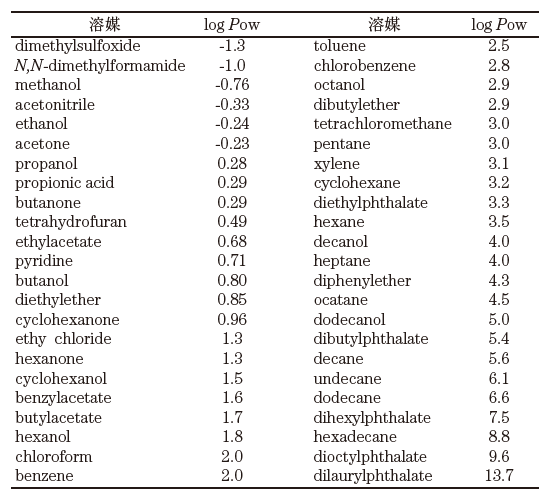
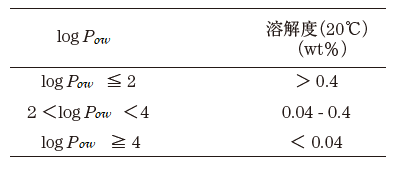
リパーゼを有機溶媒耐性なスーパー酵素の例として取り上げたが、リパーゼも非水 (微量の水は含む) 極性有機溶媒中ではほとんど活性を示さない。酵素触媒の有機溶媒耐性は溶媒の種類や性質により著しい影響を受ける。今日までの多くのデータから、一般的に溶媒と酵素触媒との関係を最も良く反映しているパラメーターは溶媒のlogPow値である4)。これは、各溶媒の水と1-octanolの2相間における分配係数Powの常用対数であり、溶媒の極性を表している。極性が低く疎水性が高い有機溶媒ほど1-octanolに相分配されるため、そのlogPow値は大きくなる。一部の有機溶媒のlogPow値を表1に示すが、通常その範囲は-1.3~13程となる。またlogPowは未知の溶媒や化合物も実験的に求めることができる5)。この中で、例えば、1-propanolと2-propanolのように官能基の位置が異なるものは同じ値 (0.28) となる。また、logPow値と各有機溶媒の水の溶解度についてもおおよそ表2のような関係がある。
表1 よく使用される有機溶媒のlogPow値
表2 有機溶媒の水溶解度とlogPow値との関係
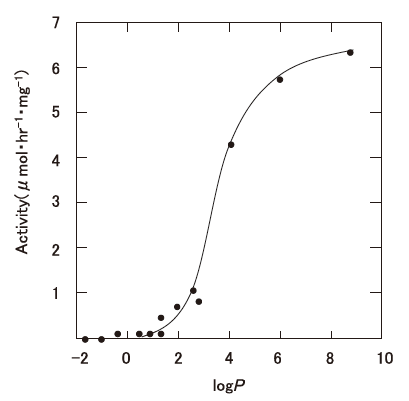
さて、非水有機溶媒中における生体触媒反応の活性につては、logPow<2では非常に低い、logPowが2~4では普通または大きく影響を受ける、logPow>4の非極性溶媒中では高いまたはほとんど影響を受けないというデータが知られている。図2は、酵母lipaseのtributyrinとheptanolのエステル交換反応における酵素活性と使用した非水溶媒との関係を示しているが4)、酵素活性と使用する溶媒のlogPowの間に非常に良い相関が認められる。ただし、lipaseは粉末のまま反応系に添加されているので不均一系での反応である。また、Zaksらは、lipase以外にもalcohol dehydrogenase (ADH) (馬肝臓)、polyphenol oxidase (キノコ)、alcohol oxidase (Pichia pastoris) のような一般的な酵素においても微水溶媒の不均一反応で十分な活性を認めている6)。さらに各種溶媒系をスクリーニングした結果、alcohol oxidaseが10%水-tert-amyl alcohol系で水系の21%の活性、polyphenol oxidaseが3%水-octanol (logPow :2.9) 系で40%の活性、ADHでは0.5%水-isopropyl ether系で水系の25%の活性を報告している6)。こうした一連の研究結果から、多くの酵素は特定の有機溶媒中でも活性は示すものと推定される。しかし、酵素蛋白質が有する活性維持に必要な蛋白質結合水を奪ったり、それに影響を与える有機溶媒の場合は、生体触媒反応系には適さないと判断できる。これを有機溶媒のlogPow値から見ると、logPow<2の極性溶媒に該当する。中迫と肥後の解説によれば、多くの蛋白質表面原子の4Å以内に第一層水和水が観察されており、その量は0.34~0.39 g 水和水/g 蛋白質と見積もられている7)。特に、水と任意に混合するエタノールのような溶媒では、モル分率が0.2 (45%(v/v)) 近辺から、溶媒のミクロ構造が大きく変化し、蛋白質の変性を一層強く誘因すると推定されており8)、こうした極性有機溶媒の耐性の上限濃度と考えられる。このように水と混和する極性有機溶媒の場合は、その濃度が重要なファクターとなる。
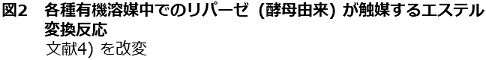
他方、logPowが2~4の溶媒では酵素は活性や立体選択性などさまざまな影響を受けるものの、蛋白質結合水への影響は比較的少ない。さらにlogPow>4のdecane やhexadecaneでは生体触媒への影響は著しく低減される。Rhodococcus corallina (旧Nocardia) で報告されているアルケンからのエポキシアルカンの製造の溶媒にhexadecane等が使用されている理由はここにあり9)、細胞内の酵素系は特に影響を受けることなく、細胞にとっては有害なエポキシアルカンを溶媒層に移動させることが可能となる。
このように、logPow値は非常に有効なパラメーターである。しかし残念なことに、重要な多くの極性有機溶媒群が酵素触媒反応には適さないlogPow<2の溶媒 (蛋白質の変性剤) に該当するのも事実である。
4.極性有機溶媒耐性酵素のスクリーニング
極性有機溶媒に耐性な酵素は簡単に見出せるだろうか?この答えは、程度の差こそあれ、イエスである。その回答の一部は、超好熱菌由来の酵素群と少数ではあるが有機溶媒耐性微生物が分泌する菌体外酵素である。また一般の中温菌からも2-propanolやacetoneを含有する反応液での酵素活性の検出といった比較的地道なスクリーニング方法でも可能である。
超好熱菌由来のNADP+-glutamate dehydrogenase (GluDH) は、イオンペアネットワークで耐熱性を示すことが知られているが、KujoとOshimaはPyrobaculumからNAD+依存性のGluDHを見い出し、サブユニット間の疎水性相互作用が、高い熱耐性に寄与していると推定している10)。同酵素は、15%のacetonitrileや10%のTHF中で2倍程度活性化され、エタノール中では約50%程度まで100%以上の活性を示す。また、50℃、10分程度のインキュベーションではメタノール、エタノール、DMSO、DMFに対し約40%濃度まで安定性を維持している。本酵素は、他の変性剤に対しても抵抗性を示す。超好熱菌の耐熱化機構には、さまざまな戦略が隠されているようであるが11)、耐熱性と有機溶媒耐性の間には物理的/化学的変性に対する耐性という共通点があり、超好熱菌由来の酵素は有機溶媒耐性酵素としても有望なソースと考えられる。
また、Oginoらは有機溶媒耐性のPseudomonas aeruginosaが分泌生産するmetalloendopeptidaseが有機溶媒中で安定なことを見出している。PST-01と命名されたこのproteaseは、約25%の各種極性有機溶媒中 (メタノール、エタノール、DMSO、DMF、2-propanol) で100日以上の半減期を示す3)。同様に、DoukyuとAonoは、Burkholderia cepaciaから、分泌性の有機溶媒耐性cholesterol oxidaseを取得し解析している12)。
中温菌からの例として、Stampferらは、2-propanol (50%) もしくはacetone (20%) 中でケトンの不斉還元反応を触媒できる微生物としてRhodococcus ruber DSM44541を選択した13)。さらに、同菌から目的の酵素を精製した。この際、少なくとも7種の2級アルコール脱水素酵素活性を認めているが、有機溶媒耐性であったのは1種だけであった。この酵素は80%濃度の2-propanol (溶媒と同時に基質でもある) に対しても高い活性を示す14)。
5.進化分子工学的手法による極性有機溶媒耐性酵素の創製と不斉還元への応用
酵素触媒の進化分子工学的改変は近年盛んに行われ、利用目的にかなった触媒酵素を開発するための重要な手段になっている。しかし、極性有機溶媒耐性に関する進化分子工学的な報告例は非常に少ない。
この最初の例は、1993年のChenとArnoldによる図1にも示したsubtilisin EのDMF中での活性の改変である2)。この論文ではsubtilisinの酵素遺伝子をエラー-プローンPCRにより変異し、DMF中で活性が高い変異酵素を順次選抜し、それらの変異を順次組み合わせ蓄積させてPC3を得たものである。変異酵素のスクリーニングは、DMFを含むカゼインプレートでのハローの大きさという簡便な方法が採用されている。最終的に得られたPC3変異酵素は、図1のbに示した反応性を示した。端的に言えば、酵素の活性が上昇し、0~85%のDMF濃度の全範囲でkcat/Km値が上昇している。また、DMF濃度が上がるにつれて顕著であるkcat/Km値の減少が、緩やかになっている。表3にそれらの結果をまとめたものを示したが、特に著しいのは、野生酵素と比較した場合のKm値の減少である。このように、「DMF中で高活性を示す。」という選択圧に対して、酵素遺伝子は、野生酵素と比較して「DMF中でのKm値を下げ、kcatを上げる。」という進化分子工学的な方向性で答えたのである。PC3は10個の変異点を有している。これらは活性中心や基質結合部位に近い蛋白質表面のループ構造に集中して存在しているが、構造学的にこれらの変異点を予想したり、野生酵素とPC3の構造的差異を示すデータは得られていない。MooreとArnoldはp-nitorbenzyl esteraseのDMF中での改変も行っている15)。この場合は基質特異性を変えるという選択圧も同時に加えられているが、最終的にはターゲット基質に対して、15%DMF中で野生酵素と比較してkcat/Km値が約25倍向上した変異酵素が得られている。この場合はKm値の減少よりも、kcatの上昇が著しい。
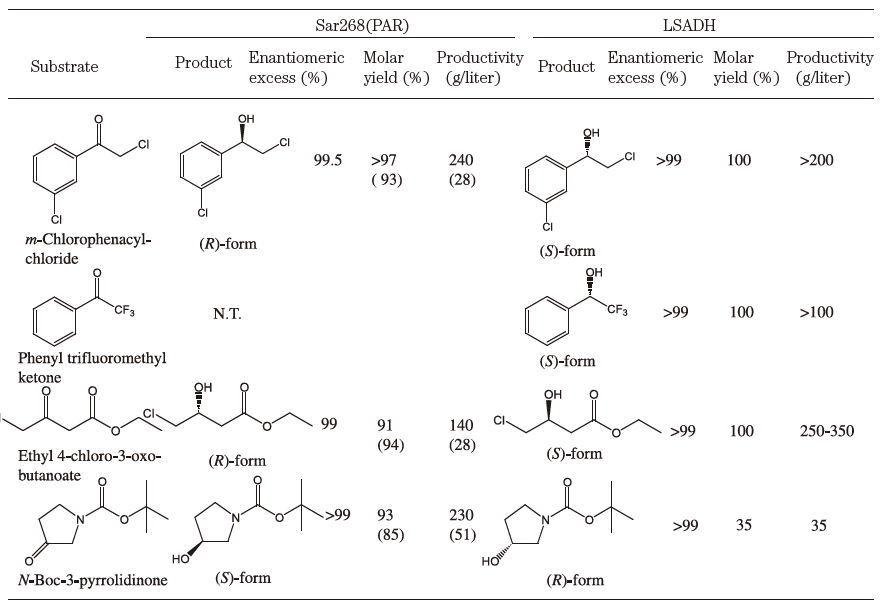
表3 ズブチリシンEとその変異酵素のDMF中での動力学定数
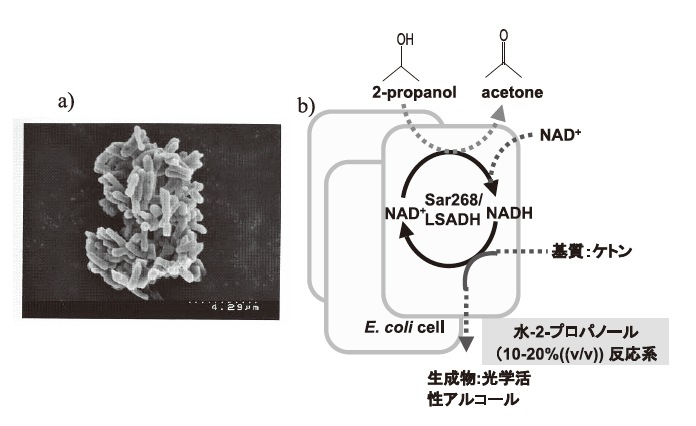
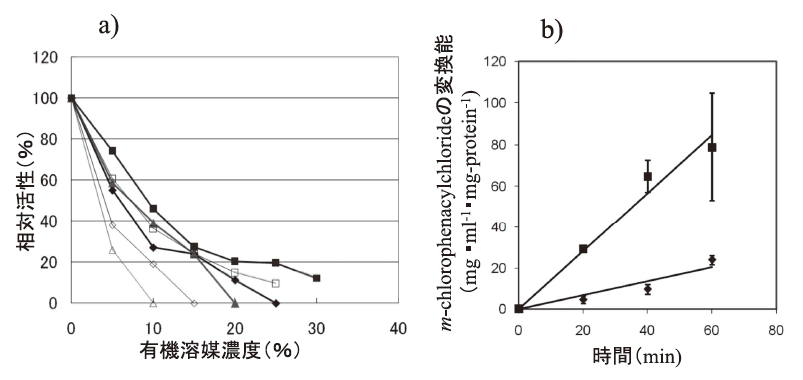
さて、著者らは、2-propanolを水素源とするケトン類の不斉還元プロセスの研究開発を行ってきた。新たに見出したRhodococcus (旧Corynebacterium) のphenylacetaldehyde reducatse (PAR:ADHの一種)16-18)とLeifsonia sp.由来のADH (LSADH)19-21)は、高い立体選択性を有し、それぞれ40種以上のケトンに反応した。図3bに示すように、PAR/LSADH反応では、1つの酵素が2-propanolを用いて補酵素NADHの再生を行うと同時に目的ケトンを光学活性アルコールに変換することが可能である。補酵素の再生反応を組み合わせることなく、100~350 g/Lという高生産で99% e.e.以上の光学純度の各種光学活性アルコールの生産を可能とする理想的なプロセスである (表4)。この場合2-propanolはケトン還元のための水素源としての機能だけではなく、多くの水難溶性のケトン類の溶解度と触媒である組換え大腸菌膜の透過性を上げるという機能を合わせ持っている。また生産物を1~2 Mと高濃度に蓄積するためには、2-propanolは10~20%(v/v) (1.34~2.7 M) 必要である。しかし、(S)-アルコールを作るために見出したPARは10%以上の2-propanol中では活性が不十分で生産性の限界が認められた19)。そこで、当該酵素の2-propanol 耐性の向上を進化分子工学的改変で行った。選択圧は「20% 2-propanol中で高基質変換率を示す。ただし、立体選択性は維持する。」である。約5×103クローンから選抜した4クローンの9変異点を蓄積させ、その後各変異点を野生酵素のアミノ酸に復帰変異させ、最終的に6変異点を有するSar268を得た22)。その後、立体選択性の維持を確認した。アルコールの生産性は数倍から10倍程度向上し、現在、さらに高機能化したHAR1酵素も得られている。E. coli (EAR2:野生酵素) とE. coli (Sar268) では、菌体当たりの可溶性酵素蛋白質量が後者では3倍程度上昇していた。精製酵素の解析データは未報告であるが、その一部を図4に示した。相対活性でみると変異酵素の方が、各種極性溶媒の濃度上昇に伴う活性の低下の程度が緩慢であり (図4a)、10%2-プロパノール中での反応性の明瞭な向上が確認された (図4b)。また、各種基質に対してKm、Vmax値の著しい減少が認められた。他方Vmax/Km値は同等かやや増加した (表5)。しかし、予想に反して、各種溶媒中での酵素の安定性はSar268の方がEAR2よりも劣っていた。実は、野生型酵素は元々各種極性有機溶媒中での安定性が高く、エタノール、アセトン、1-/2-propanol、DMFについては20%程度まで24時間インキュベーションしても活性低下はほとんど認められない。しかし、野生型酵素は極性溶媒中での活性が低く、十分な生産性が得られなかったわけである。この場合、4.で述べた耐熱性酵素の例とは異なり、安定性と活性のベクトルは一致していない。安定性と溶媒中での物質生産性の向上のための反応性のトレードオフが起こった可能性が考えられる。我々の研究結果は、極性溶媒中での酵素触媒の安定性が必ずしも溶媒中での活性とはパラレルではない興味深い例となった。
![]()
表4 水素移動型バイオ不斉還元による光学活性アルコールの生産例
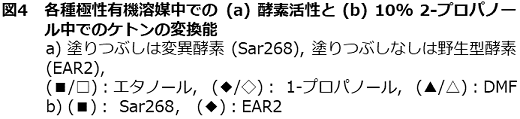
表5 PARとその変異酵素 (Sar268) の動力学定数
6.有機溶媒耐性からみた酵素の修飾と固定化
固定化酵素の有機溶媒中での反応については、成書に述べられているので詳細は割愛するが、酵素をPEG (ポリエチレングリコール) で修飾したり、エマルジョン系で利用したり、ポーラスな無機性の担体に結合したりして利用すれば、当然有機溶媒の影響を物理的にかなりの程度排除することが可能である。また固定化により、酵素活性や立体選択性、酵素の使用安定性を向上させることができる場合も多い23,24)。我々は、5.で述べたように大腸菌の細胞内に酵素触媒を高効率に発現させ、これをポリエチレンイミン (PEI) とグルタルアルデヒド (GA) で固定化したE.coli 菌体 (ADHを高濃度に発現) が、10%の2-propanol中で500時間以上連続使用が可能であることを示した (図3a)25)。固定化により10%2-propanol中での酵素触媒の半減期は5倍以上 (約600時間) となった。この固定化触媒をバイオリアクターとして利用すると、5%の4-hydroxy-2-butanoneから (R)-1,3-butanediol (99%e.e.) を99%の収率で連続的に生産することができる。
蛋白質の結合水を保持するという観点から、含水ゲル内や細胞内、多孔性粒子内に緩衝液と一緒に酵素触媒を固定化する方法は、有機溶媒中での安定性と操作性を向上するためには非常に有効な手段である。現状では、有機溶媒中での活性・安定性の高い酵素触媒を創製し、これを何らかの固定化法でさらに安定化させるのが最も優れた手法であると考えられる。
7.おわりに
水または水-極性有機溶媒系での触媒反応は、グリーンケミストリーの考え方26)から非常に重要な研究分野となりつつある。酵素触媒反応は水系が中心であるため、酵素触媒をこうした合成プロセス分野へ積極的に応用し、効率的なバイオプロセス生産を行うための技術開発への期待は年々高まっている。
酵素を極性有機溶媒中で利用するためには、限界を認識しつつも適切な反応場を選択することが大切であり、さらにそうした反応場に適した優れた酵素触媒を創製することが必要となる。
文献
1) Zaks, A., Klibanov, A. M.: Science, 24, 1251 (1984).
2) Chen, K., Arnold, F. H.: Proc. Natl. Acad. Sci., 90, 5618 (1993).
3) Ogino, H., Uchiho, T., Yokoo, J., Kobayashi, R., Ichise, R., Ishikawa, H.: Appl. Environ.Microbiol., 67, 942 (2001).
4) Laane, C., Boeren, S., Vos, K., Veeger, C.: Biotechnol. Bioeng., 30, 81 (1987).
5) Harnisch, M., Mockel, H. J., Schulze, G.: J. Chromatogr., 282, 315 (1983).
6) Zaks, A., Klibanov, A. M.: J. Biol. Chem., 263, 8017 (1988).
7) 中迫雅由, 肥後順一: 現代化学, 413(8), 48 (2005).
8) 山口敏男, 片山幹雄: 現代化学, 411(6), 55 (2005).
9) 古橋敬三: 発酵と工業, 45, 468 (1987).
10) Kujo, C., Ohshima, T.: Appl. Environ. Microbiol., 64, 2152 (1998).
11) 櫻庭春彦他: 化学と生物, 44(5), 305 (2006).
12) Doukyu, N., Aono, R.: Appl. Microbiol. Biotechnol., 57, 146 (2001).
13) Stampfer, W., Kosjek, B., Moitzi, C., Kroutil, W., Faber, K.: Angew. Chem. Int. Ed., 41, 1014 (2002).
14) Kosjek, B., Stampfer, W., Pogorevc, M., Goessler, W., Faber, K., Kroutil, W.: Biotechnol. Bioeng., 86, 55 (2004).
15) Moore, J. C., Arnold, F. H.: Nature Biotechnol., 14, 458 (1996).
16) Itoh, N., Morihama, R., Wang, J.-C., Okada, K., Mizuguchi, N.: Appl. Environ. Microbiol., 63, 3783 (1997).
17) Itoh, N., Mizuguchi, N., Mabuchi, M.: J. Mol. Cata. B: Enzymatic, 6, 41 (1999).
18) Itoh, N., Matsuda, M., Mabuchi, M., Dairi, T., Wang, J.-C.: Eur. J. Biochem., 269, 2394 (2002).
19) Inoue, K., Makino, Y., Itoh, N.: Appl. Environ. Microbiol., 71, 3633 (2005).
20) Inoue, K., Makino, Y., Itoh, N.: Tetrahedron Asymmetry, 16, 2539 (2005).
21) Inoue, K., Makino, Y., Dairi, T., Itoh, N.: Biosci. Biotechnol. Biochem., 70, 418 (2006).
22) Makino, Y., Inoue, K., Dairi, T., Itoh, N.: Appl. Environ. Microbiol., 71, 4713 (2005).
23) 山根恒夫: 生物反応工学(第2版), 産業図書 (1991).
24) 田中渥夫, 松野隆一: 酵素工学概論, コロナ社 (1995).
25) Itoh, N., Nakamura, M., Inoue, K., Makino, Y.: Appl. Microbiol. Biotechnol., 75, 1249 (2007).
26) 御園生誠, 村橋俊一: グリーンケミストリー, 講談社(2002).