【トピックス】
リパーゼの実用化利用の拡大に向けて
広瀬芳彦
天野エンザイム㈱
1.はじめに
酵素を利用して有用物質を得ようとする試みは、この30年の間に多くの研究が進み、酵素の持つ基質認識の特性を利用した光学活性体製造を目的として、医薬や農薬の重要中間体の製造に多く利用されている1-3)。酵素の中では、リパーゼ、エステラーゼやプロテアーゼといった加水分解酵素4)が利用されることが多く、その理由には、①取り扱いが簡単である ②補酵素系を必要としないため反応系が単純である ③基質の認識が広く、立体あるいは位置特異性が高い ④多くの有機溶媒が使用可能である ⑤多くの種類の酵素が工業的に安価に供給されている ⑥常温、常圧の反応で特別な装置が不要であることなどがあげられる。本稿では、光学活性な化合物を得るために広く利用されるリパーゼについて利用上の問題点を整理してみたい。
2.リパーゼは本当に使いやすい酵素か
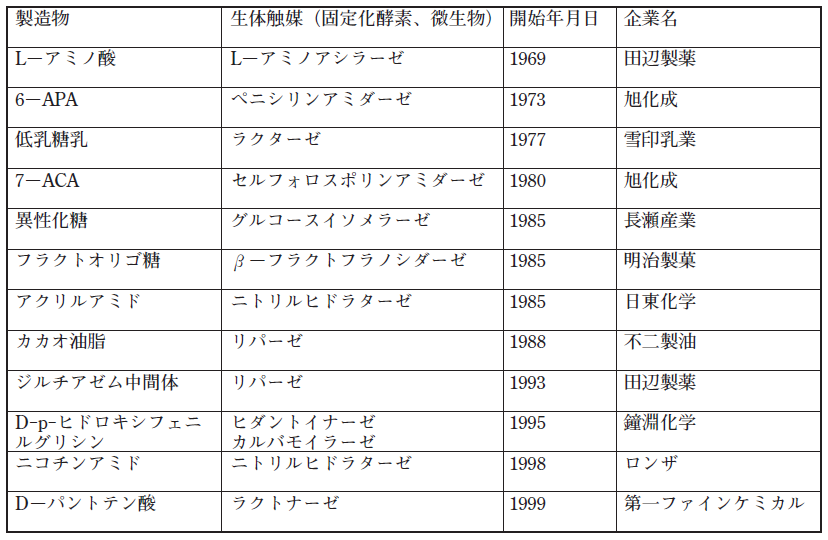
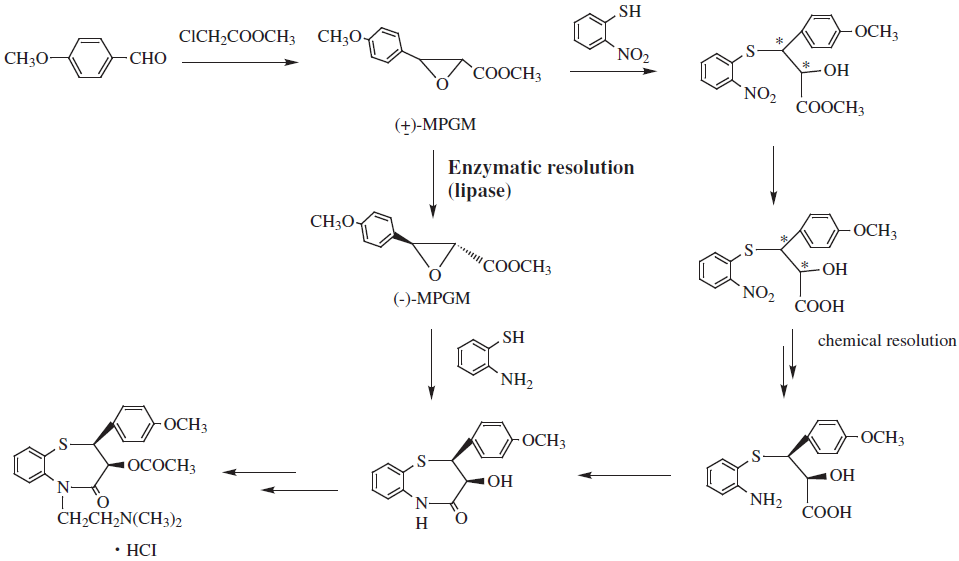
これまでにバイオリアクターとして生体触媒を利用し、実用化されている例のうち代表的なものを表1に示す。酵素を単離した形で利用されることもあるが、固定化酵素や菌体のまま使用されるケースもある。表1に示した実用化例は、土佐ら5)によりまとめられたものであるが、リパーゼの利用に限ってみれば1988年の不二製油で行われたカカオ油脂の製造と1993年の田辺製薬の医薬品ジルチアゼム6)の中間体製造の2例で示されている。特に、後者は従来化学法で行われていたプロセスを酵素を利用するプロセスに変更され、コスト的にも2/3になるなど多くの利点が示され、リパーゼを使用した工業化例として多くの注目を集めた方法であった (図1)。リパーゼの利用を示す特許や文献が数多くある中で、なぜか実用化例がここに示された2件とは不思議に感じる次第である。もっとも、表1に示されたものは代表例であって、全てを網羅するものではないと考えたい。では、なぜ実用化されている例が思ったほど多くないのか?これには、①リパーゼ反応の特性、②リパーゼの利用条件、③酵素が利用される段階 ④酵素利用研究者などの多くの仮定や条件が考えられるが、これらの点について考察してみたい。
表1 生体触媒によるバイオリアクターの工業化例5)
図1 塩酸ジルチアゼムのリパーゼによる酵素合成
①リパーゼ反応の特性 (分割反応)
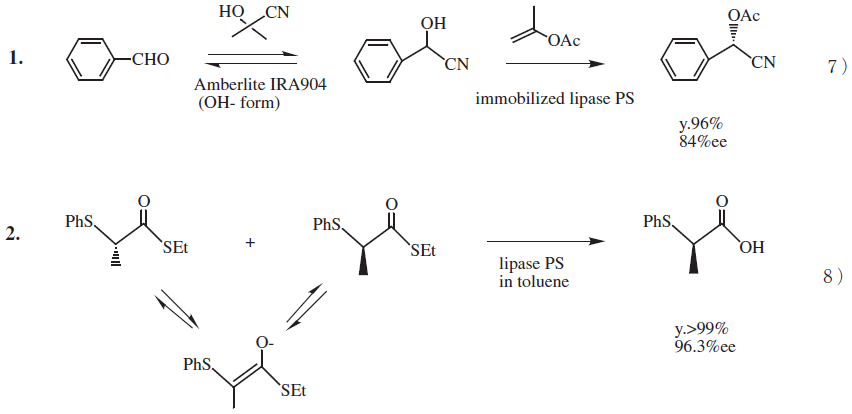
リパーゼが最も利用されるケースは、ラセミ体からの光学活性体の分割である。化学的に合成されたラセミ体から最大50%の収率で必要とする光学活性体を得る反応で、最も簡単な光学活性体の製法になる。適切な酵素が見つかれば短時間に光学活性体が得られる優れた手法であることはいうまでもない。しかし、分割反応であることから、コスト面では確実に不利になる。そこで基質をアルカリ条件下や金属触媒下でラセミ化させながら目的とする光学活性体を100%の収率に導くための工夫 (図2)7,8)をしたり、メソ体やプロキラルな基質からの製造プロセスを構築することで100%の収率を目指す例も見られる。単に分割反応で光学活性体が得られたという段階で終わるのではなく、ラセミ化反応と組み合わせなどさらに酵素利用の範囲を進展させる研究努力が必要である。酵素でもできるという反応に止まっては酵素が生かしきれていないのである。
図2 ラセミ化を伴なう酵素反応
②リパーゼの利用条件
リパーゼは表面を構成するアミノ酸に疎水性のアミノ酸が多いことから、有機溶媒に対する親和性があり、一般の有機反応で使用される有機溶媒中で使用できる特徴がある。これが理由でリパーゼの利用が広がったといっても過言ではない。酵素の利用から見れば使用できる条件の拡大として大きな特徴ではあるが、逆に、化学触媒から考えれば有機溶媒中の反応はなじみのある反応の場である。すなわち、酵素という触媒を本来酵素が得意としない化学触媒が得意とする反応の場で、その能力を競うことになるのである。リパーゼも他の酵素と同じくアミノ酸からなるタンパク質であり、基本的には水系での反応が有利なのである。しかし、基質となる化合物が水に溶けないものであることから、不利な環境での競争とならざるを得ないのかも知れない。
③酵素が利用される段階
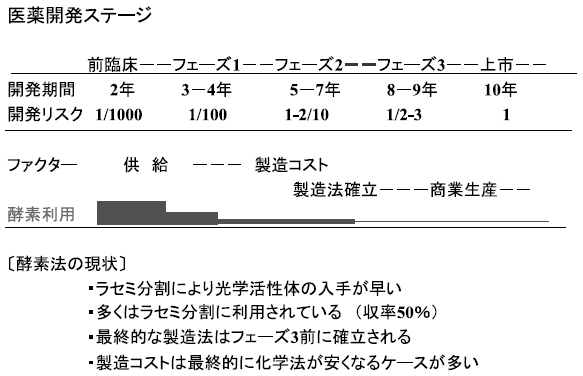
医薬品製造を例に考えてみると、一般に医薬品の開発ステージは図3のようになっている。フェーズ2が始まるまでは化合物の供給時間が最重要課題とある。すなわち、短時間で光学活性体を得る手段としての酵素によるラセミ分割が多く検討され、いち早く目的とする光学活性体を得ることに専念されることが多い。しかし、フェーズ3を迎えるにあたり製造コストが大きなポイントとなり、ここまでにあらゆる手段が検討されるなかで先の理由より圧倒的に有機化学的コストダウンが試みられるのである。残念ながら、最終的には化学法に決定されるケースが多いのも事実のようである。この局面を打破するためにも、多くの優秀な酵素利用研究者の育成が重要なカギを握っている。
図3 医薬品製造に生体触媒が利用されている現状
④酵素利用研究者
大学で有機合成に酵素を利用した経験のある研究者は残念ながら圧倒的に少なく、大半の研究者は、研究手段として酵素を用いない有機化学的手法を優先して検討することが多い。すなわち、企業研究のコストダウンにおいても酵素触媒と化学触媒が比較される中で圧倒的に化学触媒を検討する研究者が多いことになる。酵素利用のメリットは、多くの有機化学者にも理解はされてはいるが、実際に使うときはかなりの抵抗があり、また、酵素を利用する製造プロセスを構築する経験も少ないのが現実のようである9)。残念ながら酵素利用は企業研究者においてマイノリティーとなっている。大学での酵素利用の研究実習を増やすことを切望する次第である。
3.有機溶媒中でリパーゼ反応
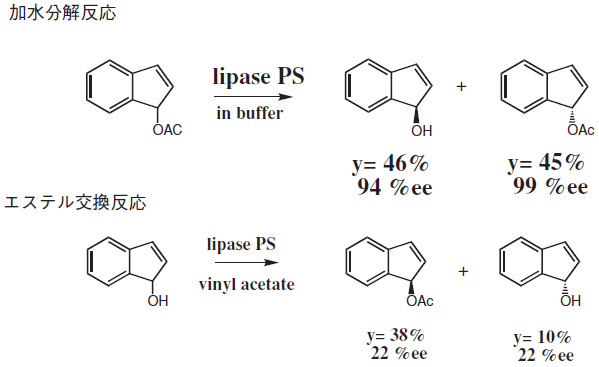
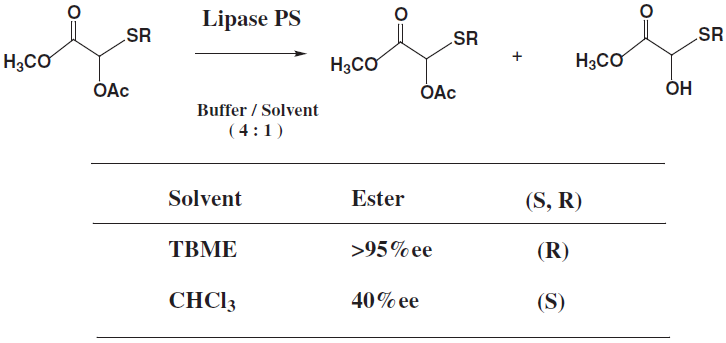
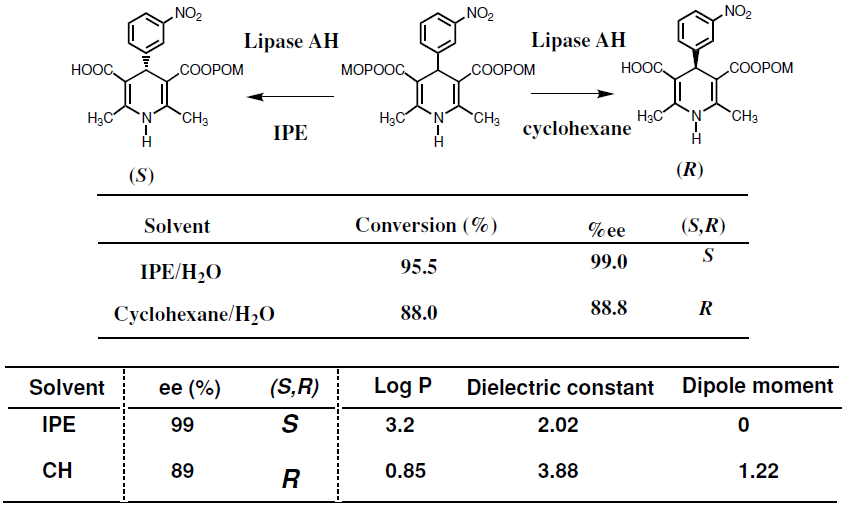
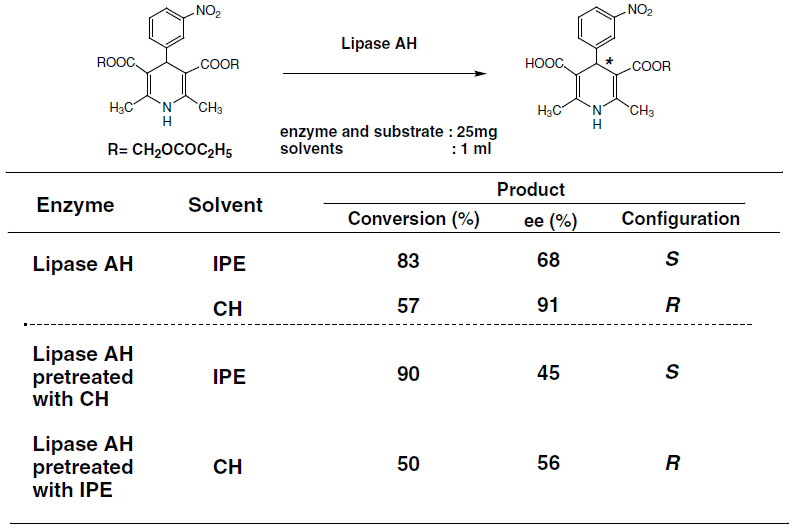
有機溶媒中でリパーゼの持つ本来の機能を100%発揮するには、溶媒の選択、固定化や分散剤など条件を最適化する必要があり、制御すべき要因は多い。これまでにも水中での加水分解反応と有機溶媒中でのエステル交換反応で酵素の立体認識に逆の差が見られたり (図4)、有機溶媒の種類により酵素の持つ立体選択性が変化する溶媒効果 (図5) に関する多くの知見が報告されている。溶媒効果12)は、有機溶媒の特性 (誘電率、双極子モーメント、Log P) や溶媒の構造が関係するとされている。一方、我々の反応にあるように、そのような相関がみられない例もある。活性中心付近での溶媒の取り込みが影響していることが示唆され、実際に有機溶媒で前処理した酵素を用いて反応を行ったときに、立体選択性に対して取り込まれた溶媒の影響を確認した (図6、7)。ここに示したようにリパーゼを有機溶媒中で用いる場合に検討すべきさまざまな要因はあるが、一般の有機触媒に比べて水分含量や温度など多くの点で酵素のほうが反応条件は緩やかであると考えられる。
図4 水中での加水分解反応と有機溶媒中でのエステル交換反応10)
図5 溶媒効果による酵素の立体選択性への影響11)
図6 加水分解における溶媒効果と溶媒パラメーター13)
図7 溶媒の前処理による酵素の立体選択性への影響
4.リパーゼの粉末化による反応性の違い
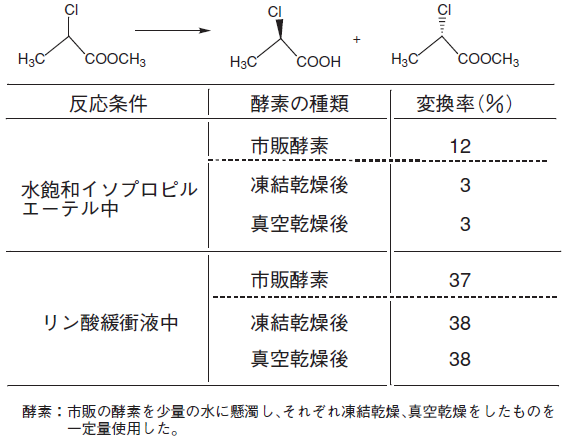
市販のリパーゼは名前が統一されておらず、酵素メーカーの略名や商品名で記されている場合が多い。一般には微生物の起源を併記しているが、命名法の問題で名前が以前と変わり、混乱を招く一因となっている。また、リパーゼの活性値については、活性測定法が統一されておらず、供給メーカーごとに独自の方法を用いていたり、酵素により測定基質が異なっている場合もあり、酵素間で比較ができないことが多い。弊社の酵素についても、JIS法、LMAP法、天野法などそれぞれの酵素ごとに独自の測定法を設定している。市販酵素は、粗酵素品として数種類の酵素の混合物であることが多く、たとえ単一酵素であってもいろいろな賦形剤が含まれており、タンパク含量が数%程度に過ぎないものもある。もともと有機合成を目的として調製されているものは少なく、近年、固定化酵素や架橋微細結晶として有機合成用に供給されているものも増えてきた。形態としては、粉末品 (非固定化品) や凍結乾燥品 (臨床試薬用) などが一般的である。粉末化の方法として、溶媒 (アルコール) や噴霧乾燥 (スプレードライ) のほか、凍結乾燥や真空乾燥の手法が用いられる。キャンディダ由来のリパーゼでは、凍結乾燥や噴霧乾燥により有機溶媒中での反応性が大きく低下することがわかっている。しかし、乾燥酵素を緩衝液に溶解させると通常の反応性を示すことから、酵素の本質に関わる失活ではないようである。乾燥条件により酵素の表面にある水分が奪われ、2次構造の変化を伴ない、有機溶媒中での活性が低下したためと思われる。クロルプロピオン酸エステルを基質としたの加水分解例を示す (表2)。
表2 Candida rugosa由来のリパーゼの反応性
5.固定化リパーゼの利用
有機溶媒中でリパーゼを利用する場合、酵素を固定化することによりその利用を広げることができる。酵素の分散性を良くすることに加え、酵素の熱安定性も向上し、酵素の使用温度が大幅に広がることが見られる。我々が進めているセラミックスに固定化したリパーゼ (Lipase PSC) では、酒井、依馬らにより反応効率の向上のほか-60℃~120℃までの利用例が報告されている14)。
6.リパーゼ反応性の拡大
近年、部位特異的変異やランダム変異などによる酵素の機能改変が盛んに検討されている。セリンプロテアーゼに代表される加水分解酵素と同じ活性中心を持つシュードモナスあるいはバーコホルデリア由来のリパーゼは、活性中心部位がほぼ同じでありながらプロテアーゼはアミド結合を切断し、リパーゼは切断しないかごくわずかの反応性しか示さない違いが見られる。平竹らはリパーゼの活性中心から遠い3ヶ所のアミノ酸を部位特異的変異により置換することによりプロテアーゼ活性を付与する検討を行い、約2倍のアミド加水分解活性を持つリパーゼの作成に成功している15)。改変技術により、有能なリパーゼの機能をさらに拡大することが期待される。
7.おわりに
酵素はアミノ酸からなる高分子化合物である。石油化学を基礎とする今日の有機化学に比べ、糖やアミノ酸からなる天然の素材を基質とする反応に酵素を応用することで、酵素の持つ本来の機能を引き出すことになり、本来の触媒としての優位性を示すことになる。糖やアミノ酸に対しては、有機化学では保護基なしに選択性が見出せず、酵素の特性を再認識できる。これまでのリパーゼを単に光学分割のための触媒として利用してきたが、今日ではタンパク質結晶解析データが得られ、基質と活性部位との結合様式が解明され、さらには、タンパクの進化工学の発展により新しい機能を付加することが可能になってきた16)。単に触媒としての機能にとどまらず、新しい反応や新素材の開発など、その応用がますます広がりつつある。科学の進歩とともにリパーゼを中心とした生体触媒が広範囲に利用されることが期待される。
文献
1) 広瀬芳彦: 農化誌, 76, 1098 (2002); 広瀬芳彦: ファインケミカル, 30, 39 (2001); 広瀬芳彦: ファルマシア, 37, 627 (2001); 広瀬芳彦: 有合化, 59, 96 (2001); 広瀬芳彦: ファルマシア, 32, 1075 (1996).
2) 広瀬芳彦: 和光純薬時報, 71, 2 (2003).
3) 中村薫、広瀬芳彦: 有合化, 53, 668 (1995).
4) Bornscheuer, U. T., Kazlauskas, R. J.: Hydrolases in Organic Synthesis, 2nd Ed., Wiley-VCH, (2006).
5) 土佐哲也: 生物工学会誌, 別冊, 特別号「発酵工学・20世紀のあゆみ」, 70 (2000).
6) Matsumae, H., Furui, M., Shibatani, T.: J. Ferment. Bioeng., 75, 93 (1993).
7) Inagaki, M., Hiratake, J., Nishioka, T., Oda, J.: J. Am. Chem. Soc., 113, 9360 (1991); Inagaki, M., Hiratake, J., Nishioka, T., Oda, J.: J. Org. Chem., 57, 5643 (1992).
8) Tan, D. S., Gunter, M. M., Drueckhammer, D. G.: J. Am. Chem. Soc., 117, 9093 (1995).
9) Thayer, A. M.: C & EN, p.15, August 14 (2006).
10) Ogasawara, K.: Chem. Pharm. Bull., 43, 1585 (1995).
11) Milton, J., Brand, S., Jones, M. F., Rayner, C. M.: Tetrahedron: Asymmetry, 6, 1903 (1995).
12) Zaks, A., Klibanov, A. M.: Proc. Natl. Acad. Sic., 82, 3192 (1985); Kirchner, G., Acoller, M. P., Klibanov, A. M.: J. Am. Chem. Soc., 107, 7072 (1985); Kitaguchi, H., Fitzpatrick, P. A., Huber, J. E., Klibanov, A. M.: J. Am. Chem. Soc., 111, 3094 (1989); Kanerva, L. T., Vihanto, J., Halme, M., Loponen, J. M., Euranto, E. K.: Acta Chemica Scandinavica, 44, 1032 (1990); Fitzpatrick, P. A., Klibanov, A. M.: J. Am. Chem. Soc., 113, 3166 (1991); Secundo, F., Riva, S., Carrea, G.: Tetrahedron: Asymmetry, 3, 267 (1992); Nakamura, K., Takebe, Y., Kitayama, T., Ohno, A.: Tetrahedron Lett., 32, 4941 (1991); Nakamura, K., Kinoshita, M., Ohno, A.: Tetrahedron, 50, 4681 (1994).
13) Hirose, Y., Kariya, K., Sasaki, I., Kurono, Y., Ebiike, H., Achiwa, K.: Tetrahedron Lett., 33, 7157 (1992).
14) Ema, T., Kageyama, M., Korenaga, T., Sakai, T.: Tetrahedron: Asymmetry, 14, 3943 (2003); Sakai, T.: Tetrahedron: Asymmetry, 15, 2749 (2004); Sakai, T., Liu, Y., Ohta, H., Korenaga, T., Ema, T.: J. Org. Chem., 70, 1369 (2005).
15) Fujii, R., Nakagawa, Y., Hiratake, J., Sogabe, A., Sakata, K.: Protein Engineering, Design & Selection, 18, 93 (2005).
16) Ema, T., Kobayashi, J., Maeno, S., Sakai, T., Utaka, M.: Bull. Chem. Soc. Jpn., 71, 443 (1998); EGuieysse, D., Salagnad, C., Monsan, P., Simeon, M. R., Tran, V.: Tetrahedron: Asymmetry, 14, 1 (2003); Ema, T.: Current Organic Chemistry, 8, 1009 (2004); 宮本憲二、太田博道: バイオサイエンストインダストリー, 63, 583 (2005); Nanba, H., Nakai, T., Yasohara, Y., Morikawa, S., Hasegawa, J.: J. Synth. Org. Chem., Jpn., 62, 1102 (2004).