【トピックス】
フェムト秒レーザー照射によるタンパク質・有機低分子の結晶化
安達宏昭、森 勇介、佐々木孝友、高野和文、松村浩由、井上 豪、村上 聡
㈱創晶、大阪大学
1.はじめに
最近、大学発ベンチャー企業が1500社を超えたという報告があり、大学での研究成果に基づく起業化が盛んである。我々も2005年7月に大阪大学発ベンチャーとして「株式会社創晶」を設立した。弊社は、結晶成長を専門とする研究者とバイオ研究者との異分野連携から生まれた新しい結晶育成技術による結晶化受託を事業の柱としている。結晶化の対象は、創薬研究に不可欠なタンパク質や医薬候補化合物の有機低分子である。
最新の創薬研究は、病気に関連するタンパク質分子の立体構造情報に基づき、医薬候補化合物の設計を行う。原子レベルの分解能を有するタンパク質分子の詳細な立体構造の多くは、X線回折による結晶構造解析によって明らかとなる。そのため、まずタンパク質の結晶化が必要となる。
結晶化の条件は個々のタンパク質により異なるため、条件の探索が必要であり、その数は数千条件にも及ぶ。膨大な条件探索をしても、結晶化に至らない場合が多く、結晶化の成功確率はたかだか20%程度である。また、結晶の品質が立体構造解析の最終的な分解能に反映するため、高品質な結晶の作製が求められる。タンパク質は分子構造が複雑で、かつ分子間の相互作用が非常に弱い。さらに、分子間に多くの水分子が占有していることもあり、分子が3次元的に規則正しく配列した状態である結晶になりにくく、高品質結晶の作製は極めて困難である。そのため、結晶化工程が構造解析のボトルネックとなっている。
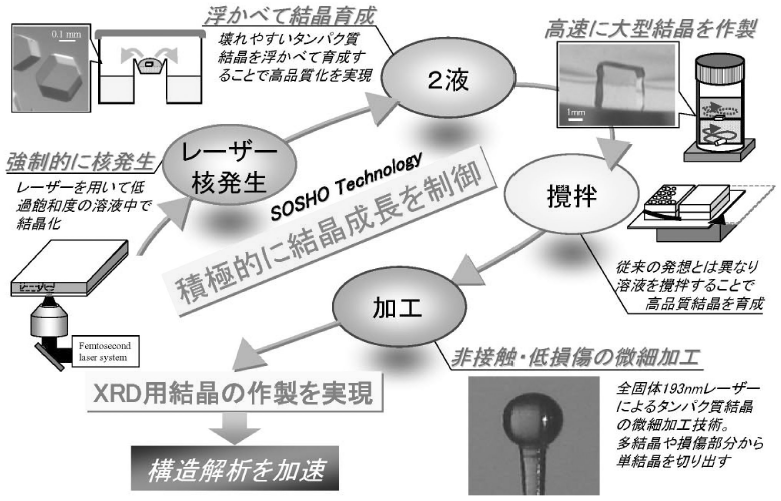
我々は、タンパク質研究では“非常識”とも思えるレーザー照射や溶液攪拌などの革新的な結晶育成技術 (図1) により、結晶化の成功確率を飛躍的に向上させ、60%超に至っている。本稿では、レーザー照射による結晶化技術を取り上げ、より速く、確実に高品質結晶を作製するためには、積極的に結晶成長を制御することが大切であることを示したい。
図1 新しい結晶育成技術
2.結晶化の原理と矛盾
結晶育成は結晶の核形成と成長の2つの過程から成る。タンパク質や有機低分子の結晶育成は、主に溶液中で行われ、結晶の核形成は溶液の過飽和度を蒸気拡散や温度変化などにより高くすることで実現する。溶液中には、複数の分子が衝突して結合したクラスターと呼ばれる集合体が存在し、他の分子と衝突することで凝縮と離脱を繰り返している。核形成は不安定な環境相から安定な結晶相への相転移であり、核消滅と核成長の分かれ道となるクラスター半径 (臨界半径) より大きなクラスターが生成された時点で、結晶核が生成されたと定義されている。
過飽和度が高くなるにつれ、分子の会合が促進され、大きなクラスターが増加する。その結果、結晶化の確率が増大する。しかしながら、タンパク質や有機低分子は無機材料に比べて準安定領域が大きく、過飽和度を極めて高くしないと核形成が起こらない。準安定領域とは、過飽和状態にあるが、核発生には至らない領域である。
結晶核は、過飽和度の高い溶液中で生じるため、その後、結晶が急成長し、結晶品質の低下をまねく。また、結晶の大量析出による多結晶化などの問題も生じる。そのため、結晶成長段階では、低過飽和度の溶液中でゆっくり育成することが必要である。しかしながら、高過飽和にしないと結晶化しないため、矛盾が生じる。
通常、核発生しない準安定領域の低過飽和溶液中で結晶化させることができれば、理想的であり、高品質結晶の育成につながる。そのため、種結晶から成長させる手法がよく用いられる。有機やタンパク質の結晶育成では、良質な種結晶がなく、種結晶育成より自然核成長で育成した結晶の方が高品質結晶を得られやすい1)。また、結晶が微小で脆く軟らかいこともあり、結晶の取り扱いが困難であるため、種結晶の導入に支障が生じる。つまり、種結晶育成に適していない。
そこで、準安定領域で核形成を強制的に引き起こすことを模索した。そのためには、溶液に機械的な衝撃を与えるなどの誘因が必要である。我々は短パルスレーザーを溶液に集光照射することで刺激 (摂動) を与え、結晶核を生成することに成功した2-5)。
3.レーザー照射による結晶化
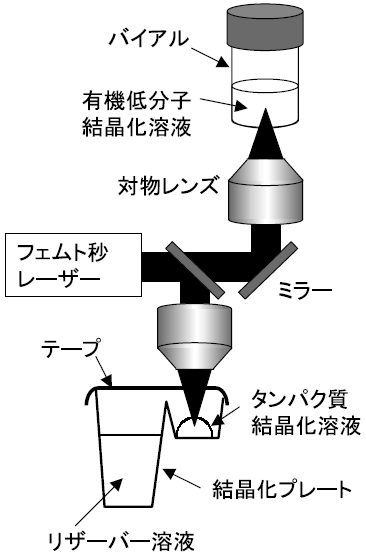
育成容器内に密封された結晶化溶液に対して、外部から再現よく刺激を与えるためには、レーザーを用いるのが得策である (図2)。容器や溶液に光の吸収がない近赤外のレーザー光を対物レンズで集光することにより、溶液内の一点 (微小空間) にエネルギーを集中できる。さらに、パルス幅の短いフェムト秒レーザー (波長:800 nm、パルス幅: 120 fs) を用いると、極めて短い時間に高強度の光を空間的にも時間的にも集中させることができる。そのため、集光位置では多光子吸収という現象が生じ、溶液内で気泡や衝撃波の発生などが誘起される6)。これが起因となり、核発生が生じる。ただし、レーザー照射による核発生の詳細なメカニズムは解明できていない7)。
図2 フェムト秒レーザー照射による結晶化セットアップ
さらにこの過程では、熱の発生を無視できるため、溶液の温度上昇やタンパク質の変性などの悪影響は観測できない8)。
フェムト秒レーザー照射による結晶化技術 (LIGHT: Laser irradiated growth technique) が、前述した結晶化の矛盾を解決するツールとなり得るかもしれない。
4.結晶化の成功例
LIGHTの有効性を示す実験結果の一例を紹介する。トリパノソーマ由来プロスタグランジンF2α合成酵素9)の結晶化では、結晶化期間が劇的に短縮した。結晶化はハンギングドロップ蒸気拡散法で行い、室温でフェムト秒レーザーを結晶化溶液内に集光照射した。その後、293 Kに設定した恒温槽内に静置して育成した。レーザー光の照射時間は0.06秒であり、照射なしのサンプルと比較した。このサンプルは結晶化が困難で、結晶が析出したとしても数ヶ月から半年を要していたが、レーザーを照射したサンプルでは2日後に結晶の析出を顕微鏡観察で確認した。レーザーを照射しないサンプルは、3ヶ月以上経っても結晶の析出は確認できなかった。
創薬ターゲットの半数以上を占めるといわれる膜タンパク質の結晶化においても、LIGHTは有効である。膜タンパク質では、界面活性剤でタンパク質を可溶化しているため、時間とともにその効果が薄れてくる。つまり、短時間で結晶化を完了することが求められる。多剤排出トランスポーターAcrBの結晶化事例を紹介する。
AcrBは1049アミノ酸からなるポリペプチドを1つのモノマーとして、それらが3つ絡み合った三量体膜タンパク質である。結晶化前の溶液状態でも三量体で存在することが示されている。従来の結晶化手法では、緻密な結晶化実験で得られる最良の結晶をもってしても、X線回折測定の分解能は3.5 Åに止まっていた10)。できるだけ過飽和度の低い溶液から結晶化させていたが、“結晶化の矛盾”の壁に阻まれ、ゆっくり成長させることができなかった (図3a)。

LIGHTはこの壁をいとも簡単に打ち破った。結晶化剤として用いていたポリエチレングリコールの濃度を下げた低過飽和溶液にレーザーを照射した。未照射の溶液からは結晶が析出しなかったが、レーザー照射した溶液からは結晶の析出を観測できた。得られたAcrB結晶のX線回折測定の分解能は2.3 Åであった (図3b)11)。低過飽和溶液中で結晶の核形成と成長の2つを制御できたことが劇的な品質の向上につながった。
最近では、タンパク質とtRNAの複合体12,13) や膜タンパク質複合体SecDF14) など、より結晶化が困難な材料においても、高品質結晶の作製に成功している。
5.まとめ
レーザー照射により結晶育成を積極的に制御することで高品質結晶の作製を実現できることを述べた。本稿では、タンパク質の結晶化が中心であったが、有機低分子の結晶化などに関してもLIGHTは有効である15)。特に、結晶化受託ビジネスとしては、製薬メーカーの有機低分子の結晶化に対するニーズが旺盛であるため、タンパク質結晶化の受託件数を超える勢いで受注が増えている。
LIGHTは、対象サンプルに依存することなく、適応範囲の広い、汎用技術として活用できる可能性が高い。今後は、技術改良や新技術開発など、さらに結晶化技術を進展させることで、結晶化の成功確率を100%に近づけていきたい。
現在は、国内のみで結晶化サービスを提供しているが、今後は海外にもサービス展開していく予定である。日本発の新しい結晶化技術が、世界標準になることを期待する。今後も創薬支援ベンチャーとして、結晶化で社会貢献できれば本望である。
文献
1) Adachi, H., Takahashi, Y., Yabuzaki, J., Mori, Y., Sasaki, T.: J. Cryst. Growth, 198/199, 568 (1999).
2) 安達宏昭、細川陽一郎、高野和文、常定扶美、増原 宏、吉村政志、森 勇介、佐々木孝友: 日本結晶成長学会誌, 29, 445 (2002).
3) Adachi, H., Takano, K., Hosokawa, Y., Inoue, T., Mori, Y., Matsumura, H., Yoshimura, M., Tsunaka, Y., Morikawa, M., Kanaya, S., Masuhara, H., Kai, Y., Sasaki, T.: Jpn. J. Appl. Phys., 42, L798 (2003).
4) 安達宏昭、細川陽一郎、増原 宏、吉村政志、森 勇介、佐々木孝友: レーザー研究, 32, 84 (2004).
5) 安達宏昭、高野和文、松村浩由、井上 豪、森 勇介、佐々木孝友: 日本結晶学会誌, 46, 238 (2004).
6) 増原宏、細川陽一郎: レーザーが拓くナノバイオ, 化学同人社, 4章(2005).
7) Oxtoby, D. W.: Nature, 420, 277 (2002).
8) Murakami, S., Kashii, M., Kitano, H., Adachi, H., Takano, K., Matsumura, H., Inoue, T., Mori, Y., Doi, M., Sugamoto, K., Yoshikawa, H., Sasaki, T.: Jpn. J. Appl. Phys., 44, 8216 (2005).
9) Okano, Y., Inoue, T., Kubota, B. K., Kabututu, Z., Urade, Y., Matsumura, H., Kai, Y.: J. Biochem., 132, 859 (2002).
10) Murakami, S., Nakashima, R., Yamashita, E., Yamaguchi, A.: Nature, 419, 587 (2002).
11) Adachi, H., Murakami, S., Niino, A., Matsumura, H., Takano, K., Inoue, T., Mori, Y., Yamaguchi, A., Sasaki, T.: Jpn. J. Appl. Phys., 43, L1376 (2004).
12) Numata, T., Ikeuchi, Y., Fukai, S., Adachi, H., Matsumura, H., Takano, K., Murakami, S., Inoue, T., Mori, Y., Sasaki, T., Suzuki, T., Nureki, O.: Acta.Crystallogr., F62, 368 (2006).
13) Numata, T., Ikeuchi, Y., Fukai, S., Suzuki, T., Nureki, O.: Nature, 442, 419 (2006).
14) Tsukazaki, T., Mori, H., Fukai, S., Numata, T., Perederina, A., Adachi, H., Matsumura, H., Takano, K., Murakami, S., Inoue, T., Mori, Y., Sasaki, T., Vassylyev, D. G., Nureki, O., Ito, K.: Acta.Crystallogr., F62, 376 (2006).
15) Hosokawa, Y., Adachi, H., Yoshimura, M., Mori, Y., Sasaki, T., Masuhara, H.: Cryst. Growth Des., 5, 861 (2005).