【トピックス】
テーラーメイド生体触媒 (抗体酵素) の分子設計
円谷 健、藤井郁雄
大阪府大院・理
1.はじめに
抗体と酵素は、生体内で重要な役割を果たしているタンパク質である。両者は特定の化合物に強く結合する能力を備えているが、それらの特性は全く異なっている。Paulingはこれら二つのタンパク質の化学的特性の違いをつぎのように説明した1)。酵素は反応の遷移状態に結合して、それを安定化することにより活性化エネルギーを低下させ、反応を加速する。一方、抗体は化合物の基底状態にのみ結合し、反応を触媒することはない。侵入してくる抗原は多種多様なものなので、それらに対応するためには抗体産生のための非常に特異な仕組みが必要となる。抗体は、多様性の発生、提示、選別の過程を経てつくられている。すなわち、免疫系は、天然のコンビナトリアル・バイオエンジニアリングであり、これを利用することによって目的とした性質をもつ抗体を手に入れることができる。これまで、抗体は微量成分の検出やウィルス感染の中和などに用いられてきたが、酵素と同様に触媒機能を有する抗体が見いだされている。天然の酵素分子が化学反応において遷移状態と結合し、安定化することによって触媒機能を発揮しているように、化学的に安定な遷移状態アナログを抗原として得られる抗体タンパク質は、天然の酵素と同様に遷移状態の基質分子に結合して安定化し、反応を加速するようになる。このような触媒機能を有する抗体タンパク質を「抗体酵素」(Catalytic Antibody) とよぶ2-5)。ヒトやマウスの体内には膨大な種類の抗体レパートリーが備わっている。そのため、いかなる反応であっても適切な遷移状態アナログを設計することにより、自由自在に希望する反応を触媒できる抗体、つまりテーラーメイドの抗体酵素を創り出すことができる可能性を秘めている。また、抗体の調製は、マウスに免疫したり、ファージ抗体法を用いて行う。したがって、我々が行わなければならないのは、希望する性質を有する抗体を選択するための遷移状態アナログを設計合成することであり、有機化学者にとっても非常に魅力的な研究分野である。本稿では、我々が抗体酵素の触媒機構を解明するために行った最新の研究成果を紹介し、抗体酵素の可能性を探ってみたい。
2.抗体に触媒機能を付与する
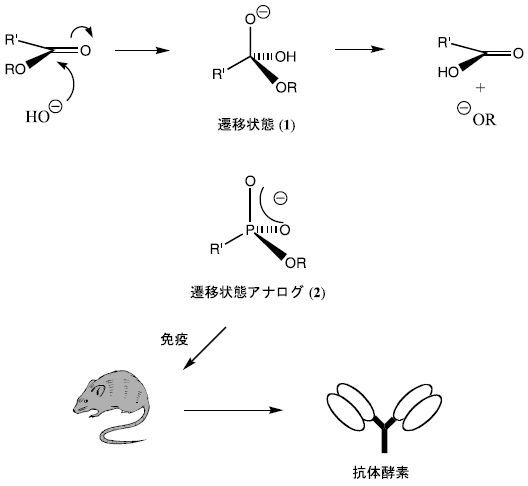
抗体は、もともと安定な抗原への親和性に基づき選択される。したがって、酵素の持つ触媒機能を抗体で実現するためには、何らかのトリックが必要となる。その一つの方法に遷移状態アナログに対する親和性を基準として抗体を選別する方法がある。図1にエステル結合の加水分解反応の例を示した。エステルの加水分解反応は、カルボニル基の酸素原子上に負の電荷をもつ高エネルギーな四面体遷移状態 (1) を経て進行する。この遷移状態によく似た安定な化合物としてリン酸エステル化合物 (2)6) が遷移状態アナログとして使われる。実際に、リン酸エステルを免疫することによって得られる抗体は、反応の活性化エネルギーを減少させ、加水分解反応を加速する。現在、エステル加水分解の遷移状態 (1) のアナログとしてリン酸エステル (2) を免疫することによって、数多くのエステル加水分解抗体酵素が作製されている。
図1 リン酸エステル化合物 (2) の免疫によるエステル加水分解抗体酵素の作製
3.遷移状態アナログの免疫による抗体酵素の作製:プロドラッグ医薬品の活性化
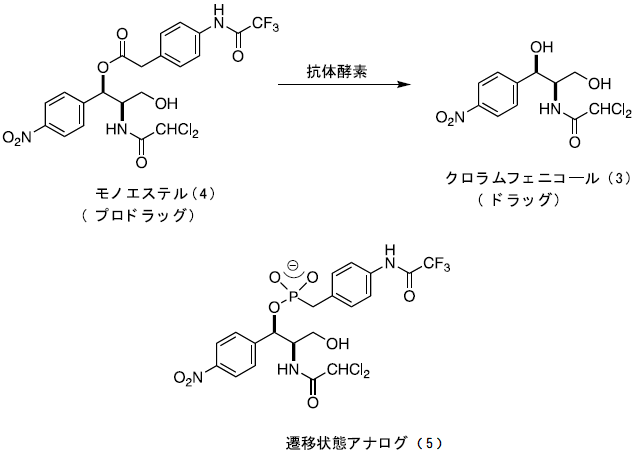
抗体酵素は、その開発当時より様々な分野で有用な利用が期待されてきたが、その具体的な例を示すことができないでいた。そこで、筆者らはプロドラッグ医薬品を特異的に活性化する抗体酵素を作製することにより、初めて医学応用への可能性を示すことに成功した7)。プロドラッグとは、医薬品の物性の改善や毒性軽減を目的として化学修飾された化合物であり、それ自身は薬理活性を示さないが、投与後生体の酵素やpHの変化により元の医薬品 (親ドラッグ) に変換されて薬理作用を発揮するものである。もし、生体内の天然酵素に対して安定なプロドラッグをテーラーメイドの抗体酵素で活性化することができれば、病巣特異的なドラッグ・デリバリーが可能になる。そこで、モデル医薬品として抗生物質であるクロラムフェニコール (3) を取り上げ、そのプロドラッグであるモノエステル (4) を加水分解する抗体を作製した (図2)7)。
図2 抗体酵素によるプロドラッグ医薬品の活性化
クロラムフェニコール・モノエステル (4) の加水分解反応の遷移状態アナログであるホスホン酸エステル (5) を合成し、キャリアータンパク質 (KLH) と縮合後、これを抗原としてマウスに免疫した。定法に従ってハプテン (5) に結合活性を持つ11種類の抗体を作製した。得られた抗体についてプロドラッグであるモノエステル (4) の加水分解活性を検討したところ、6種の抗体に顕著な触媒活性が観測された。もっとも活性の高かった抗体6D9はMichaelis-Menten型反応速度式に従って反応を加速し (kcat=0.129 min-1, Km=61.4μM)、抗体が無いときに比べて反応を約900倍加速した。また、反応液に遷移状態アナログ (5) を添加すると、抗体6D9による触媒反応は完全に阻害された (Ki=55.6 nM)。さらに、抗体酵素6D9によるプロドラッグ医薬品の活性化を細菌の増殖阻害実験により評価したところ、プロドラッグは天然酵素に対しては安定で、抗体酵素でのみ活性化されることが示された。
4.抗体酵素の構造と機能
4-1 遷移状態理論解析
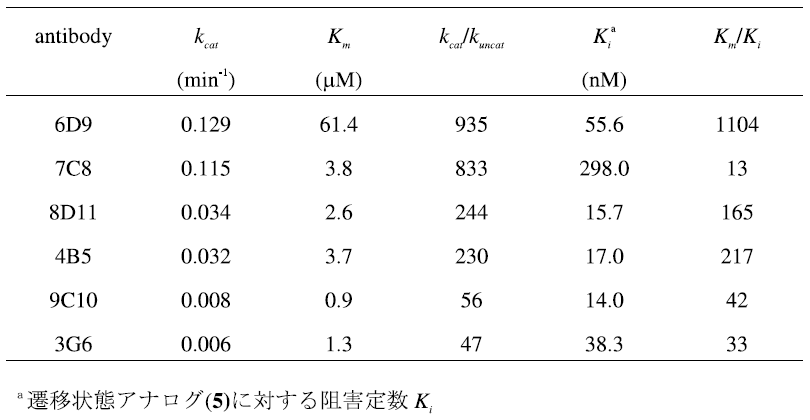
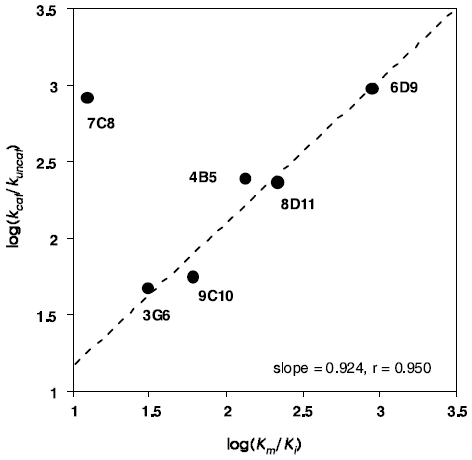
遷移状態アナログ (5) の免疫によって誘導される一連の抗体酵素の触媒活性と結合活性を表1に示す。これらのkcat値やKm値を使って遷移状態理論解析すると、触媒活性と結合活性に相関性が観測される。抗体酵素による反応が遷移状態理論に従うとすれば、その反応加速 (kcat/kuncat) は基質の基底状態と遷移状態に対する抗体の結合活性の差 (KS/KTS) から予測できる (kcat/kuncat=KS/KTS)8)。基質の基底状態の結合活性はミカエリス定数 (Km) により評価することができる。また、遷移状態に対する親和性 (KTS) は直接測定できないので、遷移状態アナログに対する阻害定数 (Ki) として評価すると、抗体6D9をはじめとして8D11、4B5、9C10、3D11の5種の抗体は、その反応加速と結合活性の比率はほぼ一致し、直線関係が得られた (kcat/kuncat=Km/Ki, 図3)9,10)。すなわち、得られた抗体酵素は、エステル・カルボニル基への水酸イオンの攻撃により生じる遷移状態と結合し安定化することよって反応を触媒している。この解析が示すように、遷移状態アナログに対して高い親和性を持つ抗体が、必ずしも高い触媒活性を示すとは限らない。触媒作用の発現するために重要なことは、基質の遷移状態に対する強い結合と基底状態への弱い結合であり、その親和性の差の大きい抗体が高い触媒活性を持つ。一方、先の直線関係から大きく外れ、反応加速と結合活性の比率は一致しない抗体酵素も生成する。抗体7C8の場合、基質への結合活性と遷移状態アナログへの結合活性に大きな差がないにもかかわらず、高い触媒活性を示す。抗体7C8では、異なった触媒機構で反応を加速していることが推察される。実際に、抗体7C8のX線結晶解析ならびに反応速度論的解析の結果、本抗体ではTyrH95の脱プロトン化したフェノキシドが求核触媒として機能していることが明らかとなっている11)。
表1 単一のハプテンから誘導される抗体酵素の触媒活性および結合活性
図3 遷移状態アナログ (5) の免疫により誘導された抗体酵素の遷移状態理論解析
4-2 抗体酵素の立体構造
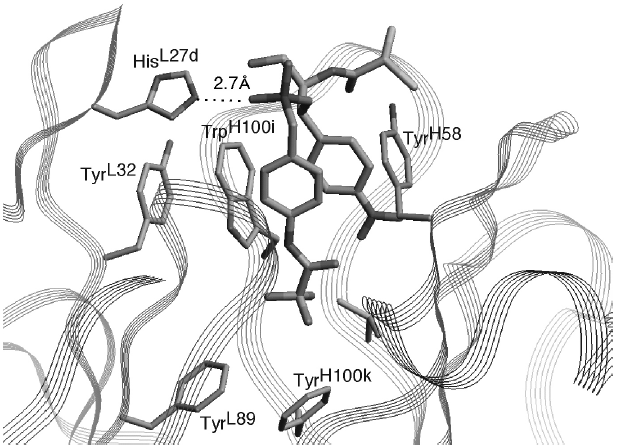
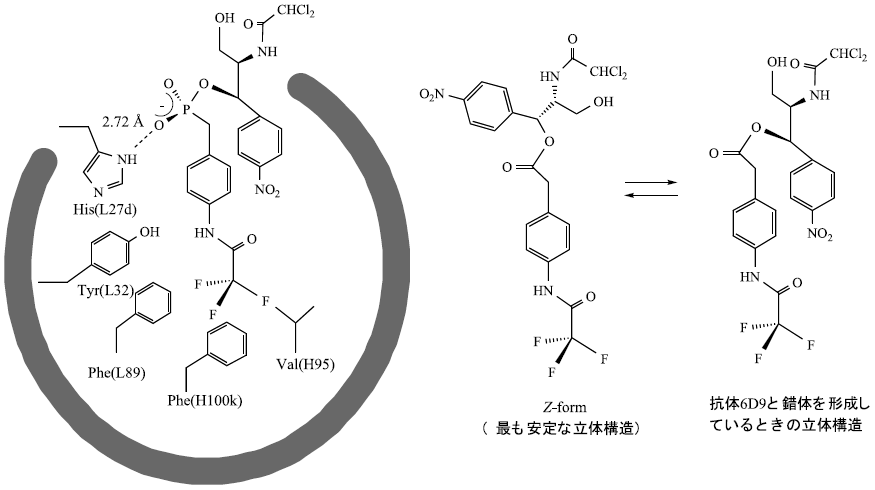
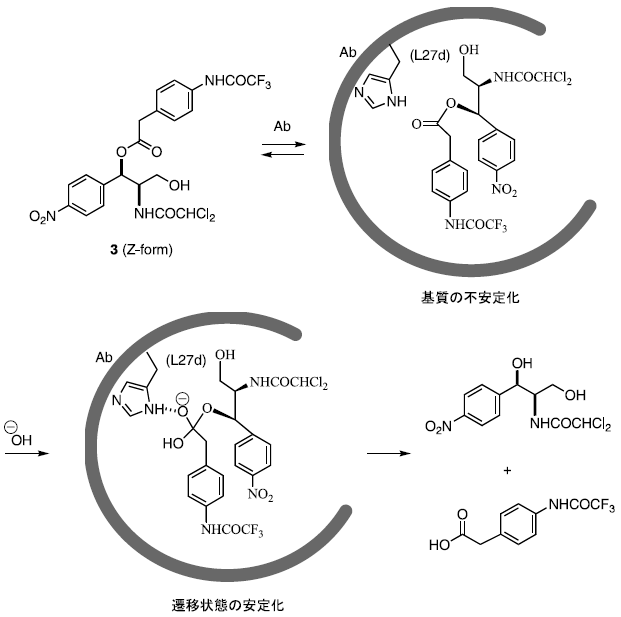
抗体酵素の触媒機構を明らかにするために、抗体6D9のX線結晶解析を行った12)。図4に示すように、抗体酵素6D9は比較的深い抗原結合部位を形成しており、その底には疎水性アミノ酸残基により疎水的結合場を形成している。もっとも興味深い、遷移状態を模倣しているホスホン酸エステル部の酸素原子は、抗原結合部位の入り口に位置するHisL27dと水素結合している。このHisL27dは4種類の抗体酵素 (6D9, 4B5, 8D11, 9C10) で保存されており、部位特異的変異操作によりHisL27dをAlaに置換した抗体は全く触媒活性を失う13)。以上の結果より、抗体酵素6D9においては、L鎖CDR-1領域のHisL27dが遷移状態のオキシアニオンと水素結合あるいは静電的相互作用し、遷移状態を安定化して触媒機能を発現している。
図4 抗体酵素6D9の抗原結合部位の立体構造
また、抗体と遷移状態アナログの錯体において、結合している遷移状態アナログの2個のベンゼン環は、TyrH58およびTrpH100iとのσ-π相互作用で抗原結合部位の深い位置に取り込まれている。結合状態にある遷移状態アナログの立体構造より、基質のエステル部は熱力学的に不安定な非平面構造をとっていることが示唆される (図5)。この様に基質がひずむことにより、遷移状態へ到達するのを容易にしているものと考えられる。
図5 抗体酵素6D9の抗原結合部位の構造および抗体中における基質の立体構造
4-3 抗体酵素の結合に関する熱力学的解析
すでに述べたように、抗体酵素による反応が遷移状態理論に従うとすれば、その反応加速 (kcat/kuncat) は基質の基底状態と遷移状態アナログに対する抗体の結合活性の差 (KS/KTSA) に等しくなる (kcat/kuncat=KS/KTSA)。遷移状態理論のもっとも重要な点は、反応速度が基質の基底状態と遷移状態のギプスの自由エネルギーの差に関係づけられることである。そこで、抗体酵素6D9の触媒機構をさらに明らかにする目的で、6D9の遷移状態アナログならびに基質との結合に関する熱力学的解析を等温滴定型カロリメトリー (ITC) を用いて行った14)。また、6D9の対照として、9C10を選んだ。9C10は6D9と比べて約10倍ほど触媒活性が低いにもかかわらず、6D9と同じ触媒残基 (HisL27d) を持ち、また、各種反応速度論解析の結果から、6D9と類似の触媒機構を有すると考えられる。
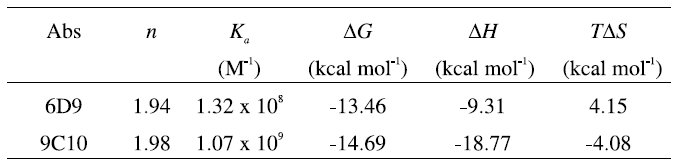
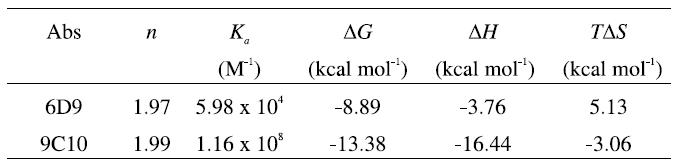
基質と遷移状態アナログに対してITC の測定から得られた熱力学的パラメーターを表2および表3に示した。非常に興味深いことに、6D9との結合では、基質、遷移状態アナログいずれの場合にも正のエントロピー変化が観測された。これは、通常の抗原-抗体反応としては非常に珍しい現象であり、基質や遷移状態アナログとの結合の際に非常に大きな疎水相互作用が働くために、水分子が脱離した結果であると解釈される。
![]()
![]()
さらに、基質と遷移状態アナログとの熱力学的パラメーターの差を計算した結果を表4に示した。6D9ならびに9C10のΔΔGはそれぞれ-4.57 kcal mol-1、-1.27 kcal mol-1であり、これらの値はkcat/kuncatおよびKS/KTSAから計算される値にほぼ等しい。また、自由エネルギーの差 (ΔΔG) をそれぞれエンタルピー項 (ΔΔH) とエントロピー項 (ΔΔS) の寄与に分解して分析すると、基質に対して遷移状態アナログの結合が強いのは主にエンタルピー項 (ΔΔH) の寄与が大きいためであり、エントロピー項の寄与は非常に小さいことがわかる。1本の水素結合によるΔΔHは最大で2 kcal mol-1であるから、6D9 (ΔΔH=-5.55 kcal mol-1) ならびに9C10 (ΔΔH=-2.22 kcal mol-1) において観測されるΔΔH においては、何らかの他の要因を考慮する必要がある。
![]()
すでに報告されているように、基質の基底状態の不安定化はkcatならびにエンタルピー (ΔΔH) の上昇を伴い、これは基質結合における「エンタルピー歪み」として知られる15-17)。6D9の-ΔΔHが9C10にくらべて大きな値を示す事実は、6D9の方が大きな触媒活性 (kcat) を示すことと一致している。このようなエンタルピー歪みは基質との結合を不安定化させ、その結果6D9はより効率よく触媒反応を加速する。今回の結果は、熱力学的平衡を観測することによって、触媒反応におけるエンタルピー歪みを初めて観測したものである。
5.抗体酵素の触媒機構
各種反応速度論的解析ならびに遷移状態理論解析の結果から示されるように、抗体酵素6D9は、遷移状態アナログの設計から期待されるように、水酸イオンがエステルのカルボニルを攻撃することによって生成する遷移状態の安定化を主な触媒因子として、反応を加速している。また、X線結晶解析や部位特異的変位の結果から、6D9では軽鎖CDR1に存在するHisL27dが触媒残基として働き、水素結合あるいは静電的相互作用により遷移状態を安定化している。さらに、熱力学的解析の結果から示されるように、「エンタルピー歪み」が基質の遷移状態と基底状態との結合の差を増大させ、その結果、効率よく反応を触媒している。図6に抗体酵素6D9のエステル基質の加水分解反応における触媒機構をまとめた。
図6 抗体酵素6D9の触媒機構
6.おわりに
抗体酵素とは生体のもつ免疫システムを利用して、多種多様な抗体タンパク質のレパートリーの中から、ハプテンのデザインにより望んだ触媒機能を持つ抗体を選別しようとするものである。これは、酵素が何億年という長い年月をかけて進化を繰り返し選別されることによって、高度な機能を獲得してきたことと似ており、機能デザインのための最も合理的な方法とも考えられる。1986年に最初の抗体酵素が見いだされてから、今日までに多くの抗体酵素が作製され、ペリ環状反応から加水分解反応までのいろいろな化学反応が抗体によって触媒されることがわかってきた。また、本稿で紹介したようにX線構造解析などによる分子認識や触媒機構の詳細な研究が報告され、抗体酵素の実態が明らかになりつつある。この分野の次の重要な研究課題は、抗体酵素が実用的に利用できることを示すことであろう。
文献
1) Pauling, L.: Am. Scient., 36, 51 (1948).
2) Schultz, P. G., Lerner, R. A.: Science, 269, 1835(1995).
3) 円谷 健: 化学と教育, 53, 440(2005).
4) 円谷 健、藤井郁雄: 生物工学会誌, 84, 316(2006).
5) Kainan, E., Ed. Catalytic Antibodies, Wiley-VCH, Weinheim (2005).
6) Teraishi, K., Saito, M., Fujii, I., Nakamura, H.: Tetrahedron Lett., 33, 7153 (1991).
7) Miyashita, H., Karaki, Y., Kikuchi, M., Fujii, I.: Proc. Natl. Acad. Sci. USA, 90, 5337 (1993).
8) Jacobs, J. W.: Bio/Technology, 9, 285 (1991).
9) Fujii, I., Tanaka, F., Miyashita, H., Tanimura, R., Kinoshita K.: J. Am. Chem. Soc., 117, 6199 (1995).
10) Takahashi, N., Kakinuma, H., Liu, L., Nishi, Y., Fujii, I.: Nature Biotechnology, 19, 563 (2001).
11) Gigant, B., Tsumuraya, T., Fujii, I., Konssow, M.: Structure, 7, 1385 (1999).
12) Kristensen, O., Vassylyev, D. G., Tanaka, F., Morikawa, K., Fujii, I.: J. Mol. Biol., 281, 501 (1998).
13) Miyashita, H., Hara, T., Tanimura, R., Fukuyama, S., Cagnon, C., Kohara, A., Fujii, I.: J. Mol. Biol., 267, 1247 (1997).
14) Oda, M., Ito, N., Tsumuraya, T., Suzuki, K., Fujii, I., submitted for publication.
15) Jencks, W. P.: Catalysis in Chemistry and Enzymology, McGraw Hill, New York (1969).
16) Bruice, T. C., Benkovic, S. J.: Biochemistry, 39, 6267 (2000).
17) 林 秀行: 生化学, 74, 5 (2002).