【トピックス】
固定化酵素を利用した生理活性キトサンオリゴ糖の効率的生産技術の開発
黒岩 崇、市川創作、佐藤誠吾、向高祐邦
筑波大院・生命環境
1.はじめに
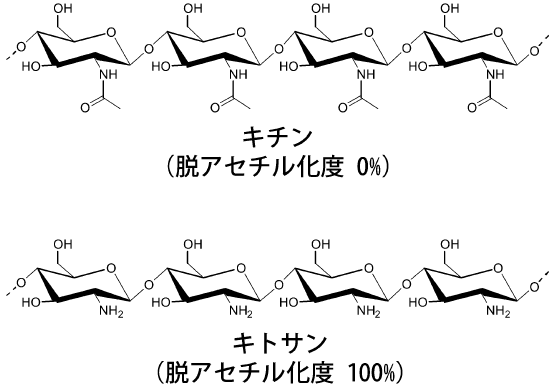
再生可能な天然資源であるバイオマスを原料とした物質生産技術は、持続的な物質循環社会の実現に向けた技術として注目されている。なかでも、カニやエビなどの外殻を原料とするキチン・キトサン (図1) は、セルロースに次いで地球上に大量に存在するともいわれており、未利用バイオマスとしてその有効利用技術の開発が望まれている。特にキトサンは、分子内に多数のアミノ基を持ち、他の糖質資源にはないユニークな特性を示すことから、様々な分野での利用が検討されている。最近では、高分子のキトサンだけでなく、キトサン分解物をはじめとする低分子誘導体の利用についても広く研究が行われている。本稿では、キトサンの低分子誘導体のうち、水溶性の機能性素材として近年注目を集めているキトサンオリゴ糖の生産技術に関して著者らが行ってきた研究を紹介したい。
図1 キチンおよびキトサンの化学構造
2.キトサンオリゴ糖とは
キトサンオリゴ糖は、キトサンの単量体であるグルコサミンが2~10個程度結合したオリゴ糖である。多くのオリゴ糖と同様、難消化性 (おなかの調子を整える) や抗う蝕性 (虫歯になりにくい) などの機能を有するほか、抗菌性、抗腫瘍性、免疫賦活活性など、本オリゴ糖に特徴的な多くの生理機能が報告されている。それぞれの生理機能の詳細については総説1,2) 等を参照されたい。
キトサンオリゴ糖は、原料であるキトサンに比べて水に対する溶解度が高く、上記の生理機能を発現する濃度範囲における溶液の粘度上昇もわずかであるため、食品をはじめとした各種用途への利用が期待できる。その生理機能は、糖の重合度と深く関わっており、5糖や6糖、あるいはそれ以上といった比較的重合度の高いオリゴ糖に優れた生理機能が多く見出されている。従って、より付加価値の高いキトサンオリゴ糖製品を得るためには、製品中の5糖以上の高機能オリゴ糖の含有量を高めることが必要となる。以下の節では、これら5糖以上のキトサンオリゴ糖の収率に着目し、その生産方法について述べる。
3.キトサンオリゴ糖の生産方法:化学法と酵素法
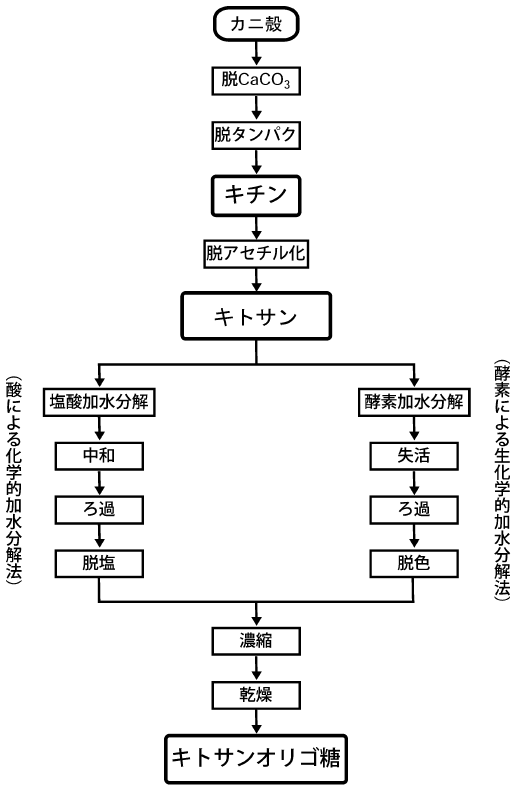
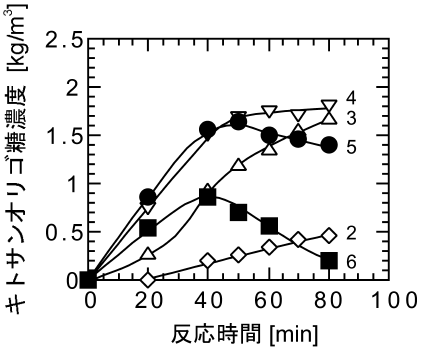
キトサンオリゴ糖は、一般にキトサンの部分加水分解により生産される。キトサンの加水分解には、酸を利用した化学法と、キトサン分解酵素を利用した酵素法がある (図2)3)。化学法では、通常、6~12 mol/L 程度の塩酸中、50~80℃で加水分解を行う。本法は、工業的なキトサン分解プロセスに広く用いられており、低コストが利点である。その一方で、反応の選択性が低く、多量の単糖グルコサミンを生成するため、重合度の高いオリゴ糖の収率が低いことが問題となる。一方、酵素法では、単糖の生成量が少なく、オリゴ糖の収率を高めることができる。さらに、常温、常圧、中性~弱酸性という温和な条件下で反応を行うことができる点も酵素法の特徴である。図3は、キトサン分解酵素であるキトサナーゼ (Bacillus pumilus BN-262株由来4,5)) によりキトサンの加水分解を行った際の、キトサンオリゴ糖の生成経過を示したものである6)。図に示すように、反応の進行に伴い、2糖から6糖のオリゴ糖が生成し、生理活性が高いとされる5糖および6糖のオリゴ糖の対原料収率は最大で40%以上に達する。この値は、塩酸加水分解法で報告されている収率 (~15%) に比べて高く、キトサナーゼの利用が重合度の高いキトサンオリゴ糖の生産に有効であることがわかる。しかしながら、重合度の高いオリゴ糖はキトサン加水分解反応の中間生成物であるため、さらに反応が進行すると重合度の低いオリゴ糖へと分解されてしまう。従って、重合度の高いオリゴ糖をより多く含む製品を得るためには、これらの収率が最も高い時点で反応を速やかに停止する必要がある。しかし、酵素が反応液中に溶解している場合、反応を停止するためには、通常、酵素を失活させ除去しなくてはならない。さらに、酵素失活処理の際に反応液の着色を伴うため、反応後に脱色操作も必要となり、プロセスが煩雑になってしまうといった問題がある。
図2 キトサンオリゴ糖の生産プロセス (文献3を改変)

4.多点結合法によるキトナサーゼの固定化と安定化
この様な背景から、著者らは、酵素キトサナーゼの固定化利用を検討した。本反応系の場合、固定化により反応液と酵素との分離が容易になれば、5糖と6糖のオリゴ糖の濃度が最も高い時点で速やかに反応を停止できるため、有用なオリゴ糖の収率を高めることができる。さらに、高価な酵素をその都度失活させることなく連続的なキトサンオリゴ糖生産が可能になるため、酵素のコストおよびエネルギーコストの面でも有利になる。
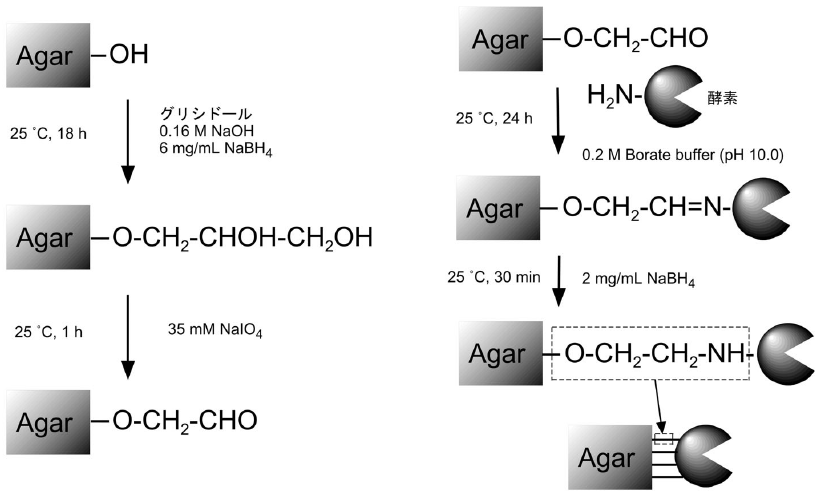
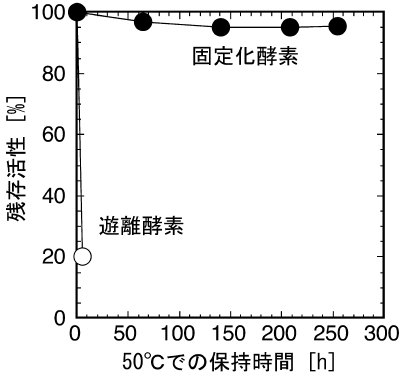
種々の固定化方法および固定化担体を検討した結果、活性化寒天ゲルを担体とした多点結合法7)により固定化したキトナサーゼが、極めて高い安定性を有することが明らかとなった8)。図4に、多点結合法による酵素の固定化法の概略を示す。本法では、寒天ゲルに多量に含まれる水酸基をグリシドールによりグリセリル基とした後、これを酸化して担体にアルデヒド基 (グリオキシル基) を付与する。続いてこの活性化寒天ゲルと酵素を接触させ、担体のアルデヒド基と酵素のアミノ基との間にシッフ塩基を形成させる。この結合自体は弱く可逆的であるが、担体の活性化条件を適切に設定すれば、酵素-担体間に多点で複数の結合が形成され、酵素が安定に固定化される。酵素と担体を十分接触させ多点結合が形成されたら、還元剤処理により結合を安定化させる。このようにして調製した固定化キトナサーゼは、遊離酵素と比較して極めて安定であった (図5)8)。また、5回の繰り返し反応に使用したり、冷蔵庫で1ヵ月程度保存したりしても、調製直後と比較して活性の低下はほとんど認められなかった。なお、本法で得られる固定化酵素の活性や安定性は、酵素-担体間の結合形成数に大きく依存する8,9)ため、優れた固定化酵素を開発する際には、担体の活性化条件を十分検討し、担体上のアルデヒド基密度を適切に制御する必要がある。
図4 多点結合法による酵素の固定化
図5 遊離および固定化キトナサーゼの熱安定性
5.キトサンオリゴ糖生産のためのバイオリアクターの開発とその設計指標
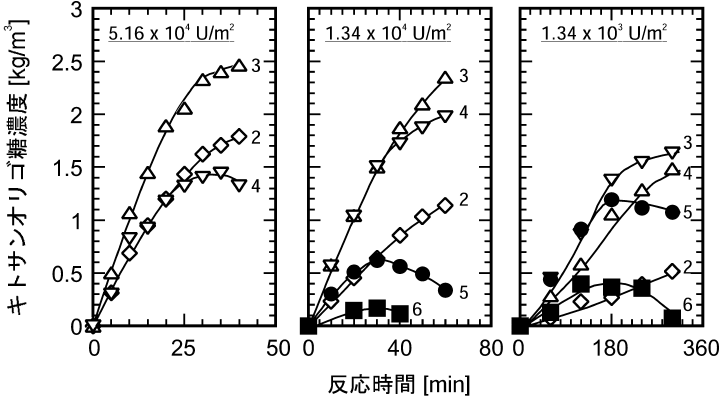
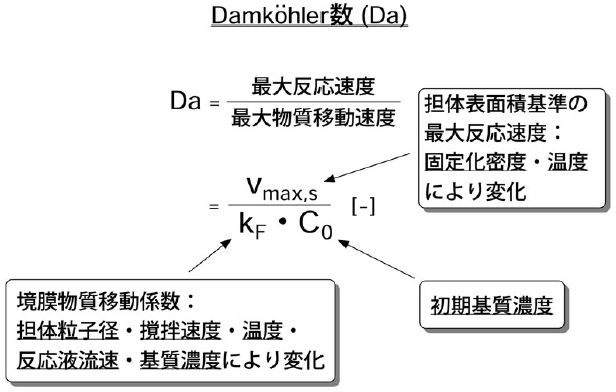
固定化キトサナーゼを用いてキトサンオリゴ糖を生産する場合、十分な活性を有する固定化酵素を調製しても、反応条件が適切でないと有用なキトサンオリゴ糖の生産性が著しく低下してしまう場合がある。一例として、図6に種々の酵素固定化密度で調製した固定化キトナサーゼによるキトサン加水分解反応の経時変化を示した6)。酵素の固定化密度が高い場合、加水分解反応自体は速やかに進行するが、有用な5糖以上のオリゴ糖は全く検出されなかった (図6左)。一方、酵素の固定化密度の低い固定化酵素を用いて反応を行った場合、固定化密度の減少に伴い、より多くの5糖と6糖のオリゴ糖の生成が認められた (図6中央および右)。すなわち、重合度の高いキトサンオリゴ糖の生産を目的とする場合、操作条件によっては、反応は進行しても目的生産物がほとんど得られない場合があることがわかった。この他にも、担体粒子径、反応温度、撹拌速度、および初期基質濃度の諸因子が5糖と6糖の最大収率 (5糖と6糖の濃度が最大となる時点でのこれらの対原料収率) に影響を及ぼすことを撹拌槽型リアクターによる回分反応実験により明らかにした6)。さらに、充填層型リアクターによる連続反応においても、酵素の固定化密度および反応液流速が最大収率に影響を及ぼすことが明らかとなった10)。これらの実験結果から、5糖と6糖の収率には担体表面近傍の反応速度および物質移動速度が関与していることが示唆された。そこで、担体表面近傍の最大反応速度と最大物質移動速度の比として次式のように定義される無次元数であるDamköhler数 (Da) を用いて、実験結果の統一的な整理を試みた。


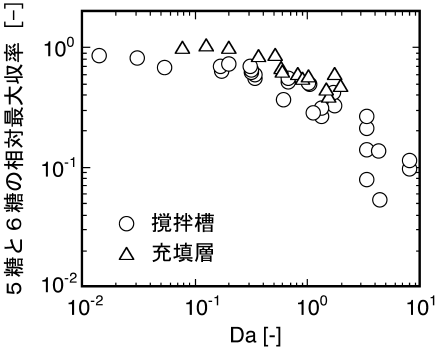
ここで、Vmax,sは担体単位表面積あたりの最大反応速度[kg/(m2s)]、kFは境膜物質移動係数[m/s]、C0は液本体の初期基質濃度[kg/m3]である。上述の操作因子の変化は、図7に示すようにDaに集約でき、各因子の影響の相対的な大きさはDaによって定量的に評価できる。図8は、Daと5糖と6糖の最大収率との関係をまとめたものである6,10)。図の縦軸の値は、各反応条件における5糖と6糖の最大収率を、遊離酵素を用いた回分反応におけるこれらの最大収率を基準として規格化した相対値として示してある。図中○印は撹拌槽型リアクターによる回分反応、△印は充填層型リアクターによる連続反応の結果である。この図から明らかなように、5糖と6糖の収率とDaとの間には高い相関が認められた。この結果から、有用な5糖以上のキトサンオリゴ糖の収率が、担体表面近傍における反応速度と物質移動のバランスによって支配されていることが明らかになった。さらに回分反応の結果と連続反応の結果は概ね一致しており、Daがバイオリアクターの操作条件を設定する指標として有用であることが示された。これらの結果から、酵素法によるキトサンオリゴ糖の生産プロセスを構築する際には、酵素触媒そのものの性質の向上とともに、速度論的な見地に立った反応操作条件の検討も重要であるといえる。
図7 Damköhler数
図8 5糖と6糖の相対最大収率とDamköhler数の関係
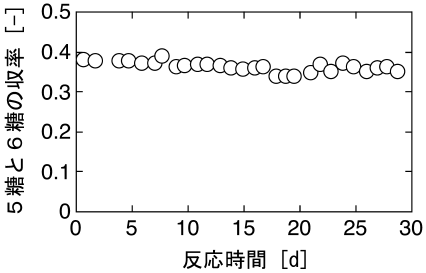
さらに著者らは、このDaを指標として充填層型バイオリアクターの最適操作条件を決定し、キトサンオリゴ糖の連続生産を行った10)。その結果、およそ1ヵ月間にわたり35%以上という高い収率で5糖以上のキトサンオリゴ糖を連続生産することに成功した (図9)。この間、5糖と6糖の生産性は20 kg/m3-reactor/day以上を維持しており、ほとんど減少は認められなかった。なお、反応器出口での還元糖濃度から推算された本リアクターの半減期は、およそ200日 (7ヵ月弱) であった。以上のように、安定性の優れた固定化キトナサーゼを開発し、これを利用したバイオリアクターを構築することで、生理活性の高い5糖以上のキトサンオリゴ糖を高収率かつ連続的に生産できた。
図9 充填層型バイオリアクターによるキトサンオリゴ糖の連続生産
6.おわりに
本稿では、酵素法によるキトサンオリゴ糖生産プロセスの効率化を目指して、工学的な見地から行った研究を紹介した。キトサンを部分的に加水分解した低分子誘導体は、ナノからマイクロサイズの様々な担体 (キャリアー) を調製する素材として利用が検討されており、薬理成分や食餌機能成分の担持、あるいは、遺伝子導入ベクターへの応用が期待されている。キトサンを素材としたキャリアーの特性は、キトサン重合度の影響を受ける。このため、固定化酵素を使って部分加水分解を行うことでキトサンの重合度を制御し、これをキャリアー調製の素材として利用することは有効である11,12)。
酵素を利用した物質生産においては、触媒である酵素の取得、改良に関する研究が不可欠であり、この段階の成否がプロセスの実現にとって極めて重要であることは言うまでもない。一方で、本稿で紹介したように、優れた性質を持つ酵素であっても、その利用方法が適切でないと酵素の特性が活かされず目的物質の生産性が低下してしまう場合もある。一般に、酵素を利用したオリゴ糖の生成反応は、複数の中間生成物が生成・消失を繰り返す複雑な機構に基づき反応が進行する複合反応系である。しかしながら、これまで、複合反応の選択性という観点から、反応機構や物質移動の影響を考慮して速度論的な立場でオリゴ糖の生成反応を検討した例は必ずしも多くない。この点は、生成物の組成が製品の価値を左右するキトサンオリゴ糖のような場合には特に注意しなければならない。今後、オリゴ糖をはじめとする様々な機能性物質の作用機序が明らかにされ、より高機能な成分の選択的な生産が求められると予想される。その効率的な生産に応えるためにも、酵素をはじめとする生体触媒の優れた性質を十二分に発揮できるように、反応系の特徴を十分考慮した反応プロセスの設計・操作が重要になると考えられる。
文献
1) 黒岩 崇、市川創作、佐藤誠吾、向高祐邦: 日本食品科学工学会誌, 52, 285 (2005).
2) 又平芳春: オリゴ糖の新知識, 食品化学新聞社, 272 (1998).
3) 山南隆徳: キチン・キトサン研究, 10, 78 (2004).
4) Fukamizo, T., Ohkawa, T., Ikeda, Y., Goto, S.: Biochim. Biophys. Acta, 1205, 183 (1994).
5) 松信俊男、蛭田 修、中川幸二、村上博志、宮道慎二、魚谷和道、武部英日、佐藤篤行: 明治製菓研究年報, 35, 28 (1996).
6) Kuroiwa, T., Ichikawa, S., Hiruta, O., Sato, S., Mukataka, S.: Biotechnol. Progr., 18, 969 (2002).
7) Guisan, J. M., Blanco, R. M.: Ann. N. Y. Acad. Sci., 501, 67 (1987).
8) Ichikawa, S., Takano, K., Kuroiwa, T., Hiruta, O., Sato, S., Mukataka, S.: J. Biosci. Bioeng., 93, 201 (2002).
9) Kuroiwa, T., Shoda, H., Ichikawa, S., Sato, S., Mukataka, S.: Process Biochem., 40, 2637 (2005).
10) Kuroiwa, T., Ichikawa, S., Sato, S., Mukataka, S.: Biotechnol. Bioeng., 84, 121 (2003).
11) Ichikawa, S., Watanabe, J., Iwamoto, S.: Biosci. Biotechnol. Biochem., 69, 1637 (2005).
12) Watanabe, J., Iwamoto, S., Ichikawa, S.: Colloids Surf. B, 42, 141 (2005).