【トピックス】
見逃されていたタマネギの催涙因子合成酵素の発見とその応用
今井真介、柘植信昭、正村典也、澤田 博
ハウス食品・ソマテックセンター
1.はじめに
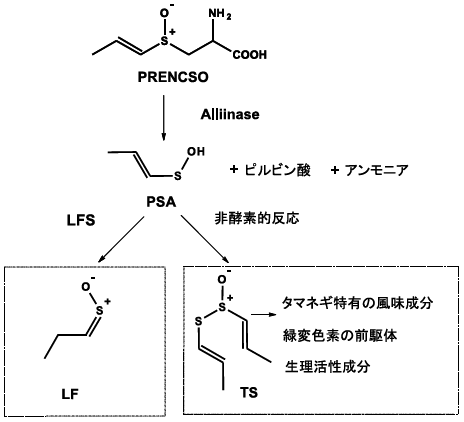
タマネギは、ユリ科ネギ属に分類される植物であり、エジプトでは、ピラミッドを造る時に、労働者に食べさせたと言う記録が残っている程、長い食経験がある野菜である。したがって、タマネギ中の成分や酵素に関する研究も古くから行われており、催涙因子 (LachrymatoryFactor:LF) に関しては、図1に示すように1-propenyl-cysteine sulfoxide (PRENCSO) と呼ばれる含硫化合物が、アリイナーゼによる分解を受けて不安定な中間体 (1-propenyl sulfenicacid:PSA) に変化した後、非酵素的に誘導されるという経路が提唱されていた1)。

しかし、我々は「常温下において、PSAからLFが非酵素的に生成する」という通説は誤りで、この反応には、催涙因子合成酵素 (Lachrymatory factor synthase:LFS) と命名した新しい酵素の存在が不可欠であることを明らかにした。LFSの発現や活性を抑えることができれば、催涙性が抑制され、しかも、独特の匂い成分や生理活性成分へと変化するthiosulfinate (TS) の量は多い、高付加価値の「催涙性抑制タマネギ」を開発することも夢ではないと考えられる。
すでに、充分に研究し尽くされたと思われていた分野で、発現量が多く、しかも重要な酵素が見落とされていたということは、研究を行った我々でさえ信じられない思いであった。本報では、LFSの存在に気付いた実験から、発見に至った研究までの概要を紹介する。
2.LFSの存在に気付くきっかけになった緑変に関する研究
レトルトカレーの製造では、タマネギとニンニクを炒める工程がある。通常この工程では、きつね色の焙煎物が得られるが、これが緑色になってしまう現象 (緑変2)) が観察された。このような緑変が起きるのは、原料中の成分が設計外の反応をしてしまっているということであり、製造上、大きな問題である。そこで、我々は、この緑変がどのような機構で発生するのか、科学的に解明する研究を開始した。
まず初めに、我々は効率的に緑変を誘導する条件を探した。その結果、タマネギを丸ごと電子レンジで加熱処理した後、粉砕した「加熱タマネギの粉砕物」と、「生のニンニクの粉砕物」を10:1の割合で混合し、室温または加温して放置すると、確実に緑変が起きることを確認した。
次に、「加熱タマネギの粉砕物」から得た抽出液を分画し、これに「生のニンニク粉砕物」から得た抽出液を加え、緑変の発生を観察する方法を用いて、緑変に関与する加熱タマネギ粉砕物中の成分を精製し、これが、PRENCSOであることを明らかにした。さらに、同様の方法を用いて、緑変に関与する生のニンニク粉砕物中の成分が、アリシンであることと、加熱タマネギの粉砕物と生ニンニクの粉砕物の両方に含まれているアミノ酸も、この変色反応に関与していることを確認した。これらの結果は、Shannonらの報告3,4)と一致するものであった。
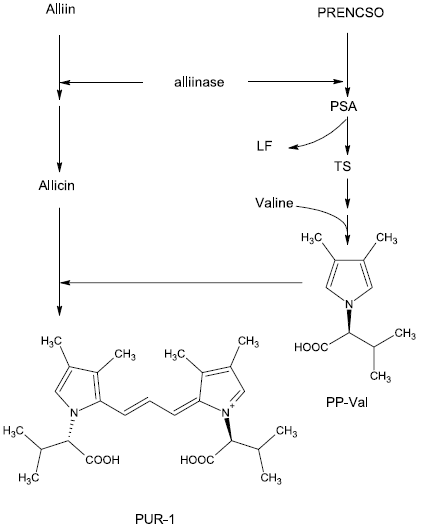
アリシンは、アリインがアリイナーゼによる作用を受けて生成する化合物であり、PRENCSOもアリイナーゼの作用を受けて図1のように分解することが知られていた。そこで、我々は、アリイン、PRENCSO、アリイナーゼ、アミノ酸の4つの既知成分から成るモデル反応系を考案し、単純な系で緑変を誘導できることを確認した5)。
3.緑変の機構解明と粗精製アリイナーゼの色素生成量に及ぼす影響
PRENCSOのアリイナーゼ分解物とアミノ酸が反応することにより、無色の色素前駆体 (Pigment Precursor:PP) が誘導され、このPPとアリシンが反応すると、緑変が誘導されることが確認できたので、我々はまず、PPの構造決定を試みた。PRENCSOをアリイナーゼで処理した後、バリンと反応させ、アリシンを加えた時に色素が誘導される性質を利用してPPを単離し、構造決定してPP-Valと命名した。さらに、精製したPP-Valとアリシンを混合し、反応の初期に誘導される赤紫色素を単離、構造決定してPUR-1と命名した。さらに、得られた結果と、PRENCSOの分解に関する既知の情報を元に、我々は緑変の反応機構を解明することに成功した (反応機構の概要を図2に示す)。
![]()
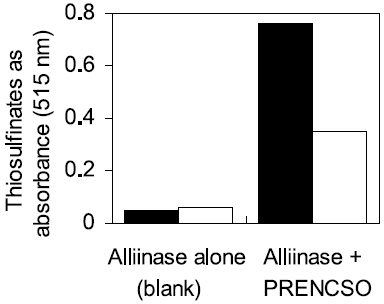
モデル系を用いた色素の誘導では、一定量のPRENCSO、アリイン、アミノ酸の混合液に、一定の活性を持つアリイナーゼを加えれば、決まった量の色素が誘導されるはずである。しかし、同じ強さのアリイナーゼ活性を示す粗酵素液でも、それがニンニク由来である場合は、タマネギ由来である場合より、色素の誘導量が多かった。そこで、PRENCSOをそれぞれのアリイナーゼの粗酵素液で処理し、生成するTSの量を比較した。どちらの場合もPRENCSOのほとんどは分解されて、残っていなかったが、色素の誘導量と同じく、ニンニク由来の場合の方がTSの生成量が多いと言う予想外の結果が得られた (図3)。そこで我々は次に、この粗精製のアリイナーゼについて研究を行うことにした。

4.PSAからLFへの変換を触媒する成分 (LFS) の発見と精製
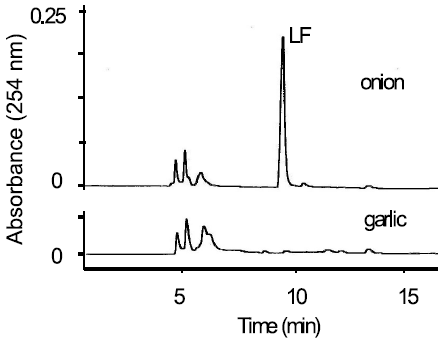
図1に示すように、PRENCSOをアリイナーゼで分解すると、PSAからLFとTSが生成すると報告されていた。PRENCSOがどちらの粗精製のアリイナーゼによっても充分に分解されているにも拘らず、TSの生成量に違いがあったので、次に我々はもう一つの反応生成物であるLFの量を比較した。その結果、PRENCSOをタマネギ由来の粗酵素で分解すると、LFが生成するが、ニンニク由来の粗酵素で分解すると生成しないことに気付いた。また、タマネギ由来でも、精製したアリイナーゼでPRENCSOを分解すると、LFが生成しなくなることを確認した (図4)。

以上の結果から、我々は、「LFが、PRENCSOの分解物であるPSAから非酵素的に生成する」と言う従来の考えは誤りであり、タマネギ由来の粗精製のアリイナーゼ溶液中には、PSAからLFへの変換を触媒するアリイナーゼ以外の他の成分が含まれていると推測しこれを精製することにした。
粗精製のタマネギアリイナーゼ中に含まれる、LFの生成に必須な成分を精製するため、我々は、まずLFを生成させる活性の測定法を考案した。この測定方法は、単独ではPRENCSOからLFを生成しないニンニクアリイナーゼ (精製品) と検定サンプル (タマネギ由来の粗精製のアリイナーゼ溶液を分画した試料) を混合した後、PRENCSOを加えて室温で3分間反応させ、生成したLFをHPLCで定量するというものであり、定量性と再現性に優れていた。さらに考案したLF生成活性を指標にし、図5に示した精製方法を用いて、3種類のタンパク質を活性成分として単離した。また、3種類の活性成分の分子量は、17,000~18,000 であることをTOF MS分析により確認し、分子量の小さい方から順にLFS-1, LFS-2, LFS-3と命名した。
図5 LFSの精製方法
5.LFSの構造解析
N末端アミノ酸分析の結果から、3種類のLFSはN末端の長さだけが異なる構造類似のタンパク質である可能性が高いことが示唆された。そこで我々は、LFSのアミノ酸配列を解析する目的で、LFS遺伝子のクローニングを試みた。タマネギの鱗片からmRNAを抽出し、RT PCRでcDNAを合成した後、LFSのN末端アミノ酸配列に基づいたdegenerateプライマーを用いてRACE (rapid amplification of complementary DNA ends) を行い、LFSのcDNAの取得に成功した。単離したcDNA (GenBank accession No.AB089203) は737 base pairsで、169個のアミノ酸をコードしており、その配列中には3種のLFSのN末端アミノ酸配列が全て含まれていた。3種のLFSの推定アミノ酸配列から計算される分子量が、それぞれをTOF MSで測定した分子量とよく一致したことから、LFSは単純タンパク質であると推測された。以上のことから、LFSをコードする遺伝子は1種類で、3つのアイソザイムは、翻訳後にN末端から取り除かれるアミノ酸残基の数が、わずかずつ異なることによって生じていることがわかった。また、LFSのアミノ酸配列は、既知のタンパク質に対するホモロジーが低く、構造的にも新規のタンパク質である可能性が高いことが示唆された。
我々がクローニングしたcDNAが、LF生成活性を持つタンパク質をコードしていることを確認するため、大腸菌にLFS-3遺伝子を導入し、GSTの融合タンパク質として発現させた。その結果、得られた融合タンパク質にはLF生成活性があることが確認できた。また、GST部分を除去した組換えLFS-3タンパク質について比活性を測定した結果、タマネギから精製したLFS-3と同等であることも確認できた。
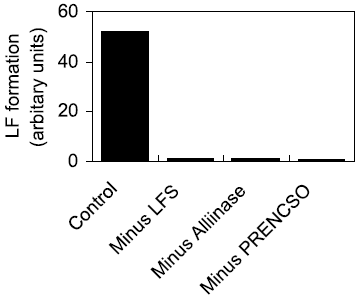
組換え体のLFS-3と精製アリイナーゼ、および精製したPRENCSOの3者を混合すると、LFが生成するが、この3成分のうちどれか1成分でも欠けると、LFは生成しなくなった (図6)。このことから、LFSは、PRENCSOからのLFの生成に必須な成分の一つであることが確認できた6)。次に、この3成分の反応順序を明らかにするため、限外ろ過膜を使用した実験を行った結果、予想通り、PRENCSOがアリイナーゼによって分解されて生じた分子量5,000 以下の成分にLFSが作用することによってLFが生成することが確かめられた。さらに、PRENCSOとアリイナーゼを反応させてから、LFSを作用させるまでの時間を長くすると、LFの生成量が減少した。これらの結果から、LFSの基質は、反応性が高く、不安定なPSAであることが強く示唆された。

6.今後の展開
我々の研究によって、タマネギのLFが、PRENCSOのアリイナーゼ分解産物であるPSAから酵素的に生じていることが明らかになった。したがって、LFSの発現や活性を抑制することで、催涙性が少ない、いわゆる「涙の出ないタマネギ」を作出できる可能性が高まった。「涙の出ないタマネギ」を作出しようとする試みは、これまでにも数多く行われていたが、従来からの作出方法 (PRENCSO含量の少ないタマネギを作る方法や、アリイナーゼ活性の弱いタマネギを作る方法) では、タマネギらしい独特の匂いが犠牲になってしまう。これに対し、LFSの発現や活性を抑制する方法では、PSAからLFへの変換が減少する分、PSAの非酵素的縮合産物であるTSが増加すると考えられる。TSは新鮮なタマネギの匂いの主要成分であり、TSから誘導されるジスルフィド化合物やトリスルフィド化合物は、調理されたタマネギの匂い成分であると報告されている7)。したがって、タマネギらしい独特の匂いは、通常のタマネギよりLFSを抑制したタマネギの方が強くなるはずである。さらに、成書8)によれば、ジスルフィド化合物には、コレステロールや脂質の合成に関わる酵素との反応性があること、さらに、血漿中のコレステロールレベルや動脈中の脂質の蓄積レベルを低下させる作用があることなどが報告されている。また、トリスルフィド化合物には強力な血小板凝集抑制作用があることも報告されている。今後は、LFSの発現や活性を制御することで、催涙性の抑制と、独特の匂い成分や生理活性成分量の増大を実現した、高付加価値タマネギの作出が進むものと期待される。
7.おわりに
タマネギやニンニクに含まれるアリイナーゼに関しては、酵素の精製9)や酵素学的特性9)をはじめ、遺伝子10)やタンパク質の立体構造11)に至るまで、さまざまな研究が行われていた。しかし、意外なことにPRENCSOを精製したアリイナーゼで処理したと言う報告は非常に少なかった。これは、有機化学を専門にする研究者にとって、PRENCSOをタマネギから抽出したり合成したりすることは簡単だったが、精製したアリイナーゼを得ることは難しく、逆に酵素を専門にする研究者にとっては、アリイナーゼを精製することは簡単でも、PRENCSOを準備することが難しかったためだと想像される。また、酵素反応に伴って生成するピルビン酸を測定する「アリイナーゼの活性測定法」がすでに確立されていたため12)、PRENCSOにアリイナーゼを作用させた文献でも、ピルビン酸だけが測定され、LFやTSの測定は行われていなかった。こうした、さまざまな偶然が重なったため、LFはPRENCSOをアリイナーゼで分解するだけでは生じないということが見逃されていたものと思われる。
我々は、酵素の分野でも有機化学の分野でも、先進的な技術は持っていなかったが、色々な分野の基本的な技術だけは持っていた。このことが、LFSの発見という幸運とめぐり合えた原因かも知れないと感じている。LFSの論文6)が発表されたあと、「彼らが行った研究は、Old Fashionであるが、発見した内容は、非常に新しい」と言うコメントを、報道記事の中に見つけた。本当に嬉しい限りである。
謝辞
本報で紹介した、緑変機構の解明研究は、京都大学大学院農学研究科教授、伏木亨先生との共同研究による成果である。また、LFSの発見に関する研究は、東京大学大学院理学系研究科教授、長田敏行先生、ならびに、石川県立大学生物資源工学研究所教授、熊谷英彦先生との共同研究による成果である。これらの研究に参加、協力いただいた方々に深く感謝いたします。
文献
1) Block, E., Penn, R. E., Revelle, L. K.: J. Am. Chem. Soc., 101, 2200 (1979).
2) Yamaguchi, M., Shannon, S., Howard, F. D., Joslyn, M. A.: Proc. Am. Soc. Hort. Sci., 86, 475 (1965).
3) Shannon, S., Yamaguchi, M., Howard, F. D.: J. Agric. Food Chem., 15, 417 (1967).
4) Shannon, S., Yamaguchi, M., Howard, F. D.: J. Agric. Food Chem., 15, 423 (1967).
5) Imai, S., Akita, K., Tomotake, M., Sawada, H.: IFT Annual Meeting: Book of Abstracts, 93 (1996).
6) Imai, S., Tsuge, N., Tomotake, M., Nagatome, Y., Sawada, H., Nagata, T., Kumagai, H.: Nature, 419, 685 (2002).
7) Brondnitz, N. H., Pollock, C. L., Vallon, P. P.: J. Agric. Food Chem., 17, 760 (1969).
8) Augusti, K. T.: Onion and Allied Crops Vol. 3, 93, CRC Press, Inc., Boca Raton, Florida, USA. (1990).
9) Nock, L. P., Mazelis, M.: Arch. Biochem. Biophys., 249, 27 (1986).
10) Van Damme, E. J., Smeets, K., Torrekens, S., Van Leuven, F., Peumans, W. J.: Eur. J. Biochem., 209, 751 (1992).
11) Kuetter, E. B., Hilgenfeld, R., Weiss, M. S.: J. Biol. Chem., 277, 46402 (2002).
12) Schwimmer, S., Weston, W. J.: J. Agric. Food Chem., 9, 301 (1961).