【トピックス】
D-Alanine-D-alanine ligase を利用したD-アミノ酸ジペプチドの合成
木野邦器
早大・理工・応化
1.はじめに
ペプチドは抗生物質やシグナル分子として自然界に多く見出され、その多様な機能から医薬品のリード化合物や機能性食品として用途開発が進められている。これら天然のペプチドの多くはL-アミノ酸で構成されているが、近年明らかになってきたD-アミノ酸の生理的意義を踏まえると、D-アミノ酸から構成されるあるいはD-アミノ酸を含有するペプチドでは、その機能多様性が増大し、新たな用途開発の可能性を提供するものと期待される。
D-アミノ酸ペプチドは専ら有機合成法によって生産されているが、煩雑な反応プロセスとそれに伴う基質のラセミ化が問題となっている。これに対して、基質特異性の高い酵素を用いる方法は、反応に関与しない活性官能基に必ずしも保護基を導入する必要がない等、化学合成法よりも優れた点を有しており、また省エネ・低公害型プロセスとしても注目されている。
D-アミノ酸ペプチドの酵素合成に関する研究は、今までに微生物のD-アミノ酸含有ペプチド加水分解酵素の活性を利用した方法が検討されている。浅野らは、D-立体特異的ぺプチダーゼ生産菌であるOchrobactrum anthropi CI-38株由来のD-アミノペプチダーゼを利用してD-AlaのメチルエステルからD-Alaオリゴマーの合成1)を、またBacillus cereus DF4-B株由来のアルカリD-ペプチダーゼを利用してD-PheのメチルエステルやアミドからD-Pheオリゴマーの合成2)を報告している。また、杉原らは、Bacillus mycoides 由来のα-アミノ酸エステラーゼを利用してD-芳香族アミノ酸のメチルエステルから2~6アミノ酸残基の各オリゴマーの合成を報告している3)。当該酵素はL-アミノ酸アミドを基質として、D,L-アミノ酸の混在するジペプチド (Ac-D-Phe-L-Leu-NH2, Ac-D-Phe-L-Leu-NH2) の合成も可能であるなど、他の酵素にはない特徴を有している。さらに彼らは、Saccharothrix sp. AS-2 株由来の新規アミノアシルトランスフェラーゼを用いたD-アミノ酸オリゴマーの合成も検討し、D-Aspを含むD-アミノ酸メチルエステルからペプチド鎖長の異なるD-アミノ酸ペプチドを収率24%で合成している4)。
しかしながら、上記の酵素を用いたD-アミノ酸ペプチド合成では、基質となるアミノ酸の誘導体化が必要であったり、重合度の異なる生成物等が混在したり、生成物の分解を抑制するための複雑な反応条件の設定が必須であるなど、一般的なD-アミノ酸ペプチド合成法として利用するにはまだ多くの課題がある。
最近、著者らは微生物のペプチドグリカン合成に関わる酵素D-alanine-D-alanine ligase (EC 6.3.2.4, D-alanylalanine synthetase) が従来知られていなかった多くの遊離のD-アミノ酸を基質とすること、ならびに当該酵素を利用することで多種類のジペプチド合成が可能であることを見出した。さらに、微生物起源の異なる酵素や反応条件との組み合わせで、その基質特異性や反応性が変化することも見出している。本稿では、D-alanine-D-alanine ligase の基質特異性や当該酵素を用いたD-アミノ酸ジペプチド合成に関する著者らの最近の研究データを紹介する。
2.D-Alanine-D-alanine ligase とバンコマイシン耐性腸球菌
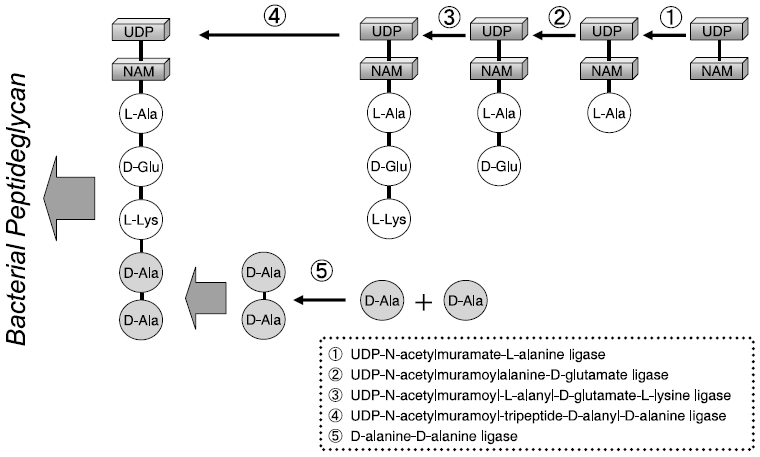
D-Alanine-D-alanine ligase (Ddl) は、遊離のD-Ala 2分子を連結する反応を触媒し、微生物のペプチドグリカン合成に関わる重要な酵素として細菌に広く存在している (図1)。因みにバンコマイシンは、細菌 (とくにグラム陽性菌) のこの特性に着目して開発された有望な院内感染菌MRSA対応抗菌剤である。すなわち、バンコマイシンはD-alanyl- D-alanine に特異的に結合して細胞壁 (ペプチドグリカン) 構成成分に構造変化を引き起こし、これが細胞壁の一部として取り込まれるのを阻害することにより抗菌活性を示す。ところが、バンコマイシンに対して耐性を獲得した腸球菌 (VRE) では、D-alanyl-D-alanineがD-alanyl-D-lactate (乳酸塩) に変化したためにバンコマイシンは結合できず抗菌活性を失うことが知られている。これは、VRE由来のDdlが基質としてD-lactateを認識するように変化したからであり、当該変異DdlはD-ala-D-Ser合成活性を触媒することも報告されている5)。Buggらは6)、変異型Ddlの一つであるVanAの基質特異性を詳細に検討し、生成するジペプチドのC末端側にD-NorLeucine, D-NorValine, D-Met, D-Pheが連結されることをTLC分析レベルで示している。またコントロールとした大腸菌由来のDdlでもD-MetやD-PheがD-Alaに連結され、D-Ala-D-MetとD-Ala-D-Pheが合成されることを報告している。さらに、これらDdl変異体の解析の一環として大腸菌由来のDdlBを対象とした部位特異的変異導入がParkらによって検討されている。DdlBの立体構造とVanAの配列情報から2ヶ所の変異導入部位 (Y216, S150) を決定し、これら変異酵素がD-lactateをN末端もしくはC末端に連結する活性を有することを速度論的なパラメータを用いて検証している7)。
図1 細菌のペプチドグリカン合成と関連酵素
以上の研究はいずれも薬理学的見地からのVREの解析を主体にしたものであり、またDdlの基質特異性に関しては、変異体によって若干の変化があるもののいずれもC末端側に連結する基質に限定されるものであった。
そこで、当該酵素が微生物に広く存在することと微生物酵素の多様性を期待して、著者らは基質特異性の異なる新規Ddlの探索を実施した。
3.各種微生物起源のDdlの高発現と基質特異性
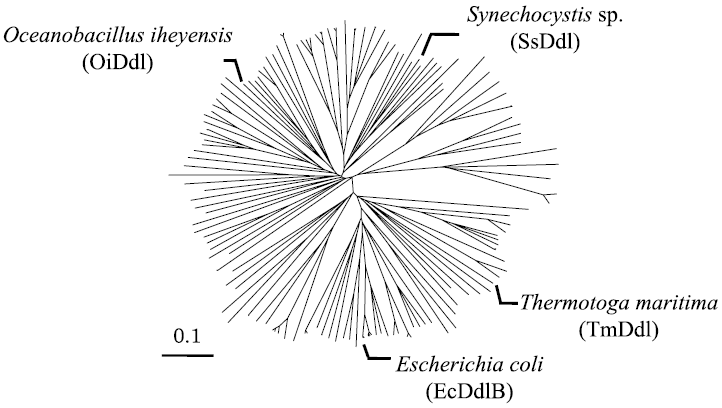
Ddlの進化系統樹 (図2) の結果を踏まえて、ゲノムが公開されている微生物からEscherichia coli K 12 (EcDdlB)、Oceanobacillus iheyensis JCM 11309 (OiDdl)、Synechocystis sp. PCC 6803 (SsDdl)、Thermotoga maritima ATCC 43589 (TmDdl) の4種類の微生物を選択し、そのddl をクローニングの対象とした。
図2 Ddlの進化系統樹とクローニングした4種類のDdlの位置
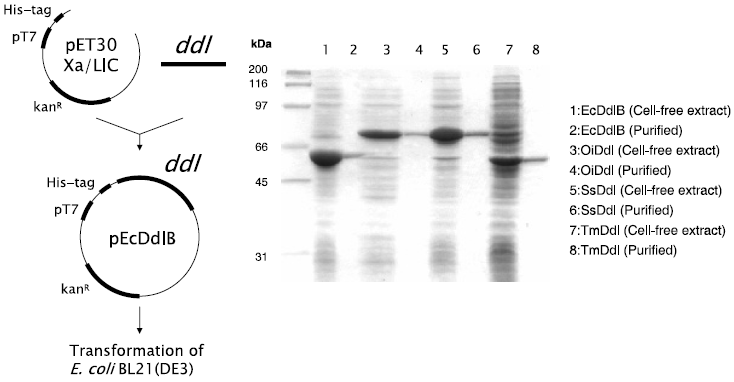
これらのゲノムDNAを鋳型としたPCRによりddlをそれぞれ増幅し、pET30 Xa/LICに連結したプラスミドをE. coli BL 21 (DE3) に導入して、ddl高発現組換え株を作成した。SDS-PAGEの結果から、いずれもHisタグ融合タンパク質として可溶性発現することが確認され、Ni2+アフィニティークロマトグラフィーおよび脱塩処理を施したサンプルを精製酵素として以下の検討に用いた (図3)。
図3 微生物起源の異なる4種類のDdlの大腸菌での発現と精製
Ddlの酵素活性は、ジペプチド合成反応の副生成物であるリン酸の遊離量を市販のキット (Determinar L IP®: KYOWA MEDEX) を用いて定量して、その値を活性値とした。実際には、100μg/ml Ddl、25 mM D-アミノ酸、12.5 mM ATP、12.5 mM MgSO4を含む100μ l の反応液を調製し、37℃でジペプチド合成反応を行いDdlの酵素活性を遊離リン酸量として測定した。また、HPLC、NMRおよびMSを用いて反応生成物の構造確認も行った。
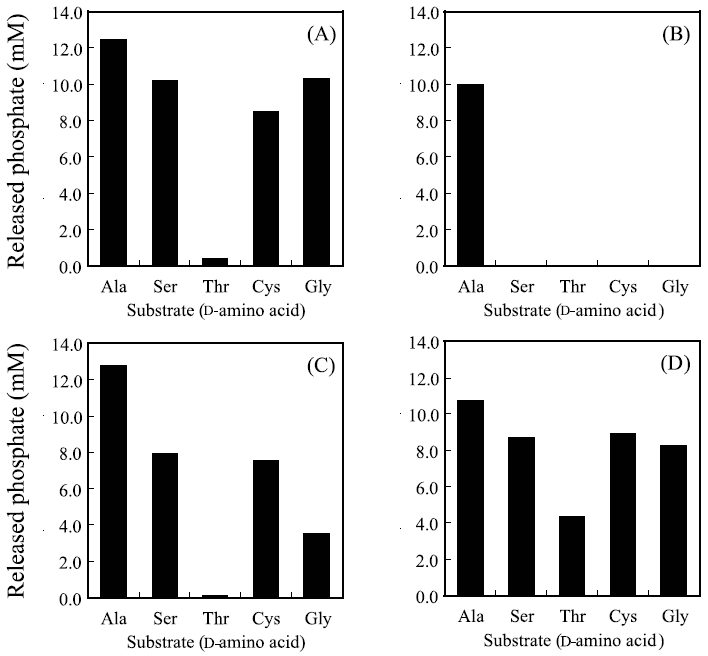
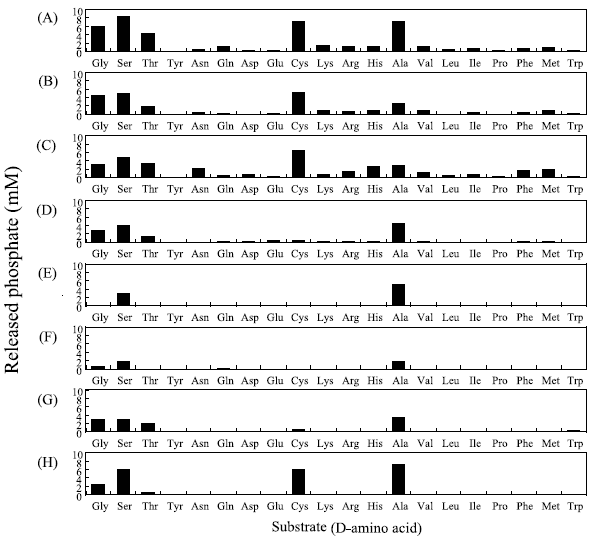
図4には、4種類のDdlについてGlyを含む20種類のD-アミノ酸をそれぞれ基質とした場合のリン酸遊離量を示した。OiDdlではD-Alaを基質とした場合にのみリン酸が遊離するのに対して、EcDdlB、SsDdl、TmDdlにおいては、D-Alaに加え、D-Ser、D-Thr、D-Cys、Glyを基質とした場合にも活性に差はあるもののリン酸の遊離が認められ、それぞれD-alanyl-D-alanine、D-seryl-D-serine、D-threonyl-D-threonine、D-cysteinyl-D-cystein、glycyl-glycineが生成していることが示唆された。実際に、これらの反応生成物の構造をHPLC、NMR、MSにより決定し、それぞれ対応するD-アミノ酸からD-アミノ酸ホモジペプチドが生成していることを確認した8)。
![]()
VREの変異型DdlがC末端側にD-AlaではなくD-Serを連結することは上述のように既に報告されているが、VRE以外の微生物のDdlがC末端側だけではなくN末端側にもD-Ser、D-Thr、D-Cys、Gly が挿入される基質特異性のあることを明らかにしたのは本研究が初めてとなる。
さらに、D-AlaとD-Serの混合基質に対しEcDdlBを用いて反応させると、D-alanyl-D-alanineやD-seryl-D-serine以外にD-alanyl-D-serineも生成する9)。これは、Ddlがホモジペプチドのみならずヘテロジペプチド合成にも幅広く利用できる可能性を示唆している。なお、この場合予想されるジペプチド生成量は等量ではなく、またD-seryl-D-alanine の生成は確認できなかった。これは、生成するヘテロジペプチドにおけるD-アミノ酸の結合順序がDdlに存在する2つの基質結合部位の基質親和性の違いによるものと推察できる。したがって、基質特異性の異なる新規Ddlの探索や改変などによって、希望するヘテロジペプチドの合成も可能になると思われる。なお、この反応系においてはトリペプチドやテトラペプチドの生成は確認できていない。
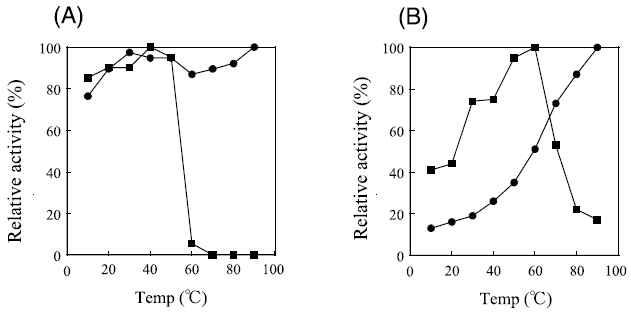
4.好熱性細菌由来TmDdlの特性解析10)
基質特異性が最も広かった好熱性細菌T. maritima ATCC 43589由来のTmDdlの特性をさらに検討した。
まず、TmDdlの温度安定性と反応最適温度をE. coli 由来EcDdlBと比較した。温度安定性は各温度で15分間インキュベート後、D-Alaを基質として37℃で20分間反応させ、生成するD-alanyl-D-alanine量を遊離リン酸の定量によって評価した。また、反応最適温度はD-Alaを基質として各温度で20分間反応させ、D-alanyl-D-alanineの生成量をHPLCにて直接定量することで評価した。図5より、EcDdlBが60℃から急激な活性の低下を示すにも関わらず、TmDdlは90℃まで活性の低下は認められなかった。TmDdlが好熱菌由来のDdlであることから、この結果は十分予想されることではあるが、高温域での反応温度が比較的自由に設定できることから物質生産に用いる酵素として有利な特性であると思われる。また、最適反応温度を評価した結果、TmDdlは温度の上昇に伴って活性も高まり、90℃までの範囲では最適値を持たなかった。しかしながら反応に必要なATPが80℃を超える高温域では化学的に加水分解を起こすため、その影響をほとんど受けない60℃を反応に適した温度と判断した。
![]()
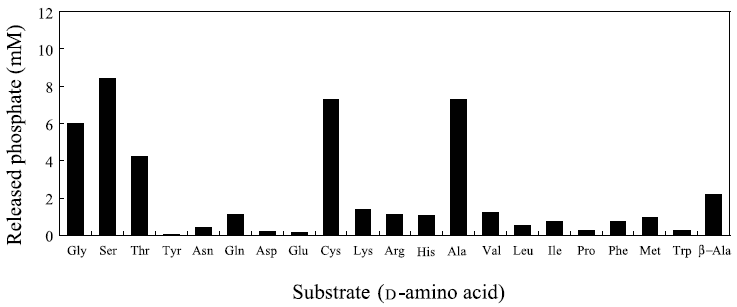
そこで、19種類のD-アミノ酸およびGly、β-Ala をそれぞれ基質として、TmDdlを用いた60℃におけるホモジペプチド合成活性をリン酸の遊離によって評価した。なお、TmDdlは基質となるアミノ酸が存在しない条件でもATPの加水分解活性を示すため、その影響を考慮して反応時間は8時間と定めた。
37℃での反応ではD-Ala、D-Ser、D-Thr、D-Cys、Glyだけが基質となり得たが (図4)、図6に示すように60℃の反応ではD-Gln、D-Lys、D-Arg、D-His、D-Val、D-Leu、D-Ile、D-Phe、D-Met、β-Alaに関しても基質となり得ることを示唆する有意なリン酸の遊離が確認された。しかしながら、37℃での反応で良好な基質であった5種類のアミノ酸を基質とした場合のリン酸の遊離量は他のアミノ酸を基質とした場合に比較して圧倒的に多いことから、60℃での反応による基質特異性の広がりは、活性化エネルギーの増大による反応速度の上昇に起因し、酵素と基質の親和性が変化したことによるものではないと推察している。
図6 60℃におけるTmDdlの基質特異性
一方、error-prone PCRに代表されるように、反応に金属イオンを必要とする酵素のいくつかは他の金属イオンの添加あるいは置換により基質特異性が変化することが知られている。そこで、7種類の2価金属イオン添加による基質特異性を検討した。なお、基質特異性の評価は、反応液に6.25 mMのMgSO4および各種2価金属イオン硫酸塩を6.25 mM添加し、60℃、8時間反応の条件で行った。なお、活性はリン酸の遊離量によって評価したが、添加した金属イオンが酵素非存在下でATPの加水分解を引き起こさないことを確認している。
図7に示すように添加したほとんどの2価金属イオンはTmDdlの反応に阻害的な影響を及ぼすが、Mn2+、Zn2+を添加した場合にはいくつかの基質においてリン酸遊離量の増加が認められる。さらにD-Alaに対する活性を100%とした各基質に対する相対活性がMg2+のみの場合とZn2+を添加した場合とで大きく異なっているため、Zn2+の添加によって酵素と基質の親和性が変化したことが強く示唆される。現在、反応生成物の定量と当該酵素活性における金属イオンとの関係について詳細検討中である。

TmDdlにおいては60℃の反応温度およびZn2+添加という条件を設定することで基質特異性が拡張され、より多様なD-アミノ酸ジペプチド合成が可能になると期待される。
5.EcDdlBを用いたD-アミノ酸ジペプチド生産11)
まず、EcDdlBを用いたD-アミノ酸からのD-アミノ酸ジペプチド生産を検討した。比較的高い活性を示したD-Ala、D-Ser、D-Cys、D-Thr、Glyを基質として40 mMを含む反応液 (100μg/ml EcDdlB、20 mM ATP、20 mM MgSO4、pH8.0) を調製し、37℃でジペプチド生産を実施した。その結果、反応7時間でD-alanyl-D-alanine、D-seryl-D-serine、D-cysteinyl-D-cystein、glycylglycineが、理論合成量20 mMに対しそれぞれ収率71%、71%、60%、77%で生成した。また、2%と低収率ではあるがD-threonyl-D-threonine も生成していた。ペプチダーゼやエステラーゼを用いる合成法のように反応条件の検討を詳細に行うこともなく70%を超える高収率を達成できたことは、Ddlを利用する反応の有効性と実用性を示すものと思われる。
さらに著者らは、当該酵素の立体選択性の高さを利用して安価に供給されるL-アミノ酸を原料とするD-アミノ酸ジペプチドの生産にも成功している。Pseudomonas putida IFO12996由来低基質特異性アミノ酸ラセマーゼ (BAR) との共役反応系を構築し、L-Ala、L-Ser、L-Cysからそれぞれ対応するD-アミノ酸ジペプチドを反応7時間で収率44%、36%、9%で合成することができた9)。D-アミノ酸を原料とする場合に比べ収率は低いものの、L-アミノ酸ジペプチドの副生は認められず、本プロセスではL-アミノ酸のラセミ化とD-アミノ酸ジペプチドの合成を一段階の反応で行うことができる。勿論、原料はDL-混合体を使用することもでき、TmDdlなど有用な酵素への変更も可能である。
ただし、本プロセスでは高価なATPを使用する点が実用上の課題である。著者らは、生成物であるD-アミノ酸ジペプチドがL-アミノ酸ジペプチドに比べ生分解を受けにくいことに着目し、DdlとBARを共発現させた大腸菌の休止菌体を用い、グルコースをエネルギー源とするATP再生系をカップリングさせたプロセスを現在検討している。今後、L-アミノ酸生産菌にDdlとBARを共発現させたり、DdlとBARを共発現させた大腸菌にL-アミノ酸生産能を付与するなどして、糖質原料からの発酵法によるD-アミノ酸ジペプチドの効率的生産プロセスの確立も夢ではないと考えている。
6.おわりに
微生物に広く存在するDdlに従来知られていなかった基質特異性を見出し、それを利用したD-アミノ酸ジペプチドの新規合成法を構築することができた。しかも、微生物起源の異なるDdlが特有の基質特異性を示すなど、当該酵素に関しては多様性や酵素学的な観点からも興味がもたれ、今後も新たな知見が多く得られると考えている。また、これまでの研究を踏まえると、D-アミノ酸のホモジペプチドやヘテロジペプチドだけでなく、非天然型アミノ酸やVRE由来の変異Ddlで報告されているような乳酸などアミノ酸以外の化合物を連結した新規化合物合成の可能性もあると考えている。D-アミノ酸で構成されるペプチドに関しては、自然界に多く見出されていないこともあってL-アミノ酸ペプチドに比べ用途ならびに生理学的な研究が少ないが、本研究で開発されたD-アミノ酸ジペプチドの新規合成法が用途開発研究の進展に貢献できれば幸いである。また、最近協和発酵によって開発された新規L-アミノ酸リガーゼ酵素を用いたL-アミノ酸ジペプチド合成法12)や味の素が開発したエステル転移酵素を利用したL-アミノ酸ジペプチド合成法13)と併せて、短鎖ペプチド研究の新たな展開を期待したい。
文 献
1) Kato, Y., Asano, Y., Nakazawa, A., Kondo, K.: Biocatalysis, 3, 207 (1990).
2) Komeda, H., Asano, Y.: J. Mol. Catal. B: Enzymatic, 6, 379 (1999).
3) Sugihara, A., Shimada, Y., Sugihara, S., Nagano, T., Watanabe, Y., Tominaga, Y.: J. Biochem., 130, 119 (2001).
4) Sugihara, A., Shimada, Y., Sugihara, S., Nakai, T., Kokuno, T., Nagano, T., Watanabe, Y., Tominaga, Y.: J. Biochem., 131, 247 (2002).
5) Healy, V. L., Lessard, I. A. D., Roper, D. I., Knox, J. R., Walsh, C. T.: Chem. Biol., 7, 109 (2000).
6) Bugg, T. D. H., Dutka-Malen, S., Arthur, M., Couvalin, P., Walsh, C. T.: Biochemistry, 30, 2017 (1991).
7) Park, S., Lin, C. H., Walsh, C. T.: Biochemistry, 35, 10464 (1996).
8) 佐藤 大, 木野邦器: 酵素工学研究会第52回講演要旨集, 44 (2004).
9) 佐藤 大, 桐村光太郎, 木野邦器: 日本農芸化学会大会講演要旨集, 119 (2004).
10) Sato, M., Kirimura, K., Kino, K.: J. Biosci. Bioeng., in press (2005).
11) 佐藤 大, 桐村光太郎, 木野邦器: 日本生物工学会大会講演会要旨集, 108 (2004).
12) 国際出願特許:WO2004/058960
13) 国際出願特許:WO2003/010307