【トピックス】
部位特異的タンパク質固定化法 ─最近の展開─
神谷典穂
九大院・工
1.はじめに
タンパク質を適当な担体に固定化して利用する意義はここで改めて述べるまでもない。タンパク質は機能・構造において多種多様であり、用途に応じた多種多様な固定化法が提案されている。ポストゲノム時代における研究者の興味は、タンパク質間相互作用、翻訳後修飾、酵素活性といったタンパク質に特有なイベントの網羅的かつ迅速な解析へと移行している。そのため、極少量の生体試料を効率的に解析することが可能なDNAチップのように、様々なタンパク質が基盤状に固定化されたプロテインチップ1)の開発が注目を集めているが、その達成には、多種類のタンパク質を効率よく取得する方法の確立や、固定化タンパク質の機能保持といった大きな課題がある。タンパク質はDNA (核酸) のように簡便な増幅法もなく、その機能は高次構造に厳密に依存するため、その安定な取り扱いは核酸に比べると難易度が高い。後者の課題を克服すべく、近年、タンパク質の '部位特異的' 固定化法の開発が活発化している。対象とするタンパク質の特定部位を狙い、分子配向を制御して固相上にならべる技術は、プロテインチップやマイクロリアクターのように極少量のタンパク質の機能を有効に活用したい場合や、極めて高活性な固定化酵素の調製ならびにバイオリアクターの設計において威力を発揮する。本稿では、部位特異的タンパク質固定化法の最近の展開について、要素技術を中心に解説する。タンパク質固定化技術の歴史的進展については、巖倉博士の総説2)に詳しく述べられているので参照されたい。
2.非共有結合的・部位特異的固定化
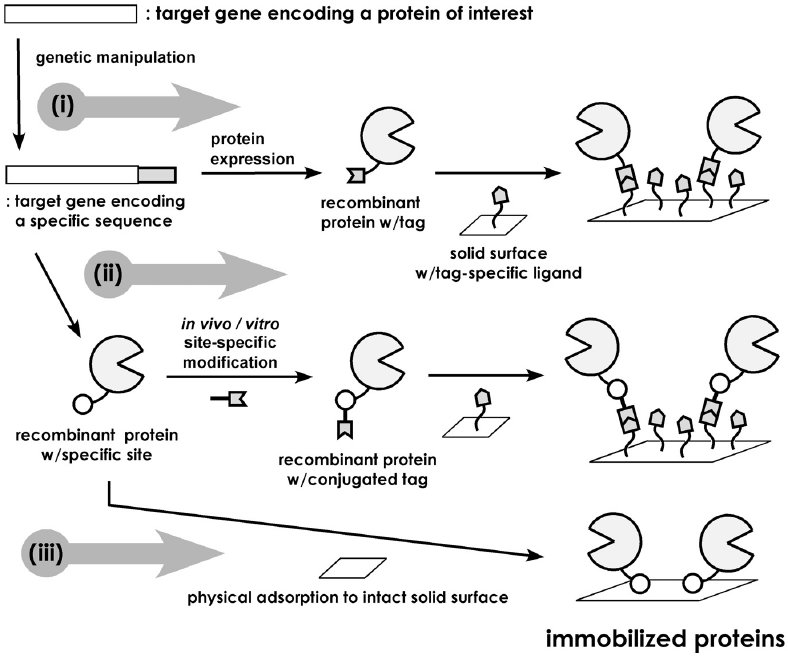
遺伝子組換え技術は、タンパク質の分離精製プロセスの大幅な簡略化を可能にした。すなわち、目的とするタンパク質を組換え体として適当な宿主で発現させる際、特定のリガンドに対して親和性を有するペプチドあるいはタンパク質 (以下、アフィニティータグと略記) を付加して発現し、対応するリガンドを表面修飾した担体を用意しておけば、様々な生理活性物質が存在する生体試料中から目的タンパク質のみを容易に回収することが可能である3)。タンパク質の分離精製を目的として開発された本技術は、アフィニティータグ導入部位でタンパク質を固相上につなぎ留めることができることから、現在、部位特異的な固定化技術としても広く利用されている (図1(i))。このとき、対象タンパク質の高次構造と機能部位が既知であれば、機能発現に影響を与えない部位を選択してタグを導入する必要がある。原理的にはタンパク質主鎖中にアフィニティー部位を導入することも可能であるが、発現タンパク質の機能保持を考慮して、ほとんどの場合、NあるいはC末端が導入部位として選択される。

組換えタンパク質の精製に汎用されるヘキサヒスチジンタグ (His tag) を例に取ると、Zhuらは5800種の酵母タンパク質をHis tag付加体としてクローニングし、Niイオンの配位サイトをその表面に提示したガラススライド上に固定化することで、酵母のプロテインチップを調製している4)。その中で、化学修飾によるランダムな固定化に対するHis tag特異的な固定化の優位性が示されている。しかしながら、His tagを介した固定化では、固相上に担持されたNiイオンの溶離に伴い固定化効率が低減することが知られている。そこで、Niイオンの錯化部位として従来用いられてきたニトリロトリ酢酸の代わりにトリアザシクロノナンを用いると、この問題点が克服可能なことが示されている5)。また、抗His tag抗体をまず固定化しておいて、そこにHis tagが付加されたタンパク質を固定化する方法も試みられているが、この場合には最初に固定化される抗体の配向制御に工夫が必要である6)。
タンパク質の精製におけるアフィニティータグの役割は、タンパク質の一時的な固相への捕捉であるため、それほど強い相互作用は必要とされない。しかし、より安定にタンパク質を固定化したい場合には、より強い相互作用が必要である。ビオチン-アビジン間の解離定数は10-15 Mに及ぶため7)、極めて安定にタンパク質を固定化することが可能である。この相互作用を利用する固定化では、通常アビジンが担体に固定化されることが多いため、固定化対象のタンパク質をいかにして部位特異的にビオチン化するかがポイントとなる。これを達成する手段として、生体内 (in vivo)8)および生体外 (in vitro)9)ビオチン化システムが提案されている (図1(ii))。前者では、対象タンパク質とビオチンリガーゼの基質タンパク質の一部 (75 amino acids, aa) との融合体を大腸菌で発現させることにより、基質タンパク質部位が内在性ビオチンリガーゼにより特異的にビオチン化されたタンパク質を得ている。後者では、タンパク質スプライシング10)を利用して対象タンパク質のC末端をチオエステル化し、ここにビオチン誘導化システインを加えることで、C末端特異的なビオチンラベル化を達成している。最近、後者の手法がinvivo でも機能することが明らかとなり11)、タンパク質特定部位の生体内小分子ラベル化法としても有力な手段となることが示された。また、最近Walshらは、ビオチンリガーゼに代わる酵素反応を利用した新しい部位特異的ビオチン化法を報告している12)。この手法では、CoAの4’-ホスホパンテテイン (P-pant) 基を非リボソーム型ペプチド合成酵素のペプチドキャリアータンパク質 (PCP, 80 aa) に転移する反応を触媒するP-pant転移酵素 (Sfp) が利用された。目的タンパク質をPCPとの融合タンパク質として発現させ、Sfpとビオチン誘導化CoAを加えることで、PCP部位特異的なビオチン化が達成されている。酵素による翻訳後修飾を利用した部位特異的タンパク質修飾法は、穏和な条件下、酵素の厳密な基質認識能力に基づく修飾が可能なため、タンパク質工学分野での応用が今後さらに進むことが予想される。しかしながら、比較的大きなタンパク質性タグが必要となる点に注意が必要である。
一方、一見何ら特異性がないように思えるタンパク質の物理吸着過程を、ペプチドタグの付加によって制御しようとする試みも報告されている (図1(iii))。物理吸着法はタンパク質の固定化における最もシンプルな手法であるが、通常、非特異的な吸着による機能損失は避けられない。Kobatakeらは、構造タンパク質であるelastin由来のヘキサペプチドに着目し、その12回繰り返し配列をグルタミン結合タンパク質のC末端に導入することで、その機能を保持したままポリスチレンプレート上に固定化することに成功している13)。Nakanishiらは、ポリスチレンに親和性を有するペプチドをファージディスプレイシステムにより取得し、これをモデルタンパク質 (glutathione S-transferase, GST) のC末端に導入することで、ポリスチレンへのGST固定化における活性保持率の大幅な向上に成功している14)。コンビナトリアル化学を利用して様々な担体に特異的かつ不可逆的に吸着するペプチドを取得することで、広範な担体に対して応用可能な部位特異的タンパク質固定化法となる可能性を秘めており、今後の展開が期待される。
3.共有結合的・部位特異的固定化
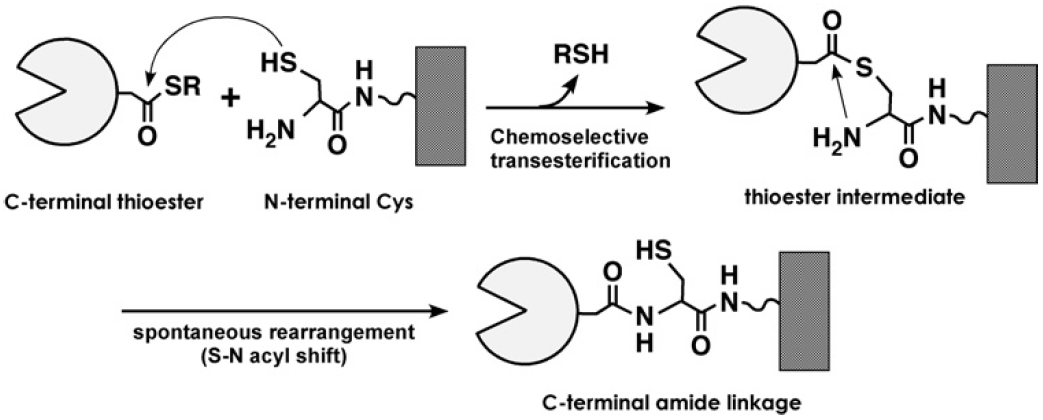
有機化学的手法に基づきタンパク質を固定化する場合、分子表面に存在するアミノ基 (Lys残基側鎖、N末端アミノ基)・水酸基 (Ser・Thr残基側鎖)・カルボキシル基 (Glu・Asp 残基側鎖) といった官能基と、これらに反応性を有する適当な官能基を表面に提示した担体が用いられる。そのメリットの1つはタンパク質-担体間の共有結合形成による高い安定性であるが、タンパク質と担体表面の反応は無差別 (すなわち、非特異的) に進行するため、目的とする機能に影響を与えることが多い。そのため、共有結合を介したタンパク質固定化においても、アミノ酸残基選択的な手法から部位特異的な手法へと研究開発の主眼はシフトしている。ところが、タンパク質の特定部位に存在する官能基を狙って、水溶液中、室温条件下で、効率よく共有結合を形成させるのはなかなか難しい。これまで、Cys残基側鎖のチオール基の反応特異性は、この目的によく利用されてきた。C末端にCys残基を有するペプチドタグを付与した組換えアビジンを調製し、これをマレイミド基が表面修飾された固相に固定化した例では、野生型アビジンを物理吸着させた場合に比べ、ビオチン化タンパク質をより効果的に固定化可能なことが示されている15)。Cys残基を利用した新たな部位特異的タンパク質固定化法として、シアノシステインを介した1級アミンとの分子間アミド結合形成反応16)を利用する手法がある。この手法の特徴は、アミノ酸残基側鎖ではなく、タンパク質主鎖を介したC末端特異的な固定化が可能な点にある17)。しかしながら、これらの手法は、Cys残基を複数有するタンパク質に対してはそのまま応用できないという制限があるため、何らかの工夫が必要である2)。また、前節で触れたタンパク質スプライシング10)を利用する場合、基盤表面にCys残基を提示することによりC末端特異的な固定化が達成されている18) (図2)。
![]()
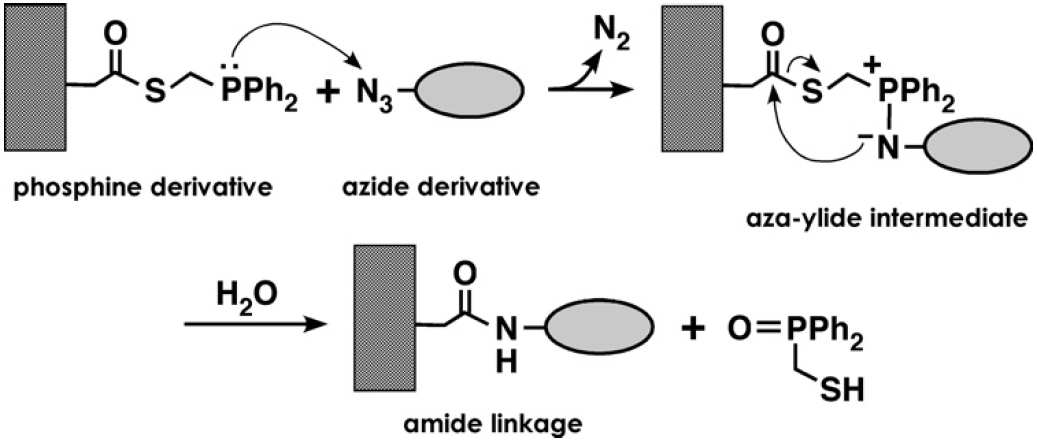
そのほかの有機化学的アプローチの1つとして、最近、ホスフィン-アジド間の共有結合形成を介した改変型Staudinger反応によるアミド結合形成反応19)の利用が検討されている。この手法は、現時点ではペプチドの固定化に応用されているのみであるが、固定化されたペプチドに高い親和性を有するタンパク質の固定化が可能であることが示されている20)(図3)。また、対象タンパク質にアジド基を有する非天然型アミノ酸 (アジドホモアラニン) を導入することで、上記反応による部位特異的な修飾も可能なことから21)、タンパク質の部位特異的固定化への応用も十分可能であると考えられる。
図3 改変型Staudinger反応を介した共有結合的固定化20)
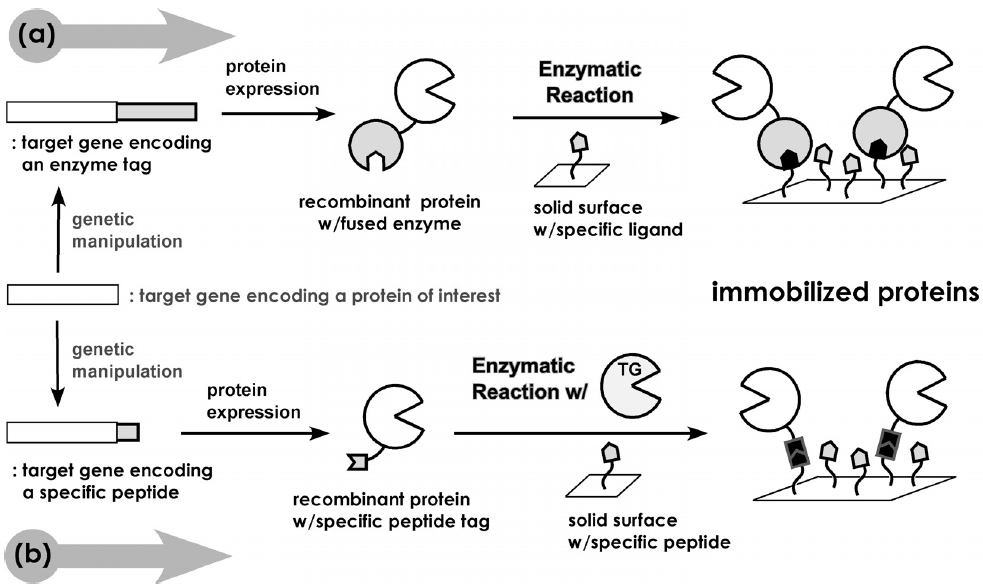
一方、タンパク質の固定化に酵素反応を利用しようとする興味深い試みもある。酵素反応の特徴である穏和な条件下での厳密な基質特異性を利用すれば、目的タンパク質の機能を損なうことなく、部位特異的な固定化が可能となる。Johnssonらは、DNA修復系で働くヒト由来O6-アルキルグアニン・アルキル転移酵素 (hAGT, 207aa) を利用している22)。hAGTは、O6-アルキルグアニンのアルキル基を自身のチオール基に転移させる反応を触媒する。彼らは、この反応の不可逆性に着目し、目的タンパク質をhAGTとの融合タンパク質として発現させ、O6-ベンジルグアニン誘導体で表面修飾された固相に加えることで、hAGT部位特異的な固定化に成功している。Mrksichらは、セリンエステラーゼの一種であるCutinase (Cut, 199 aa) がホスホン酸エステルとの反応により不可逆的に失活することを利用し、目的タンパク質をCutとの融合タンパク質として発現させ、ホスホン酸エステルが表面修飾された固相と組み合わせることで、Cut 活性部位のSer残基 (Ser120) 特異的な固定化を達成している23)。これらの手法は、酵素反応における不可逆的な阻害反応に着目しており、酵素そのものをタグとして利用した点で新規な手法であるが、タグのサイズは共に20 kDa程度とかなり大きい (図4(a))。

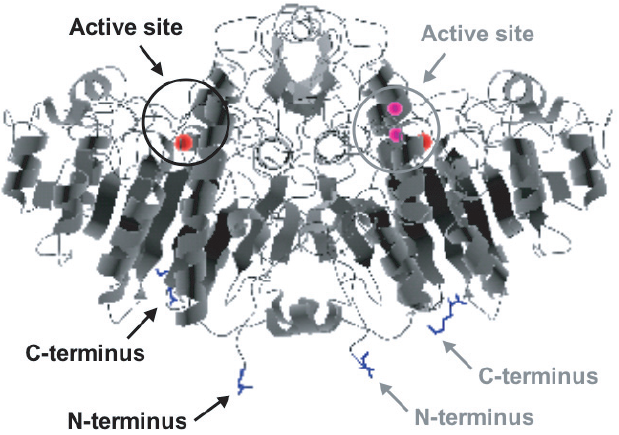
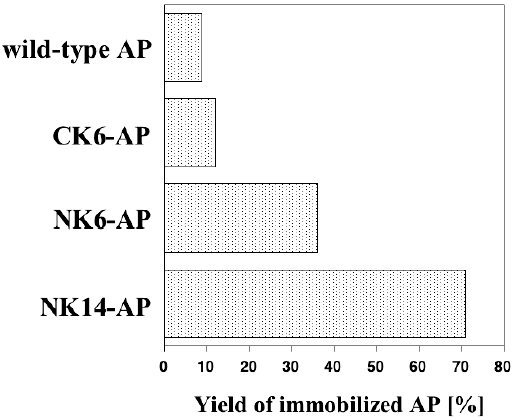
最近、筆者らは、Gln残基とLys残基の側鎖を共有結合的に架橋化するトランスグルタミナーゼ (TG) を利用したタンパク質固定化法を提案している24,25)。これまで、TGを用いたタンパク質固定化法はいくつか報告されているが、すべてnative酵素が用いられており、その形態は包括型26,27)か、あるいは適当な担体に物理吸着させた後、架橋化処理を施す手法28,29)が取られていた。そこで筆者らは、TGのペプチドタグ選択的タンパク質架橋化能力30)をより積極的に活用するため、TGの基質ペプチドを目的タンパク質のNあるいはC末端に導入することにより、導入ペプチドを介した共有結合的固定化を試みた (図4(b))。大腸菌由来のアルカリホスファターゼ31) (AP,図5) をモデルとした検討においては、反応性Lys残基を含む僅か6残基からなるペプチドタグ (MKHKGS) をN末端に付加し、反応性Gln残基に富む基質タンパク質であるカゼインにより表面修飾を施した担体を調製することで、ペプチドタグ特異的なAPの固定化が可能であった24,25)。TGを利用する共有結合的固定化法は、前述のペプチドタグを利用する利点と、酵素反応を利用する利点とを併せ持つ点で、既往の手法に勝ると考えている。本手法をさらに発展させるためには、TGの基質認識に最適なペプチド配列の取得と、その導入部位の最適化が必須であるが、最近、後者が固定化効率に大きな影響を与えることを見出している (図6)。また、TGはLys残基の代わりに様々な1級アミンも基質として認識するため、本固定化法は極めて汎用性の高い技術になる可能性を秘めている。
![]()

4.おわりに
タンパク質の固定化技術は、タンパク質機能を安定に利用するための基盤技術である。本稿では、固定化されるタンパク質側に注目して提案された手法のいくつかを紹介したが、そのほとんどは遺伝子工学的手法による組換えタンパク質調製技術の発展に負うところが大きい。一方、高機能な固定化タンパク質材料を得るためには、競合する非特異的吸着を最小化すると同時に部位特異的固定化を達成する必要があるため、当然のことながら固定する担体側の材質ならびにその表面処理法も極めて重要である。この点において、固定化酵素32)の研究開発において蓄積されたknow-howが様々な場面で活かされていることを実感する。多量体タンパク質や膜タンパク質を安定に固定化するための技術開発も急務であり、これを実現するためには、より学際的なアプローチが必要であろう。筆者は、有機化学・遺伝子工学・タンパク質工学的なアプローチに、酵素工学のエッセンスを加えることで、タンパク質機能を最大限に活用可能な新しいタンパク質固定化技術を開発し、酵素・タンパク質工学分野の進展に微力ながら貢献できればと考えている。
謝辞
TGを用いたタンパク質固定化の研究成果は、当研究室の富永譲氏、土居智氏によるものです。TGの諸特性について、味の素(株)の研究者の方々に多くの有益なご助言を賜りました。本研究は、主として日本学術振興会科学研究費補助金ならびに長瀬科学技術振興財団研究助成を受けて行われました。記して心より感謝の意を表します。
文献
1) Kambhampati, D.: in Protein microarray technology, WILEY-VCH, 1 (2003).
2) 巖倉正寛:バイオサイエンスとインダストリー, 60, 587 (2002).
3) Hearn, M. T. W., Acosta, D.: J. Mol. Recognit., 14, 323 (2001).
4) Zhu, H., et al.: Science, 293, 2101 (2001).
5) Johnson, D. L., Martin, L. L.: J. Am. Chem. Soc., 127, 2018 (2005).
6) Sasakura, Y., et al.: Anal. Chem., 76, 6521 (2004).
7) Livnah, O., Bayer, E. D., Wilcheck, M., Sussman, J. L.: Proc. Natl. Acad. Sci. USA, 90, 5076 (1993).
8) Cronan, J. E.: J. Biol. Chem., 265, 10327 (1990).
9) Lesaicherre, M.-L., Lue, R. Y. P., Chen, G. Y. J., Zhu, Q., Yao, S. Q.: J. Am. Chem. Soc., 124, 8768 (2002).
10) Muir, T. W., Sondhi, D., Cole, P. A.: Proc. Natl. Acad. Sci. USA, 95, 6705 (1998).
11) Lue, R. Y. P., Chen, G. Y. J., Hu, Y., Zhu, Q., Yao, S. Q.: J. Am. Chem. Soc., 126, 1055 (2004).
12) Yin, J., Liu, F., Li, X., Walsh, C. T.: J. Am. Chem. Soc., 126, 7754(2004).
13) Wada, A., Mie, M., Aizawa, M., Lahoud, P., Cass, A. E. G., Kobatake, E.: J. Am. Chem. Soc., 125, 16228 (2003).
14) Sakiyama, T., Ueno, S., Imamura, K., Nakanishi, K.: J. Mol. Catl. B: Enzym., 28, 207 (2004).
15) Reznik, G. O., Vajda, S., Cantor, C. R., Sano, T.: Bioconjugate Chem., 12, 1000 (2001).
16) Takenawa, T., Oda, Y., Ishihama, Y., Iwakura, M.: J. Biochem., 123, 1137 (1998).
17) 巖倉正寛:酵素工学ニュース,43,23 (2000).
18) Camarero, J. A., Kwon, Y., Coleman, M. A.: J. Am. Chem. Soc., 126, 14730 (2004).
19) Saxon, E., Bertozzi, C. R.: Science, 287, 2007 (2000).
20) Sollner, M. B., Dickson, K. A., Nilsson, B. L., Raines, R. T.: J. Am. Chem. Soc., 125, 11790 (2003).
21) Kiick, K. L., Saxon, E., Tirrell, D. A., Bertozzi, C. R.: Pro. Natl. Acad. Sci. USA, 99, 19 (2002).
22) Kindermann, M., George, N., Johnsson, N., Johnsson, K.: J. Am. Chem. Soc., 125, 7810 (2003).
23) Hodneland, C. D., Lee, Y.-S., Min, D.-H., Mrksich, M.: Pro. Natl. Acad. Sci. USA, 99, 5048 (2002).
24) Tominaga, J., Kamiya, N., Doi, S., Ichinose, H., Goto, M.: Enzyme Microb. Technol., 35, 613 (2004).
25) Kamiya, N., Doi, S., Tominaga, J., Ichinose, H., Goto, M.: Biomacromolecules, 6, 35 (2005).
26) Motoki, M., Aso, H., Seguro, K., Nio, N.: Agr. Biol. Chem., 51, 997 (1987).
27) Josten, A., Meusel, M., Spener, F., Haalck, L.: J. Mol. Catal. B: Enzym., 7, 57 (1999).
28) Kamata, Y., Ishikawa, E., Motoki, M.: Biosci. Biotech. Biochem., 56, 1323 (1992).
29) Kawakita, H., Sugita, K., Saito, K., Tamada, M., Sugo, T., Kawamoto, H.: Biotechnol. Prog., 18, 465 (2002).
30) Kamiya, N., Tanaka, T., Suzuki, T., Takazawa, T., Takeda, S., Watanabe, K., Nagamune, T.: Bioconjugate Chem., 14, 351 (2003).
31) Kim, E. E., Wyckoff, H. W.: J. Mol. Biol., 218, 449 (1991).
32) 千畑一郎:固定化酵素,講談社 (1975).